Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основні діаграми стану подвійних системСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Властивості сплаву залежать від багатьох факторів, але перш за все вони визначаються складом фаз та їх кількісним співвідношенням. Ці відомості можна одержати за допомогою аналізу діаграм стану. Знання діаграм стану дає можливість уявити формування структури всіх сплавів, визначити оптимальну температуру заливки сплаву для одержання литої деталі, оцінити рідкотекучість вибраного сплаву і можливість одержання хімічної неоднорідності; зробити висновок стосовно можливості й умови обробки тиском.
Діаграма стану у випадку повної розчинності компонентів в рідкому і твердому станах. Правіло відрізків.
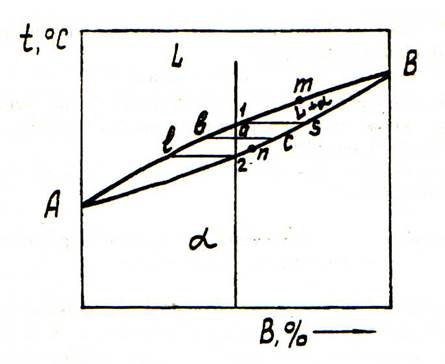
Обидва компоненти необмежено розчинені у рідкому та твердому станах, але не утворюють хімічну сполуку. Компоненти: А, В. Фази: L, α. Якщо два компоненти необмежено розчиняються у рідкому і твердому станах, можливе існування тільки двох фаз – рідкого розчину L і твердого розчину α. Діаграма складається з трьох областей: рідина, рідина і твердий розчин, твердий розчин. Лінія AmB називається лінією ліквідус, а лінія AnB – лінією солідус. Точка 1 відповідає початку кристалізації, точка 2 – закінченню. Між точками 1 і 2 (тобто між лініями ліквідус і солідус) сплав перебуває у двохфазному стані.
Рис. 1. Діаграма стану сплавів, компоненти яких розчинені в рідкому і твердому станах
Якщо існують два компоненти і дві фази, система моноваріантна, тобто, якщо змінюється температура, то змінюється і концентрація у фазах; кожній температурі відповідають певні склади фаз. (c=k-f+1=2-2+1) Концентрація і кількість фаз сплаву, який знаходиться між лініями солідус і ліквідус, визначається правилом відрізків. Так, сплав 1 у точці складається з рідкої і твердої фаз. Склад рідкої фази визначається проекцією точки, яка лежить на лінії ліквідус, а твердої – проекцією точки с, яка лежить на лінії солідус. Кількість рідкої і твердої фаз визначається співвідношеннями: кількість рідкої фази – ac/bc, кількість твердої фази – ab/bc.
Правило визначення складу фаз (правило концентрацій): для визначення концентрацій компонентів у двох фазах через точку, яка характеризує стан сплаву, проводять горизонтальну лінію (коноду) до перетину з лініями, які обмежують дану область; проекції точок перетину на горизонтальну вісь діаграми покажуть склади фаз.
Правило визначення кількісного співвідношення фаз (правило відрізків). Через дану точку проводять горизонтальну лінію. Відрізки цієї лінії (коноди), які визначають склад фаз, обернено пропорціональні кількості цих фаз: L/a=ac/ab. Якщо треба визначити кількість тієї чи іншої фази, всю коноду вважають за 100 % сплаву, кількість рідкої фази (як у нашому випадку) розраховують як ac/bc ×100%, твердої – ab/bc ×100 %. Ці правила справедливі для двофазної області діаграми стану і не мають сенсу в однофазній області.
Діаграма стану сплавів з обмеженою розчинністю компонентів у твердому стані Обидва компоненти необмежено розчинні у рідкому стані, обмежено у твердому і не утворюють хімічних сполук. В таких сплавах можлива нонваріантна рівновага, якщо одночасно існують три фази: L, α, β. Залежно від того, яка реакція здійснюється в умовах існування трьох фаз, можуть бути два види діаграм: діаграма з евтектикою та діаграма з перитектикою.
Діаграма з евтектикою Компоненти: А.В. Фази: L – рідка фаза, α – твердий розчин компонента В у компоненті А; β – твердий розчин компонента А у компоненті В. У цій системі не утворюються фази, що являють собою чисті компоненти. З рідини можуть виділятися тільки тверді розчини α і β. Лінія DF – показує граничну розчинність компонента В у А. Лінія CG – граничну розчинність компонента А у В. Сплави, які розмістилися між цими лініями за межею розчинності складаються з двох фаз α+β.
Рис. 2. Діаграма з евтектикою
Лінія AEB цієї діаграми називається лінією ліквідус; лінія ADECB – лінією солідус. За допомогою правила фаз та правила відрізків можна простежити за процесом кристалізації будь-якого сплаву. Евтектикою називають структуру, яка складається з певного поєднання двох (або більше) твердих фаз, що одночасно кристалізуються з рідкого сплаву. Сплави, в яких відбувається одночасна кристалізація двох (або більше) фаз при постійній і найнижчий для даної системи температур, називають евтектичними. Ті сплави, які лежать лівіше точки Е, називають доевтектичними, правіше – заевтектичними. Якщо відбувається евтектичне перетворення, рідина кристалізується з утворенням двох твердих фаз. Діаграма з перитектикою Перитектичне перетворення спостерігається у багатьох промислових сплавах, наприклад, у сплавах Fe-C (до 0,51 %С), Cu-Zn, Cu-Sn. На відміну від евтектичного перетворення можливий і інший тип нонваріантного перетворення (трифазової рівноваги), коли рідина взаємодіє з кристалами, які раніше випали, і утворює новий вид кристалів. Реакція подібного типу називається перитектичною.
Рис. 3. Діаграма з перитектикою
На діаграмі показано три однофазні зони: рідина – L і обмежені тверді розчини α і β. АСВ – лінія ліквідус, APDB – лінія солідус.
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 584; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.34.93 (0.006 с.) |