
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теплоемкость в политропном проессе.Содержание книги Поиск на нашем сайте
Из общей формулы теплоёмкости однородных систем имеем:
Была поучена:
Здесь Cn- массовая теплоемкость в политропном процессе Так как газ в политропном процессе полагается идеальным, то
Подставим в уравнение (64)
Здесь по уравнению Майера R=Cp-Cv,
(122)- массовая теплоемкость в политропном процессе. Так как k>1, то при 1<n<k – имеем cn<0. С точки зрения физики это трудно объяснимо, поэтому продолжим процесс вычисления с этим значением: В силу универсальности уравнения 1) При n=0 →p=const, np = 0 2) При n=0 → pv=const (T=const), nT = 1 3) При n=k →S=const(pvk=const), nA = k 4) При n= Изобразим процессы на pv-диаграмме, для кривых возьмём общую точку:
пунктирной линией изображены процессы не относящиеся к простейшим.
Работа, теплота и внутренняя энергия в политропном процессе. Абсолютная работа термодеформационной системы определяется:
Для того чтобы взять интеграл надо знать связь между Pи v. Найдем связь из уравнения политропы: pvn=const,
Получим ещё несколько формул для вычисления работы. Преобразуем формулу (123):
Окончательно:
Выразим отношение
Выразим отношение температур из уравнения:
(125)
Или В политропном процессе газ считается идеальным, а для идеального газа Теплота в политропном процессе определяется:
После подстановки dQ = T dS dQ = c dT c dT = T dS => dS =
Если за начало отсчета S взять нормальные физические условия, то можно получить формулу для энтропии:
Получим ещё несколько формул:
Исследование изопроцессов. Работа, теплота и внутренняя энергия в изопроцессах. 1) v = const, (Q = DU + A => Qv = DUv) 2) T = const,
DU = cv (T2 – T1) = 0, Q = DU + A => QT = AT
3) p = const,
Получим ещё одну формулу для расчёта теплоты. 1-ое начало термодинамики в энтальпийной форме
dU = TdS – p dv = dQ – p dv, dU = dQ – p dv – v dp + v dp = dQ – d(pv) + v dp, dQ = dU + d(pv) – v dp = d(U+pv) – v dp, dQ = dI – v dp - 1-ое начало термодинамики в энтальпийной форме. Из этого уравнения для изобарного процесса получим: dQp = dI => Qp = I2 – I1. Таким образом, в изобарном процессе теплота может быть вычислена по двум формулам:
4) Адиабатный dQ=0, S=const
Из 1-ого начала термодинамики следует: dQ = dU + dA, dAS = - dUS, AS = - DUS
Второй закон термодинамики. 1-ый закон термодинамики говорит, что невозможно получить работу без подвода энергии, в частности в форме теплоты, из вне, т.е. закон говорит о возможности взаимопревращения работы в теплоту, но не устанавливает особенности превращения теплоты в работу или работы в теплоту. Но работа в теплоту превращается легко и просто, а для превращения теплоты в работу нужны сложные технические устройства, и процесс превращения теплоты в работу всегда сопровождается потерями. С точки зрения физики различие кроется на уровне превращения упорядоченного движения в хаотическое (A®Q) и хаотическое в упорядоченное. Все процессы в природе подразделяются на самопроизвольные и вынужденные (падение давления в сосуде при разгерметизации, диффузия газов и т.д. – самопроизвольные; нагнетание давления, разделение газов, в общем случае превращение теплоты в работу – вынужденные процессы). Ранняя формулировка 2-ого закона термодинамики (формулировка Томсона): «Невозможно провести отрицательный (вынужденный) процесс без компенсации его положительным самопроизвольным процессом». Пример: Таяние снега – вынужденный процесс – сопровождается отдачей тепла от более теплого более холодному (излучение, радиация) - самопроизвольный процесс. Формулировка: «Каждый вынужденный процесс избегает одиночества и требует сопровождения самопроизвольным процессом». Известны и другие формулировки 2-ого закона термодинамики: «Невозможно построить тепловой двигатель, КПД которого превышал бы цикл Карно»; «Вечный двигатель 2-ого рода невозможен»; «Энтропия в адиабатически изолированных системах всегда возрастает». Вечный двигатель 2-ого рода – двигатель, источником теплоты которого является теплота окружающей среды. С точки зрения 1-ого закона это возможно, но 2-ой закон утверждает, что должно быть два источника теплоты: нагреватель и холодильник. Цикл Карно:
Только для обратимых процессов: dQ = T dS, Q1 = T1(S2 – S1), Q2 = T2(S1 – S2). Для любых процессов (обратимых и необратимых) Если подставить Q1 и Q2, то получим
Теорема Карно КПД обратимого цикла Карно не зависит от состава топлива и определяется температурами нагревателя T1 и холодильника T2. Все реальные процессы необратимы, т.е.
В то время, как для обратимого:
Произвольный обратимый цикл
Разобьем цикл бесчисленным числом адиабат и образуем бесчисленное количество обратимых циклов Карно. Справедливо следующее равенство:
Из математики известно, что линейный интеграл по замкнутому контуру равен нулю В необратимых процессах dQ ¹ T dS. Рассмотрим гипотетический процесс, который состоит из обратимых и необратимых частей. Суммарно процесс является необратимым, тогда
Клаузиус рассматривал адиабатный процесс в масштабах всей Вселенной (суммарно адиабатный процесс). Он пришёл к выводу Энтропия – мера неупорядоченности системы. Sгаза>Sжидк>Sтв.тел. По Клаузиусу движение во Вселенной хаотично. Теплота от более нагретых тел к менее нагретым будет излучаться во Вселенную и передаваться другим космическим телам и через большой промежуток времени температура во Вселенной выровняется, но если температура будет одинаковой, то преобразование теплоты в работу невозможно, как следует из теоремы Карно у тепловых двигателей должно быть два источника теплоты (нагреватель и холодильник). Но если температура во Вселенной будет постноянной, то преобразование теплоты в работу станет невозможным. Это состояние называется тепловой смертью Вселенной. Критика тепловой смерти Вселенной. Если будет конец, значит было начало, а в масштабах бесконечного вселенского времени таких начал и концов должно быть также бесконечное множество. Отсюда согласуется гипотеза пульсирующей Вселенной. С точки зрения статистической физики критику тепловой смерти дал Гольцман. Согласно ему: «Термодинамическое состояние системы – это её наиболее вероятное состояние (флуктуация)», поэтому dS>0 - наиболее вероятный вариант развития Вселенной, но наряду с тем есть процессы флуктуации, когда dS<0, последннее компенсирует первое.
(Природа Вселенной не ясна, поэтому считать её адиабатической не стоит). Третий закон термодинамики (следствие тепловой теоремы Нернста): По теореме T®0 S®0, абсолютный нуль по шкале Кельвина невозможен.
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 573; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.6.144 (0.01 с.) |

 (62)
(62) (64)
(64) .
.



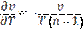
 подставим в уравнение
подставим в уравнение
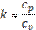
 (122)
(122) можно формально рассмотреть изопроцессы как частные случаи политропного процесса:
можно формально рассмотреть изопроцессы как частные случаи политропного процесса: (v=const), nv = ±¥.
(v=const), nv = ±¥.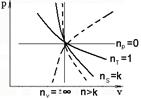




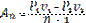 (123)
(123)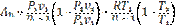
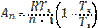 (124)
(124) из уравнения политропы
из уравнения политропы

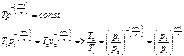

 (126) (125), (126) широко используются в теории газовых турбин, теории компрессоров, газовой динамике
(126) (125), (126) широко используются в теории газовых турбин, теории компрессоров, газовой динамике , и
, и 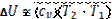 для любого процесса, в том числе и для политропного.
для любого процесса, в том числе и для политропного.
 => dSn = cn
=> dSn = cn  =
=  , проинтегрировав, получим
, проинтегрировав, получим .
. .
. =>
=>  =>
=> 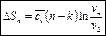

 , при нормальных физических условиях получим
, при нормальных физических условиях получим  .
.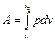 => Av = 0,
=> Av = 0,  ,
, 
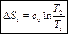
 , nT = 1, p1v1 = p2v2 = RT = const
, nT = 1, p1v1 = p2v2 = RT = const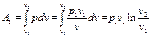 ,
, 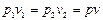 ,
,  ,
, ,
,  ,
, 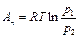 , DUT = 0
, DUT = 0
 , np = 0
, np = 0


 и
и  ,
,  .
. .
. , ns = k,
, ns = k, ;
;  ;
; 




 .
.


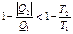 ,
,  .
.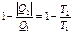 ,
,  .
.
 =>
=> 
 , где dS – полный дифференциал, т.е. её изменение не зависит от пути перехода, а только от начального и конечного состояния.
, где dS – полный дифференциал, т.е. её изменение не зависит от пути перехода, а только от начального и конечного состояния. , после интегрирования
, после интегрирования


 , т.е. по Клаузиузсу должна наступить смерть Вселенной.
, т.е. по Клаузиузсу должна наступить смерть Вселенной. .
.


