
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослід 2.2.1. Взаємодія розчину калію йодиду зСодержание книги
Поиск на нашем сайте
Гідроген пероксидом у кислому середовищі Взаємодія розчину калію йодиду з гідроген пероксидом у кислому середовищі протікає за рівнянням: H2O2 + 2 KI + H2SO4 → 2H2O + K2SO4 + I2 В одну пробірку влити із бюретки 2 мл 0,001 н розчину калій йодиду, 2 мл 0,005 н розчину сульфатної кислоти, 1 мл 1%-вого свіжоприготованого розчину крохмалю і 4 мл води, в другу – 4 мл розчину калій йодиду, 2 мл сульфатної кислоти, 1 мл розчину крохмалю і 2 мл сульфатної кислоти, 1 мл розчину крохмалю і 2 мл води, в третю – 6 мл розчину калій йодиду, 2 мл сульфатної кислоти і 1 мл розчину крохмалю. Таким чином, при однаковому загальному об’ємі розчинів концентрації калій йодиду в пробірках відносяться як 1: 2: 3. Влити у першу пробірку 2 мл 3%-вого розчину гідроген пероксиду і включити секундомір. Відзначити час до появи в розчині синього забарвлення. Додати по 2 мл гідроген пероксиду в другу і третю пробірки і також зазначити час появи синього забарвлення у розчинах. Результати спостережень записати у вигляді таблиці.
Побудувати графічну залежність за результатами дослідів. Доля цього на осі абцис відкласти відносні концентрації, а на осі ординат – швидкості реакцій (в умовних одиницях). Дослід 2.2.2. Швидкість розкладу лужного розчину гідроген пероксиду При різних температурах У склянці нагріти 150-200 мл води до 50-60°С. У дві пробірки налити по 8 мл 20%-вого розчину гідроген пероксиду і по 2 мл лугу. Одну пробірку залишити у штативі, а іншу занурити у стакан із гарячою водою. Швидкість розкладання гідроген пероксиду визначити за інтенсивностю виділення газу. Встановити, газ що виділяється (кисень). Дослід 2.2.3. Каталітичний розклад гідроген пероксиду В присутності Манган(IV) оксиду У пробірку влити 5-8 мл 10%-вого розчину гідроген пероксиду. Відзначити, що в звичайних умовах помітного розкладання гідроген пероксиду не спостерігається. Додати на кінчику шпателя Манган(IV) оксид. Що спостерігається? Піднести до отвору пробірки тліючу скіпку. Який газ виділяється? Скласти рівняння реакції розкладу гідроген пероксиду. Дослід 2.2.4. Зміщення рівноваги реакції окиснення Натрій гідроарсеніту йодом Зміщення рівноваги реакції окиснення натрій гідроарсеніту йодом протікає за рівнянням: I2 + Na2HAsO3 + H2O → 2HI + Na2HAsO4 Налити в пробірку 3 мл води, 3 краплі водного розчину йоду (йодної води) і 5-7 крапель свіжоприготовленого розчину крохмалю. До отриманого синього розчину додати по краплях 0,5 н розчин натрій гідроарсеніту до зникнення забарвлення. До знебарвленого розчину додати по краплям натрій гідроарсеніту до появи синього забарвлення. Відзначити зникнення синього забарвлення крохмалю та його появу знову і пояснити причину цих явищ. 2.3. Контрольні запитання
ЛАБОРАТОРНА РОБОТА № 3 РОЗЧИНИ Теоретична частина Розчин -це гомогенна (однорідна) система, яка складається з двох або більше компонентів (розчинника, розчиненої речовини) і продуктів їх взає-модії. Для кількісної оцінки вмісту розчиненої речовини використовують такі способи вираження концентрації розчинів: масова частка розчиненої речовини, молярна, нормальна і моляльна концентрації. Масова частка розчиненої речовини(w) - це фізична величина, що до-рівнює відношенню маси розчиненої речовини (mрозч.реч .) до маси всього розчину (mрозчину). Її визначають у частках одиниці або у відсотках.
Молярна концентрація (СМ) розчиненої речовини - це фізична вели-чина, що визначається відношенням кількості розчиненої речовини до об’єму розчину.
де СМ – молярна концентрація речовини; V – об’єм розчину, л; m – маса речовини, M – молярна маса речовини). Нормальна концентрація (СН)– це фізична величина, що визначається числом моль-еквівалентів розчиненої речовини, яка міститься в 1 л розчину.
де СН – нормальна концентрація речовини; V – об’єм розчину, л; Е – екві-валентна маса розчиненої речовини. Моляльна концентрація (Сm) показує, яка кількість розчиненої речо-вини припадає на 1 кг розчинника в даному розчині. Одиниці вимірюван-ня: моль/кг.
де Сm – моляльна концентрація розчину; n – число молів розчиненої речо-вини; mр. – маса розчинника, кг. Експериментальна частина
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 145; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.0.93 (0.005 с.) |

 COCl2 рівноважні концентрації реагуючих речовин становлять: [CO] = 0,2 моль/л; [Cl2] = 0,3 моль/л; [COCl2] = 1,2 моль/л. Знайти константу рівноваги цієї системи.
COCl2 рівноважні концентрації реагуючих речовин становлять: [CO] = 0,2 моль/л; [Cl2] = 0,3 моль/л; [COCl2] = 1,2 моль/л. Знайти константу рівноваги цієї системи.
 = -43,7 кДж?
= -43,7 кДж?
 ,
,
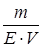 ,
,
 ,
,



