
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Чигвінцева О.П., Голов’ятинська В.В.Содержание книги
Поиск на нашем сайте НЕОРГАНІЧНА ХІМІЯ. ЛАБОРАТОРНИЙ ПРАКТИКУМ
Навчальний посібник
Дніпропетровськ, 2011
Рекомендовано до друку науково-методичною радою агроногмічного факультету Дніпропетровського державного аграрного університету (протокол № 1 від 1 вересня 2011 р.) Рецензенти:
Чигвінцева О.П., Голов’ятинська В.В. Неорганічна хімія. Практикум. Навчальний посібник – Дніпропетровськ, 2011. – 80 с.
Навчальний посібник включає теоретичну та експериментальну частини основних розділів неорганічної хімії. Призначений для початкового систематичного вивчення неорганічної хімії і може слугувати навчальним посібником для студентів агрономічних спеціальностей вищих учбових закладів аграрного профілю III-IV рівнів акредитації.
Навчальне видання
ЧИГВІНЦЕВА Ольга Павлівна ГОЛОВ’ЯТИНСЬКА Вікторія Вікторовна
НЕОРГАНІЧНА ХІМІЯ. ПРАКТИКУМ
Навчальний посібник
Підписано до друку 29.10.11. Формат 60 ´ 84 Папір офсетний. Гарнітура літературна. Друк офсетний. Умовн. друк.арк. 3,3 Тираж 500 прим. Зам. № 18.
ВСТУП
Дисципліна «Неорганічна хімія» складається із трьох частин, пов’яза-них між собою загальним підходом та методологією. Перша частина містить у собі матеріал стосовно основних понять і законів неорганічної хімії, а розглядає загальні закономірності протікання хімічних процесів у розчинах. Друга частина дисципліни містить теоретичний матеріал відносно умов протікання окисно-відновних процесів та властивостей комплексних сполук. У третій частині розглянуті властивості основних хімічних елементів-органогенів та біометалів, що відіграють важливу роль у розвитку системи грунт – рослина. Вивчення дисципліни передбачає засвоєння основних понять і законів хімії, розвиток сучасних поглядів на будову атома і речовини, закономірності перебігу хімічних реакцій, основні положення сучасних теорій розчинів, електролітичної дисоціації, способів вираження складу розчинів; основних прийомів виконання хімічних дослідів та математичної обробки одержаних результатів. Навчальний посібник «Неорганічна хімія. Практикум», призначений для студентів денного відділення спеціальності «Агрономія» і складений у відповідності з типовою програмою дисципліни. Кожний розділ практикуму розпочинається із теоретичного матеріалу, у якому максимально стисло і в доступній формі викладені основні теоретичні положення неорганічної хімії. Для більш повного вивчення дисципліни, що базується на експериментальних дослідженнях, дуже важливим є виконання лабораторного практикуму. Обдумування плану досліду, його постановка і здобування результатів експерименту виховують у студента дослідницькі навички, звичку до пошуків практичних підтверджень набутих теоретичних положень, розвиває їх хімічне мислення. Тому для закріплення теоретичних знань та отримання практичних навичок і техніки хімічного експерименту в кожному розділі посібника запропоновані лабораторні роботи. Контрольні запитання для самоконтролю, наведені в кінці кожного розділу, дозволять студенту перевірити свій рівень знань із дисципліни, а Додатки можуть бути корисними для виконання цих контрольних завдань. ЛАБОРАТОРНА РОБОТА № 1 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Теоретична частина Оксиди Оксидами називають сполуки елементів з Оксигеном. Вони бувають солетворними (здатними утворювати солі) i несолетворними. Солетворні оксиди можуть бути основними, кислотними та амфотерними. Несолетворними оксидами є NО,СОта ін. Основними називають оксиди, які утворюють солі під час взаємодії з кислотами або кислотними оксидами i не взаємодіють з основами або основними оксидами. Основним оксидам відповідають основи. Наприклад: К2О – КОН СаО – Са(ОН)2 FeO – Fe(OH)2 Xiмiчнi властивості Основі оксиди взаємодіють: – з водою СаО + Н2О → Са(ОН)2 – з кислотами СаО + H2SO4 → CaSO4 + H2O – з кислотними оксидами ВаО + СО2 → ВаСО3 – з амфотерними оксидами СаО + ZnO → CaZnO2. Кислотними називають оксиди, які утворюють солі під час взаємодії з основами або основними оксидами i не взаємодіють з кислотами або кислотними оксидами. Кислотним оксидам відповідають кислоти. Наприклад: СО2 – Н2СО3 Р2О5 – Н3РО4 Xiмiчнi властивості Кислотні оксиди взаємодіють: – з водою СО2 + Н2О → Н2СО3 – з основами SО3 + 2NaOH → Na2SO4 + Н2О – з основними оксидами СО2 + СаО → СаСО3 – з амфотерними оксидами Р2О5 + Аl2О3 → 2АlРО4 Амфотерними називають оксиди металів, які утворюють солі під час взаємодії як з кислотами або кислотними оксидами, так i з основами чи основними оксидами. Xiмiчнi властивості Амфотерні оксиди взаємодіють: – з кислотами (та кислотними оксидами) ZnO + 2НС1 → ZnCl2 + Н2О – з основами (та основними оксидами) ZnO + 2NaOH → Na2ZnО2 + Н2О. Номенклатура оксидів
Основи Основами називають сполуки, до складу яких входять катіони металу та гідроксильні групи. Інша назва основ – гідроксиди. Розчинні у воді основи називають лугами. Xiмiчнi властивості Основи взаємодіють: – з кислотами (реакція нейтралізації) NaOH + НСl → NaCl + Н2О Cu(OH)2 + H2SO4 → CuSO4 + 2H2O – з кислотними оксидами 2NaOH + СО2 → Na2CO3 + Н2О Са(ОН)2 + СО2 → СаСО3 + Н2О – з розчинами середніх i кислих солей (тільки луги) 2КОН + CuCl2 → Cu(OH)2↓ + 2KC1 NaOH + NaHCO3 → Na2CO3 + Н2О – основи розкладаються під час нагрівання Cu(OH)2 2Fe(OH)3 Амфотерні гідроксиди Амфотерні гідроксиди одночасно можна розглядати i як кислоти, i як основи, тобто такі сполуки, в яких Гідроген може заміщуватись на атоми металу, а гідроксильна група – на кислотний залишок. Наприклад: Zn(OH)2, А1(ОН)3, Cr(OH)3, Sn(OH)4, Pb(OH)2тощо Амфотерні гідроксиди з кислотами реагують як основи, а з основами – як кислоти Zn(OH)2 + H2SO4 → ZnSO4 +2H2O Zn(OH)2 + 2NaOH → Na2ZnО2 + 2H2O Амфотерні гідроксиди добувають взаємодією розчину солі металу з певною кількістю лугу ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl A12(SO4)3 + 6KOH → 2A1(OH)3 + 3K2SO4 Кислоти Кислотами називають сполуки, що містять атоми Гідрогену, здатні заміщуватись на атоми металів з утворенням солей. Кількістю атомів Гідрогену, здатних заміщуватися на атоми металів, визначається основність кислоти. Розрізняють безоксигенові та оксигеновмісні кислоти. Безоксигенові кислоти: HF–флуоридна, або флуороводнева (плавикова) кислота; НСl – хлоридна, або хлороводнева кислота; НВг – бромідна, або бромоводнева кислота; HJ – йодидна, або йодоводнева кислота; HCN – ціанідна (синильна) кислота; H2S – сульфідна або сірководнева кислота. Оксигеновмісні кислоти: H2SO4 – сульфатна кислота (сірчана кислота); H2SO3 – сульфітна кислота; HNO3 – нітратна кислота (азотна кислота); HNO2 – нітритна кислота; Н3РО4 – ортофосфатна кислота; НClO4 – перхлоратна кислота; НСlО3 – хлоратна кислота; НСlО2 – хлоритна кислота; НСlO – гіпохлоритна кислота; Н3ВО3 – ортоборатна кислота; H2SiО3 – силікатна кислота. Хімічні властивості Кислоти взаємодіють: – з металами згідно з рядом електрохімічних потенціалів металів Zn + Н2SО4 (розв.) → ZnSО4 + Н2↑ Сu + Н2SО4 (pозв.) ≠ Сu + 2Н2SО4(конц.) → СuSО4 + SО2↑+ 2Н2О – з основними та амфотерними оксидами СuО + Н2SО4 → СuSО4 + Н2О SnО + 2НСl → SnСl2 + Н2O – з основами (реакція нейтралізації) Сu(ОН)2 + 2НСl → СuС12 + 2Н2О 2КОН + Н2SО4 → К2SО4 + 2Н2О – із солями, якщо в результаті виділяється газ або випадає осад Na2СО3 + 2НСl → 2NaСl + СО2↑ + Н2О ВаСl2 + Н2SО4 → ВаSO4↓ + 2НСl Солі Солями називають продукт заміщення атомів Гідрогену у кислоті на атоми металу або гідроксильних груп у гідроксидах металів на кислотні залишки. Солі бувають середні, кислі та основні. Середні coлi є продуктом повного заміщення атомів Гідрогену кислоти на атоми металу NaCl, ZnSO4, Cu(NO3)2. Назви середніх солей походять від назв кислот i металів, з яких утворені солі: магній сульфат MgSO4, натрій фосфат Na3PO4. Кислі солі можна розглядати як продукт неповного заміщення атомів Гідрогену кислоти на атоми металу. Кислі солі, як правило, утворюються в разі надлишку кислоти i можуть бути перетворені на середні солі дією основи: Са(НСО3)2 + Са(ОН)2 → 2СаСО3 + 2Н2О Назви кислих солей походять від назв середніх солей з додаванням слова гiдpoген- або дигiдpoген-: кальцій гідрогенкарбонат, натрій дигідрогенфосфат Са(НСО3)2, NaH2PO4 Подвійними солями називають coлi, утворені різними катіонами i одним і тим самим аніоном. Прикладом може бути кристалогідрат калій-алюміній сульфат – алюмокалієвий галун, розгорнута формула якого K2SO4 • A12(SO4)3 • 24H2O i скорочена KA1(SO4)2 • 12Н2О. Утворення подвійних сульфатів (галунів) є характерним для низки тривалентних металів (Al, Cr, Fe, V тощо). 3мішаними називаються coлi, yтвopeнi одним і тим самим катіон-іном, але різними аніонами. Наприклад, Ba(Cl)NO3 – барій хлорид-нітрат, CaCl(OC1) – кальцій хлорид-гіпохлорит. Xiмiчнi властивості Cолі взаємодіють: – з металами, згідно з рядом електрохімічних потенціалів металів Zn + CuSO4 → ZnSO4 + Cu Cu + ZnCl2 ≠ – з основами, якщо внаслідок реакції випадає осад або виділяється газ FeCl3 + ЗКОН → Fe(OH)3↓ + 3KCl 2NH4Cl + Са(ОН)2 → СаСl2 + 2NH3↑ +2H2O – з кислотами, якщо внаслідок реакції випадає осад або виділяється газ FeS + H2SO4 → FeSO4 + H2S ↑ ВаСl2 + H2SO4 → BaSO4 ↓ + 2HCl – з солями, якщо внаслідок реакції випадає осад NaCl + AgNO3 → NaNO3 + AgCl ↓ ВаС12 + CuSO4 → CuCl2 + BaSO4 ↓ Генетичний зв'язок між класами неорганічних сполук можна зобразити схемою:
1) Ca + O2 → 2CaO 2) CaO + H2O → Ca(OH)2 3) S + O2 → SO2 4) SO2 + H2O → H2SO3 5) Ca + S → CaS 6) CaO + SO2 → CaSO3 7) CaO + H2SO3 → CaSO3 + H2O 8) Ca(OH)2 + SO2 → CaSO3 + H2O 9) Ca(OH)2 + H2SO3 → CaSO3 + 2H2O Експериментальна частина ЛАБОРАТОРНА РОБОТА № 2 Теоретична частина Під швидкістю хімічних реакцій розуміють зміну концентрації oднієї з реагуючих речовин за одиницю часу при постійному тиску та температурі. Концентрацію виражають у моль/л, а час – у секундах або хвилинах. Розглянемо у загальному вигляді швидкість реакції, що відбувається при постійних температурі i тиску за рівнянням: А + В → С + D. По мiрі витрачання речовини А швидкість реакції зменшується. Звідки випливає, що швидкість реакції можна визначити лише для деякого проміжку часу. Оскільки, концентрація речовини А у момент часу t1 вимі-рюється величиною c1,а у момент t2 – величиною с2, то за проміжок часу Δt= t2 - t1, зміна концентрації речовин буде становити Δс = с2 – с1,звідки можна визначити середню швидкість реакції (υ):
Знак «мінус» ставиться тому, що, незважаючи на зменшення концентрації речовини A i, отже, на від`ємне значения різниці с2 – c1 швидкість реакції може бути тільки додатньою величиною. Можна також стежити за зміною концентрації одного з продуктів реакції – речовин С або D; вона під час реакції буде збільшуватись, i тому у правій частині рівняння необхідно ставити знак «плюс». Оскільки, швидкість реакції весь час змінюється, тоді у хімічній кінетиці розглядають тільки дійсну швидкість реакції υ, тобто швидкість у даний момент часу, коли Δt → 0, а саме
Фактори, що впливають на швидкість реакції Швидкість хімічної реакції залежить від природи реагуючих речовин, а також від умов перебігу реакції: концентрації с, температури t, наявності катализатора, а також від деяких інших факторів (наприклад, від тиску – для газових реакцій, від ступеня подрібнення – для твердих речовин, відрадіоактивного випромінювання тощо). Вплив концентрації реагуючих речовин виражається законом діючих мас (Гульдберг, Вааге, 1864-1867 pp.): за сталої температури швидкість xімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин. Для реакції mА + nВ → pС + gD закон діючих мас виражається рівнянням: ν = k • де сАi сВ – концентрації речовин, моль/л; k – коефіцієнт пропорційності, що називається константою швидкості реакції. Це рівняння називається кінетичним рівнянням реакції. Із нього неважко встановити фізичний зміст константи швидкості. Вона чисельно дорівнює швидкості реакції, коли концентрації кожної з реагуючих речовин становлять 1 моль/л. Константа швидкості залежитъ від природи реагуючих речовин, від температури, тиску, але не залежитъ від їx концен-трації. Закон діючих мас застосовується лише до газоподібних i розчинених речовин, він не розповсюджується на реагуючі речовини у твердому стані, оскільки їх концентрації є стабільними i вони реагують лише на поверхні. Залежність швидкості реакції від температури визначається (наближено) правилом Вант-Гоффа: з підвищенням температури на кожні 10 градусів швидкість більшості реакцій зростає у 2-4 рази. Математично ця залежність виражається співвідношенням:
де
γ – температурний коефіцієнт швидкості peaкції, який показує, у скільки разів збільшується швидкість реакції з підвищенням температури реагуючих речовин на 10 градусов (γ = 2 - 4). Температура впливає на швидкість хімічної реакції, збільшуючи константу швидкості. Енергія активації 3 підвищенням температури число активних молекул значно зростає, внаслідок чого збільшується швидкість реакції. Це пояснюється збільшен-ням кількості так званих «активних молекул», тобто молекул, що мають енергію, достатню для здійснення даної реакції при їх зіткненні. Енергія, яку потрібно надати молекулам (частинкам) реагуючих речовин, щоб перетворити їх на активні, називається енергією активації. Її визначають експериментально i позначають літерою Еаi виражають у кДж/моль.Енергія активації залежить від природи реагуючих речовин i є характеристикою кожної реакції. Для того, щоб реакція між молекулами була можливою, молекули повинні мати надлишкову енергію, що більша за середню на величину, рівну енергії активації. Поняття про каталіз i каталізатори Каталізом називають зміну швидкості хімічних реакцій в присут-нocтi речовин, які самі після реакції залишаються хімічно незміненими. Зазвичай каталізаторами називаютьея лише прискорювачі реації, а інгібіторами – уповільнювачі. Якщокаталізатор i peaгуючі речовини перебувають у одній фазі, тоді каталіз називають гомогенним, якщо у piзниx фазах – гетерогенним. Дія каталізаторів: 1) не змінює теплового ефекту реакції; 2) знижує енергію активації як прямої, так i зворотної реакції на одну й ту саму величину ΔЕ, тому не порушує рівноваги; 3) збільшуючи однаковою мірою швидкість прямої i зворотної реакцій, скорочує час досягнення piвноваги; 4) є вибірковою, що визначається природою каталізатора i умовами його застосування. Хімічні реакції, що відбуваються за участю каталізаторів, називаються каталітичними. Розрізняють гомогенний (однорідний) і гетерогенний (неоднорідний) каталіз. Для гомогенного каталізу встановлено, що швидкість хімічної реакції пропорційна концентрації каталізатора. Механізм гомогенного каталізу звичайно пояснюють за допомогою теорії проміжних сполук. У відповідності з цією теорією каталізатор (К) спочатку утворює з однією із вихідних речовин проміжну сполуку (АК). Ця сполука реагує з іншою вихідною речовиною з відновленням каталізатора. Схематично це можна зобразити таким чином: А + Б ® АБ (реакція протікає повільно) (а) Каталізатор розбиває процес на дві стадії: А + К ® АК (реакція протікає швидко) (б) АК + Б ® АБ + К (реакція протікає швидко). (в) Швидкості реакцій (б) і (в) у багато разів більші від швидкостей процесу (а), оскільки стадії (б) і (в) характеризуються меншою енергією активації. Таким чином, причина збільшення швидкості реакції в присутності каталізатора полягає у зменшенні енергії активації цієї реакції. У відповідності з цією теорією процес окиснення SO2 до SO3 за участю каталізатора – нітроген (ІІ) оксиду можна схематично зобразити таким чином: SO2 + А + Б ® АБ. Реакція протікає повільно. При введенні каталізатора відбувається утворення проміжної сполуки:
Підчас гетерогенного каталізу peaгуючі речовини i каталізатор утворюють систему з різних фаз. Міжкаталізатором i реагуючими речовинами існує поверхня поділу. Зазвичай, каталізатор – тверда речовина,а реагують між собою речовини – гази або рідини. Поверхня каталізатopa є неоднорідною. На ній є так звані активні центри, на яких в основному i відбуваються каталітичні реакції. Експериментальна частина При різних температурах У склянці нагріти 150-200 мл води до 50-60°С. У дві пробірки налити по 8 мл 20%-вого розчину гідроген пероксиду і по 2 мл лугу. Одну пробірку залишити у штативі, а іншу занурити у стакан із гарячою водою. Швидкість розкладання гідроген пероксиду визначити за інтенсивностю виділення газу. Встановити, газ що виділяється (кисень). Натрій гідроарсеніту йодом Зміщення рівноваги реакції окиснення натрій гідроарсеніту йодом протікає за рівнянням: I2 + Na2HAsO3 + H2O → 2HI + Na2HAsO4 Налити в пробірку 3 мл води, 3 краплі водного розчину йоду (йодної води) і 5-7 крапель свіжоприготовленого розчину крохмалю. До отриманого синього розчину додати по краплях 0,5 н розчин натрій гідроарсеніту до зникнення забарвлення. До знебарвленого розчину додати по краплям натрій гідроарсеніту до появи синього забарвлення. Відзначити зникнення синього забарвлення крохмалю та його появу знову і пояснити причину цих явищ. 2.3. Контрольні запитання
ЛАБОРАТОРНА РОБОТА № 3 РОЗЧИНИ Теоретична частина Розчин -це гомогенна (однорідна) система, яка складається з двох або більше компонентів (розчинника, розчиненої речовини) і продуктів їх взає-модії. Для кількісної оцінки вмісту розчиненої речовини використовують такі способи вираження концентрації розчинів: масова частка розчиненої речовини, молярна, нормальна і моляльна концентрації. Масова частка розчиненої речовини(w) - це фізична величина, що до-рівнює відношенню маси розчиненої речовини (mрозч.реч .) до маси всього розчину (mрозчину). Її визначають у частках одиниці або у відсотках.
Молярна концентрація (СМ) розчиненої речовини - це фізична вели-чина, що визначається відношенням кількості розчиненої речовини до об’єму розчину.
де СМ – молярна концентрація речовини; V – об’єм розчину, л; m – маса речовини, M – молярна маса речовини). Нормальна концентрація (СН)– це фізична величина, що визначається числом моль-еквівалентів розчиненої речовини, яка міститься в 1 л розчину.
де СН – нормальна концентрація речовини; V – об’єм розчину, л; Е – екві-валентна маса розчиненої речовини. Моляльна концентрація (Сm) показує, яка кількість розчиненої речо-вини припадає на 1 кг розчинника в даному розчині. Одиниці вимірюван-ня: моль/кг.
де Сm – моляльна концентрація розчину; n – число молів розчиненої речо-вини; mр. – маса розчинника, кг. Експериментальна частина ЛАБОРАТОРНА РОБОТА № 4 Теоретична частина Гідроліз солі – хімічна взаємодія іонів розчинної солі з водою з утворенням слабкого електроліту. Це призводить до накопичення іонів Н+ або ОН–і, відповідно, до зміни реакції середовища розчину солі. Гідролізу підлягають солі, утворені за участю слабких кислот або слабких основ. Солі, які є похідними сильних кислот і сильних основ, не гідролізують, оскільки їхні іони не зв’язують іони води (Н+ або ОН–) в слабкий електроліт, а отже, не зміщують її іонну рівновагу. Солі, до складу яких входять багатозарядні іони, гідролізують ступінчасто (за стадіями). При цьому гідроліз солі переважно відбувається за першим ступенем. Розрізняють три основних типи гідролізу солей: 1. За катіоном – він характерний для солей, утворених катіоном слабкої основи і аніоном сильної кислоти. Наприклад: Al2(SO4)3 + 2HOH 2Al3+ + 3SO 2Al3+ + 2HOH Al3+ + HOH 2AlOHSO4 + 2HOH 2AlOH2+ + 2SO 2AlOH2+ + 2HOH AlOH2+ + HOH Третій ступінь гідролізу Al2(SO4)3 практично не відбувається. Внаслідок накопичення іонів H+ процес зміщується в бік вихідних сполук. 2.За аніоном – він характерний для солей, утворених катіоном сильної основи і аніоном слабкої кислоти. Наприклад: Na3PO4 + НОН 3Na+ + PO PO Na2НPO4 + НОН 2Na+ + НPO НPO Третій ступінь гідролізу з утворенням ортофосфатної кислоти Н3PO4 практично не відбувається. 3.Гідроліз солі за катіоном і аніоном – він характерний для солей, утворених катіоном слабкої основи і аніоном слабкої кислоти. Наприклад: NH4СN + HOH NH4+ + CN- + HOH Скорочене іонне рівняння в цьому випадку не записують. Гідроліз солей, утворених багатозарядними катіоном або аніоном, відбувається ступінчасто (переважно за першим ступенем). Багато солей цього типу гідролізують необоротно. Прикладом солей, які зазнають повногогідролізу, є солі слабких основ і дуже слабких, нестій-ких або летких кислот: Cr2S3, Al2S3, Fe2(CO3)3, Al2(CO3)3, CuSiO3, Ag2SiO3, Fe2(SO3)3, SnCO3, інші. Їх гідроліз супроводжується повним розкладанням солі з виділенням вільних кислот і гідроксидів. Рівняння реакцій повного гідролізу солей записують лише у молекулярному вигляді: Al2S3 + 6HOH ® 2Al(OH)3¯ + 3H2S. Через повний гідроліз ці солі не можуть бути одержані з водних розчинів. Реакцію середовища розчинів характеризують за допомогою величини водневого показника рН. Водневий показник рН – це негативний десятковий логарифм концентрації іонів Гідрогену в розчині. рН = – lg[H+] Якщо рН = 7 – середовище нейтральне; рН < 7 – кисле; рН > 7 – лужне. Експериментальна частина ЛАБОРАТОРНА РОБОТА № 5 ОКИСНО-ВІДНОВНІ РЕАКЦІЇ Теоретична частина Ступінь окиснення – умовний заряд атома, розрахований із припущення що молекула складається лише із іонів. Для знаходження ступенів окиснення елементів у складних сполуках користуються наступними правилами: 1. Ступінь окиснення атомів в простих речовинах дорівнює нулю ( 2. Атоми Оксигену в сполуках мають ступінь окиснення -2; виняток становлять пероксиди, де ступінь окиснення Оксигену складає -1 (наприклад, 3. У Гідрогену в сполуках ступінь окиснення +1; виняток становлять гідриди металів, де ступінь окиснення Гідрогену складає -1 (наприклад, 4. Оскільки молекула у цілому електронейтральна, алгебраїчна сума ступенів окиснення усіх атомів, що входять у сполуку, дорівнює нулю. У будь-якій окисно-відновній реакції беруть участь одночасно окисник і відновник. До відновників належать речовини, атоми (або іони) яких від-дають електрони, а до окиcників – речовини, що приєднують ці електрони. Процес віддавання електронів називається окисненням, а процес при- дбання електронів – відновленням. Хімічні реакції, що протікають зі зміною ступенів окиснення елементів, що входять до складу речовин, називаються окисно-відновними. Існує три типи окисно-відновних реакцій: 1. Реакції міжатомного або міжмолекулярного окиснення-віднов-лення. До них належать такі реакції, в яких обмін електронами відбува-ється між різними атомами, молекулами або іонами. Наприклад:
Експериментальна частина Дослід 5.2.1.Окисні властивості калій дихромату У дві пробірки взяти по 2-3 краплі розчину калій дихромату, додати по 3-4 краплі розчину сульфатної кислоти. У першу пробірку додати щіпку натрій сульфіту, у другу – декілька кристалів натрій нітриту. Відмітити зміну кольору розчинів. Написати рівняння реакцій, скласти схему електронного балансу до кожної з них, підібрати коефіцієнти. Дослід 5.2. 2. Вплив середовища на окисно-відновні процеси У три пробірки помістити по 3-4 краплі розчину KMnO4. У першу додати 1 краплю розчину H2SO4, у другу 3-4 краплі дистильованої води, в третю – 2-3 краплі розчину NaOH. Чи змінився при цьому колір розчину KMnO4? Далі у кожну пробірку додати щіпку порошку натрій сульфіту. Що відбувається? Написати рівняння реакцій, скласти схему електронного балансу до кожної з них, підібрати коефіцієнти. Дослід 5.2.3. Окисні властивості галогенів Налити у пробірку 4-5 крапель розчину натрій сульфіду і додати 3-4 краплі йодної води (водний розчин йоду). Чому знебарвився розчин йоду та випав осад сірки? Написати рівняння реакцій, скласти схему електронного балансу, підібрати коефіцієнти. Дослід 5.2.4. Окиснення іонів J– іонами Fe3+ У пробірку налити 5–7 крапель розчину Fe2(SO4)3 або FeCl3, додати 3-4 краплі безбарвного розчину KI. Розвести суміш 15-20 краплями дистильованої води і добавити 1-2 краплі розчину крохмалю. Поява синього забарвлення свідчить про утворення в розчині вільного йоду. Як це пояснити? Написати рівняння реакцій, скласти схему електронного балансу до кожної з них, підібрати коефіцієнти. Дослід 5.2.5. Окиснення іонів Fe2+ перманганат-іонами В пробірку налити 2-3 каплі розчину калій перманганату і 2-3 каплі 2 н розчину сульфатної кислоти. По каплях додати свіжоприготований розчин ферум (ІІ) сульфату до повного знебарвлення розчину. Скласти рівняння окисно-відновної реакції. 5.3. Контрольні запитання
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 189; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.012 с.) |


 CuO + Н2О
CuO + Н2О
 , де d – диференціал.
, де d – диференціал.
 ,
, – швидкості реакції за початкової – t1 ікінцевої t2 температурах;
– швидкості реакції за початкової – t1 ікінцевої t2 температурах; О2 ® SO3;
О2 ® SO3; COCl2 рівноважні концентрації реагуючих речовин становлять: [CO] = 0,2 моль/л; [Cl2] = 0,3 моль/л; [COCl2] = 1,2 моль/л. Знайти константу рівноваги цієї системи.
COCl2 рівноважні концентрації реагуючих речовин становлять: [CO] = 0,2 моль/л; [Cl2] = 0,3 моль/л; [COCl2] = 1,2 моль/л. Знайти константу рівноваги цієї системи.
 = -43,7 кДж?
= -43,7 кДж?
 ,
,
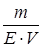 ,
,
 ,
,
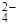 + 2HOH
+ 2HOH 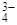 + НОН
+ НОН 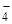 + Na+ + ОН–;
+ Na+ + ОН–; );
); ) і оксиген фторид
) і оксиген фторид 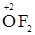 , де ступінь окиснення становить +2.
, де ступінь окиснення становить +2. ).
). .
.


