
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гідроліз солей. Водневий показникСодержание книги
Поиск на нашем сайте
Теоретична частина Гідроліз солі – хімічна взаємодія іонів розчинної солі з водою з утворенням слабкого електроліту. Це призводить до накопичення іонів Н+ або ОН–і, відповідно, до зміни реакції середовища розчину солі. Гідролізу підлягають солі, утворені за участю слабких кислот або слабких основ. Солі, які є похідними сильних кислот і сильних основ, не гідролізують, оскільки їхні іони не зв’язують іони води (Н+ або ОН–) в слабкий електроліт, а отже, не зміщують її іонну рівновагу. Солі, до складу яких входять багатозарядні іони, гідролізують ступінчасто (за стадіями). При цьому гідроліз солі переважно відбувається за першим ступенем. Розрізняють три основних типи гідролізу солей: 1. За катіоном – він характерний для солей, утворених катіоном слабкої основи і аніоном сильної кислоти. Наприклад: Al2(SO4)3 + 2HOH 2Al3+ + 3SO 2Al3+ + 2HOH Al3+ + HOH 2AlOHSO4 + 2HOH 2AlOH2+ + 2SO 2AlOH2+ + 2HOH AlOH2+ + HOH Третій ступінь гідролізу Al2(SO4)3 практично не відбувається. Внаслідок накопичення іонів H+ процес зміщується в бік вихідних сполук. 2.За аніоном – він характерний для солей, утворених катіоном сильної основи і аніоном слабкої кислоти. Наприклад: Na3PO4 + НОН 3Na+ + PO PO Na2НPO4 + НОН 2Na+ + НPO НPO Третій ступінь гідролізу з утворенням ортофосфатної кислоти Н3PO4 практично не відбувається. 3.Гідроліз солі за катіоном і аніоном – він характерний для солей, утворених катіоном слабкої основи і аніоном слабкої кислоти. Наприклад: NH4СN + HOH NH4+ + CN- + HOH Скорочене іонне рівняння в цьому випадку не записують. Гідроліз солей, утворених багатозарядними катіоном або аніоном, відбувається ступінчасто (переважно за першим ступенем). Багато солей цього типу гідролізують необоротно. Прикладом солей, які зазнають повногогідролізу, є солі слабких основ і дуже слабких, нестій-ких або летких кислот: Cr2S3, Al2S3, Fe2(CO3)3, Al2(CO3)3, CuSiO3, Ag2SiO3, Fe2(SO3)3, SnCO3, інші. Їх гідроліз супроводжується повним розкладанням солі з виділенням вільних кислот і гідроксидів. Рівняння реакцій повного гідролізу солей записують лише у молекулярному вигляді:
Al2S3 + 6HOH ® 2Al(OH)3¯ + 3H2S. Через повний гідроліз ці солі не можуть бути одержані з водних розчинів. Реакцію середовища розчинів характеризують за допомогою величини водневого показника рН. Водневий показник рН – це негативний десятковий логарифм концентрації іонів Гідрогену в розчині. рН = – lg[H+] Якщо рН = 7 – середовище нейтральне; рН < 7 – кисле; рН > 7 – лужне. Експериментальна частина Дослід 4.2.1. Вплив температури на гідроліз солей Налити у дві пробірки по 5-6 крапель 2 н розчину CH3COONa. У кожну пробірку додати 1 краплю розчину фенолфталеїну. Одну пробірку залишити для порівняння, а другу нагріти до кипіння. Що спостерігається? Охолодити пробірку до кімнатної температури, спостерігати зникнення забарвлення індикатора. Написати реакцію гідролізу натрій ацетату і пояснити явище, що спостерігається. Дослід 4.2.2. Повний гідроліз Налити у пробірку 2–3 мл розчину алюміній сульфату і додати такий самий об’єм розчину натрій карбонату. Спостерігати випадіння аморфного осаду та виділення бульбашок газу. Визначити рН розчину за допомогою універсального індикатору. Осад промити 2–3 рази гарячою водою і перевірити на розчинність у хлоридній кислоті (чи виділяється газ?) та у надлишку лугу. Записати рівняння реакцій. Дослід 4.2.3. Визначення реакції середовища у розчинах солей за допомогою універсального індикатору Визначити середовище у розчинах солей (вказує викладач), дослідивши їх дію на універсальний індикатор шляхом нанесення краплі розчину на індикаторний папірець. Результати випробування занести в таблицю:
Записати рівняння реакцій гідролізу вказаних солей.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 281; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.176.80 (0.006 с.) |

 2AlOHSO4 + H2SO4 (I);
2AlOHSO4 + H2SO4 (I);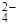 + 2HOH
+ 2HOH 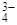 + НОН
+ НОН 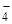 + Na+ + ОН–;
+ Na+ + ОН–;


