
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Постулаты Бора. Опыт Франка и ГерцаСодержание книги Поиск на нашем сайте В предыдущем параграфе было выяснено, что ядерная модель атома в сочетании с классической механикой и электродинамикой оказалась неспособной объяснить ни устойчивость атома, ни характер атомного спектра. Выход из создавшегося тупика был найден в 1913 г. датским физиком Нильсом Бором, правда, ценой введения предположений, противоречащих классическим представлениям. Допущения, сделанные Бором, содержатся в двух высказанных им постулатах. 1. Из бесконечного множества электронных орбит, возможных с точки зрения классической механики, осуществляются в действительности только некоторые дискретные орбиты, удовлетворяющие определенным квантовым условиям. Электрон, находящийся на одной из этих орбит, несмотря на то, что он движется с ускорением, не излучает электромагнитных волн (света). 2. Излучение испускается или поглощается в виде светового кванта энергии ħω при переходе электрона из одного стационарного (устойчивого) состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый скачок электрона: ħω=En – Em
  Существование дискретных энергетических уровней атома подтверждается опытами, осуществленными в 1914 г. Франком и Герцем. Схема их установки приведена на рис. 7, а. В трубке, заполненной парами ртути под небольшим давлением (~1 мм рт. ст.), имелись три электрода: катод К, сетка С и анод А. Электроны, вылетавшие из катода вследствие термоэлектронной эмиссии, ускорялись разностью потенциалов V, приложенной между катодом и сеткой. Эту разность потенциалов можно было плавно менять с помощью потенциометра П. Между сеткой и анодом создавалось слабое электрическое поле (разность потенциалов порядка 0,5 В), тормозившее движение электронов к аноду. Существование дискретных энергетических уровней атома подтверждается опытами, осуществленными в 1914 г. Франком и Герцем. Схема их установки приведена на рис. 7, а. В трубке, заполненной парами ртути под небольшим давлением (~1 мм рт. ст.), имелись три электрода: катод К, сетка С и анод А. Электроны, вылетавшие из катода вследствие термоэлектронной эмиссии, ускорялись разностью потенциалов V, приложенной между катодом и сеткой. Эту разность потенциалов можно было плавно менять с помощью потенциометра П. Между сеткой и анодом создавалось слабое электрическое поле (разность потенциалов порядка 0,5 В), тормозившее движение электронов к аноду.
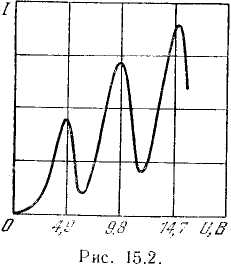
Такой ход кривой объясняется тем, что вследствие дискретности энергетических уровней атомы могут воспринимать энергию только порциями: ΔЕ1 =Е2 — Е1 либо ΔЕ2 = Е3 — Е1 и т. д., где Е1, Е2, Е3, — энергия 1-го, 2-го, 3-го и т.д. стационарных состояний. До тех пор, пока энергия электрона меньше ΔЕ1 соударения между электроном и атомом ртути носят упругий характер, причем, поскольку масса электрона во много раз меньше массы атома ртути, энергия электрона при столкновениях практически не изменяется. Часть электронов попадает на сетку, остальные же, проскочив через сетку, достигают анода, создавая ток в цепи гальванометра Г. Чем больше скорость, с которой электроны достигают сетки (чем больше U), тем больше будет доля электронов, проскочивших через сетку, и тем, следовательно, больше будет сила тока I. Когда энергия, накапливаемая электроном в промежутке катод - сетка, достигает значения ΔЕ1 соударения перестают быть упругими — электроны при ударах об атомы передают им энергию ΔЕ1 и продолжают затем двигаться с меньшей скоростью. Поэтому число электронов, достигающих анода, уменьшается. Например, при U = 5,3 В электрон сообщает атому энергию, соответствующую 4,9 В (первый потенциал возбуждения атома ртути), и продолжает двигаться с энергией 0,4 эВ. Если даже такой электрон окажется между сеткой и анодом, он не сможет преодолеть задерживающее напряжение 0,5 В и будет возвращен обратно на сетку. Атомы, получившие при соударении с электронами энергию ΔЕ1, переходят в возбужденное состояние, из которого они спустя время порядка 10-8 с возвращаются в основное состояние, излучая фотон с частотой ω=ΔЕ1/ħ.
При достаточном разрежении паров ртути и соответствующей величине ускоряющего напряжения электроны за время до столкновения с атомами могут приобретать скорость, достаточную для перевода атома в состояние с энергией Е3. В этом случае на кривой I = f (U)наблюдаются максимумы при напряжениях, кратных второму потенциалу возбуждения атома (для ртути этот потенциал равен 6,7 В), или при напряжениях, равных сумме первого и второго потенциалов возбуждения и т. д. Таким образом, в опытах Франка и Герца непосредственно обнаруживается существование у атомов дискретных энергетических уровней. На рис. показаны спектры некоторых атомов.
§ 17. Элементарная боровская теория водородного атома
Бор предположил, что из всех возможных орбит электрона осуществляются только те, для которых момент импульса электрона равен целому кратному постоянной Планка ħ:
Число п называется главным квантовым числом. Рассмотрим электрон, движущийся в поле атомного ядра с зарядом Zе. При Z = 1 такая система соответствует атому водорода, при иных Z — водородоподобному иону, т. е. атому с порядковым номером Z, из которого удалены все электроны, кроме одного. Электрон в атоме движется под действием кулоновской силы притяжения, которая является центростремительной силой. Уравнение движения электрона имеет вид:
Здесь k – коэффициент пропорциональности в законе Кулона, в частности в системе единиц СИ Исключив υ из уравнений (1) и (2), получаем, что радиус электронных орбит в атоме может принимать лишь ряд дискретных значений:
Радиус первой орбиты водородного атома называется боровским радиусом. Его значение равно (Z= 1, n =1):
Отметим, что боровский радиус имеет значение порядка газокинетическнх размеров атома. Внутренняя энергия атома слагается из кинетической энергии электрона (ядро неподвижно) и энергии взаимодействия электрона с ядром
Из (2) следует что:
Наконец, учтя значения r, даваемые (3), получим дозволенные значения внутренней энергии атома:
Схема энергетических уровней, определяемых (4), дана на рис. 1. При переходе атома водорода (Z= 1) из состояния n в состояние т излучается фотон
Частота испущенного света равна
Эта формула называется формулой Бальмера. Величина
При подстановке в это выражение числовых значений т, е и ħ получается величина, поразительно хорошо согласующаяся с экспериментальным значением постоянной Ридберга. Теория Бора была крупным шагом в развитии теории атома. Она с полной отчетливостью показала неприменимость классической физики к внутриатомным явлениям и главенствующее значение квантовых законов в микромире. Изложенная нами элементарная теория была подвергнута дальнейшему развитию и уточнениям, с которыми мы не станем, знакомиться, поскольку в настоящее время теория Бора имеет преимущественно историческое значение. После первых успехов теории все яснее давали себя знать ее недочеты. Особенно тягостной была неудача всех попыток построения теории атома гелия — одного из простейших атомов, непосредственно следующего за атомом водорода. Самой слабой стороной теории Бора, обусловившей последующие неудачи, была ее внутренняя логическая противоречивость: она не была ни последовательно классической, ни последовательно квантовой теорией. После открытия волновых свойств вещества стало совершенно ясно, что теория Бора, опирающаяся на классическую механику, могла быть только переходным этапом на пути к созданию последовательной теории атомных явлений.
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 809; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.008 с.) |

 На рис. 7, б показано изменение потенциальной энергии электрона Ep = - eφ в зазоре между электродами при различных значениях напряжения U между катодом и сеткой (φ — потенциал в соответствующей точке поля).
На рис. 7, б показано изменение потенциальной энергии электрона Ep = - eφ в зазоре между электродами при различных значениях напряжения U между катодом и сеткой (φ — потенциал в соответствующей точке поля).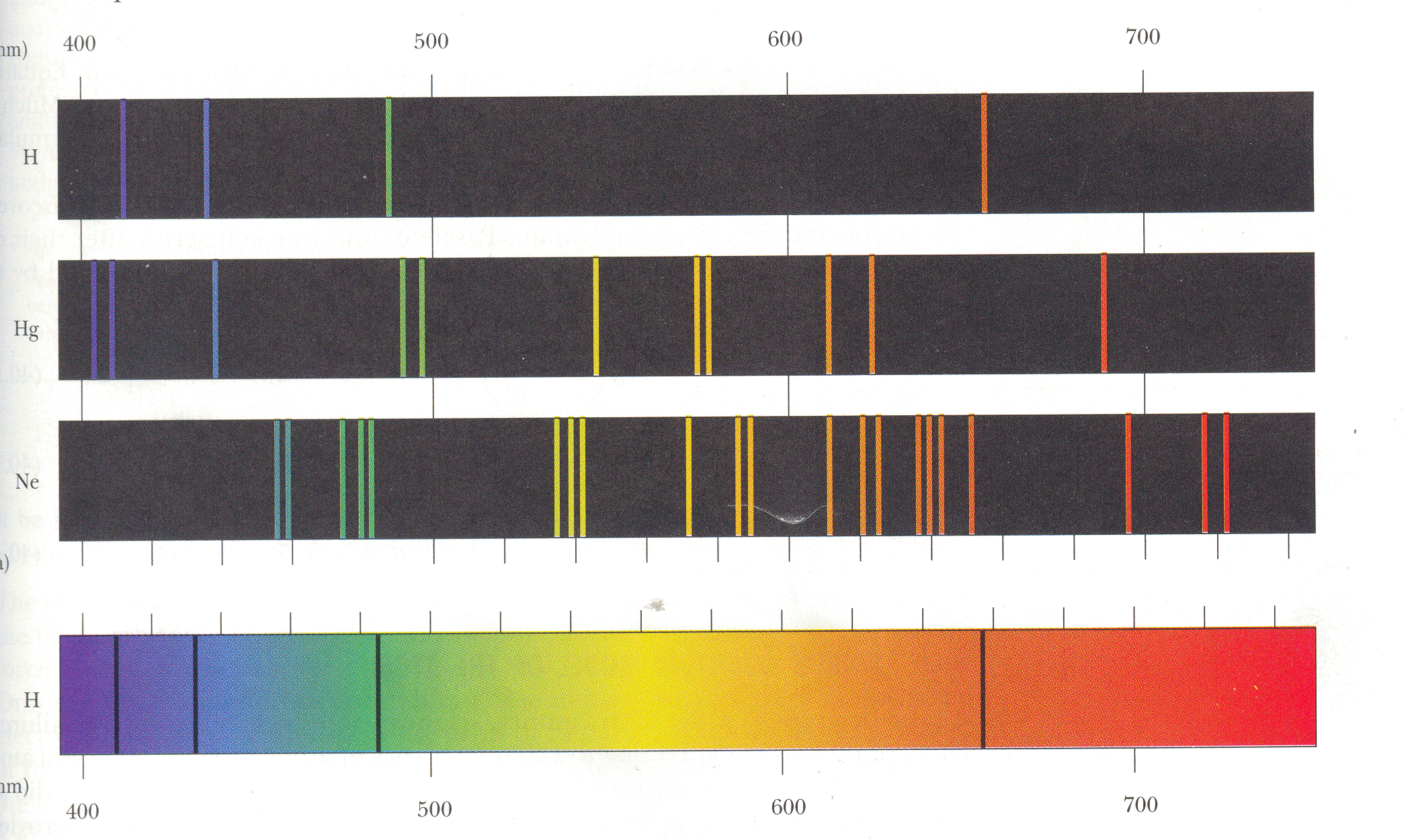
 (1)
(1) (2)
(2)
 (3)
(3)





 называется постоянной Ридберга. С учетом этого формула Бальмера приобретает вид:
называется постоянной Ридберга. С учетом этого формула Бальмера приобретает вид:



