
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ацетилсаліцилова кислота (аспірин) є складним ефіром саліцилової кислоти по фенольному гідроксилу. До складу молекули входитьСодержание книги
Поиск на нашем сайте
залишок оцтової кислоти):
Аспірин погано розчиняється у воді, набагато краще розчиняється у спирті. Як складний ефір аспірин легко гідролізується при кип’ятінні з водою з утворенням оцтової СН3-СООН і саліцилової кислот:
При неправильному зберіганні ацетилсаліцилова кислота також може розкладатися на оцтову і саліцилову кислоти. Для визначення чистоти ацетилсаліцилової кислоти проводять реакцію з хлорним залізом: саліциловакислота містить вільний фенольний гідроксил, тому дає фіолетове забарвлення з ферум (ІІІ) хлоридом, в складі ж ацетилсаліцилової кислоти вільний фенольний гідроксил відсутній, тому зміна забарвлення розчину не відбувається. Ацетилсаліцилова кислота володіє знеболювальною, протизапальною і жарознижувальною дією.
Методичні рекомендації по виконанню дослідів. Розчинність ацетилсаліцилової кислоти у різних розчинниках. Розтерти в ступці пігулку ацетилсаліцилової кислоти. Помістити частину лікарського засобу в пробірку і добавити води, суміш збовтати. Записати спостереження. ________________________________________________________________________________________________________________________________________ Суміш у пробірці нагріти до кипіння. Чи змінюється розчинність препарату при нагріванні? ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________
У пробірку з лікарським засобом добавити 3 мл етилового спирту, суміш нагріти. Записати спостереження. ____________________________________________________________________ ____________________________________________________________________ Зробити висновок про розчинність аспірину у різних розчинниках. ________________________________________________________________________________________________________________________________________ Взаємодія ацетилсаліцилової кислоти з розчином хлорного заліза (доказ відсутності фенольного гідроксилу). У пробірку помістити 1-2 крупинки ацетилсаліцилової кислоти, добавити 5 крапель води і енергійно струсити. Добавити в пробірку 1 краплю розчину хлорного заліза. Записати спостереження. __________________________________________________________________ Зробити висновок про наявність або відсутність фенольного гідроксилу у складі молекули ацетилсаліцилової кислоти. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Гідроліз ацетилсаліцилової кислоти. У пробірку помістити 1-2 крупинки ацетилсаліцилової кислоти, добавити 4-5 крапель води. Нагріти вміст пробірки до кипіння і кип’ятити на протязі 0,5 – 1 хв. Після чого добавити в пробірку 1 краплю розчину хлорного заліза. Записати спостереження і пояснити явище, що відбувається. Напишіть рівняння реакції гідролізу ацетилсаліцилової кислоти. ________________________________________________________________________________________________________________________________________ ____________________________________________________________________________________________________________________________________________________________________________________________________________
Зробити загальний висновок, про особливості будови та властивості ацетилсаліцилової кислот. ________________________________________________________________________________________________________________________________________ ____________________________________________________________________________________________________________________________________________________________________________________________________________ ? Контрольні питання. 1. Поясніть поняття: а) “лікарські препарати”: ______________________________________________ ____________________________________________________________________б) ”синтетичні лікарські препарати”_____________________________________ ____________________________________________________________________ в) “вакцини” ________________________________________________________ ____________________________________________________________________ г) “лікувальні сироватки ”______________________________________________ ____________________________________________________________________ д) “антибіотики”_____________________________________________________ ____________________________________________________________________ е) “антисептики” _____________________________________________________ ________________________________________________________________________________ є) “хіміотерапія” _____________________________________________________ ____________________________________________________________________ ж) “фармакотерапія” __________________________________________________ ____________________________________________________________________ Алкалоїди: морфін, кофеїн, хінін, кокаїн, атропін - їх значення в Медицині. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ____________________________________________________________________
Які жарознижувальні та знеболювальні засоби медицини Ви Знаєте? ____________________________________________________________________________________________________________________________________________________________________________________________________________
4. Які Вам відомі правила прийому ліків? ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лабораторна робота № 17 Тема: Порівняння властивостей мила і СМЗ
Мета: за допомогою хімічного експерименту вивчити та порівняти властивості мила і синтетичних мийних засобів, показати взаємозв'язок будови й властивостей миючих засобів, продовжити набувати навиків роботи в лабораторії. Досліди: 1. Виділення жирних кислот. 2. Одержання нерозчинних солей жирних кислот. 3. Порівняння мила й синтетичних миючих засобів.
Прилади та матеріали: Реактиви: фенолфталеїн, мило тверде, мило рідке, СМЗ (порошкоподібний), СМЗ (рідкий), вода дистильована (Н2О), сульфатна кислота (Н2SO4), купрум сульфат (СuSO4), плюмбум ацетат (СН3СОО)2Рb), кальцій хлорид (СаСl2). Обладнання: штатив з пробірками, тримач, спиртівка, хімічний стакан, піпетка, скляна паличка.
G Правила техніки безпеки 1. Приступайте до виконання роботи тільки після ознайомлення з текстом інструкції. 2. Користуйтеся чистим і придатним для роботи хімічним посудом. 3. Працюйте тільки з невеликою кількістю речовин. 4. Роботу проводьте стоячи, тільки над столом. 5. Насипайте, або наливайте сухі реактиви – над аркушем паперу, рідкі – над скляною посудиною. 6. Нагріваючи рідини, тримайте посудину отвором від себе і не спрямовуйте її на сусідів. 7. Не заглядайте в посудину згори під час нагрівання. 8. Не нагрівайте пробірку лише знизу, а рівномірно прогрівайте всю пробірку. 9. Під час роботи забороняється:
- пробувати речовини на смак (а), - брати речовини незахищеними руками (б), - залишати неубраними розсипані або розлиті реактиви (в), - залишати відкритими склянки з рідинами та банки з сухими речовинами (г).
& Теоретичне обґрунтування теми Мила - це натрієві або калієві солі вищих жирних кислот, які гідролізуються у водному розчині з утворенням кислоти й лугу. Натрієві солі вищих карбонових кислот – основна складова твердого мила, солі Калію – рідкого мила. Загальна формула твердого мила - R-COONa, рідкого мила – R-COOK. Добувають мило реакцію гідролізу (омилення) жирів:
або шляхом нейтралізації вищих карбонових кислот, які, в свою чергу, одержують при крекінгу й окислюванні нафтопродуктів: СН3(СН2)mCH3 + 3/2O2 → H2O + СН3(СН2)mCOOH
Одержання натрієвих солей: С n H m COOH + NaOH = С n H m COONa + H2O, або 2С n H m COOH + Na2СО3 = 2С n H m COONa + H2O + СО2↑.
Мило, добуте безпосередньо внаслідок цих реакцій, називається ядровим і відоме як господарське. Туалетне мило відрізняється від нього наявністю добавок: барвників, запашних речовин, антисептиків тощо. Cолі, утворені сильними основами лужних металів і слабких карбонових кислот, піддаються гідролізу:
С17H35COONa + НOH = С17H35COOН + NaOH.
Луг, що утворився, емульгується, частково розкладає жири й звільняє в такий спосіб прилиплу до тканини бруд. Карбонові кислоти з водою утворять піну, що захоплює частки бруду. Калієві солі в порівнянні з натрієвими краще розчинні у воді й тому мають більше сильну миючу властивість. Під час миття гідрофобна частина мила (R) проникає в гідрофобну забруднюючу речовину, у результаті поверхня кожної частки забруднення виявляється оточеною оболонкою гідрофільних груп (-СОО-Na+). Вони взаємодіють із полярними молекулами води. Завдяки цьому йони миючого засобу разом із забрудненням відриваються від поверхні тканини й переходять у водне середовище. Так відбувається очищення забрудненої поверхні миючою речовиною. Мило втрачає свою мийну дію в кислому середовище і в твердій воді. У кислому середовище мило як сіль сильної основи і слабкої кислоти гідролізується з утворенням нерозчинних вищих жирних кислот:
2С17Н35СООNa + Н2SO4 → 2С17Н35СООН + Na2SO4
В твердій воді мило перетворюється в нерозчинні кальцієві або магнієві солі карбонових кислот, які осідають на поверхні виробу:
2С17Н35СООNa + МgSO4 → (С17Н35СОО)2Мg↓ + Na2SO4
СМЗ мають подібну до мила будову молекул, але, на відміну від мила, є солями кислих естерів вищих спиртів і сульфатної кислоти і містять на кінці вуглеводневого радикалу не групу –СОО-, а, наприклад, ROSO2Na (сіль алкілсульфату) й в твердій воді не утворюють нерозчинних сполук, а отже й не втрачають миючих властивостей. У цьому полягає перевага СМЗ над звичайним милом. Однак, у процесі використання СМЗ не піддаються руйнуванню і, потрапляючи зі стічними водами у водойми, вони згубно діють на живі організми і порушують природну рівновагу. Сьогодні нагальною є проблема синтезу таких речовин, які, володіючи високою миючою дією, швидко розкладалися би на нешкідливі сполуки, екологічно безпечні.
|
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 810; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.245.172 (0.01 с.) |

 О
О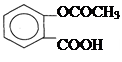 карбоксильна група - СООН і радикал ацетил СН3 – С (одновалентний
карбоксильна група - СООН і радикал ацетил СН3 – С (одновалентний
 аспірин оцтова кислота
аспірин оцтова кислота




