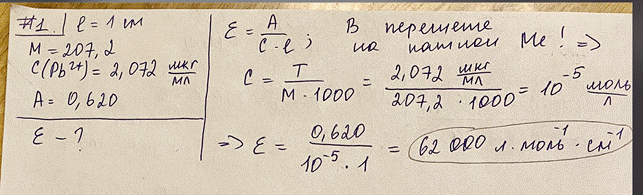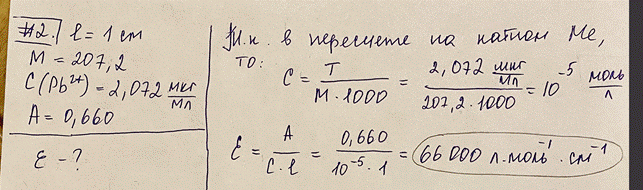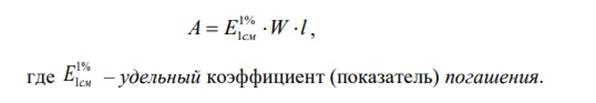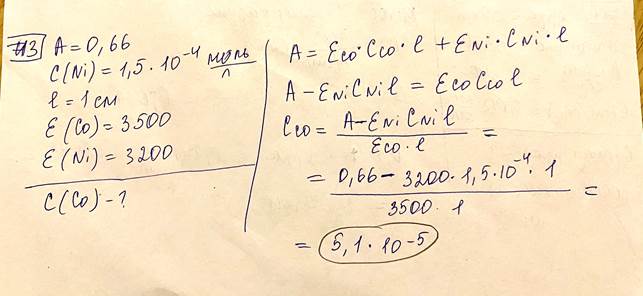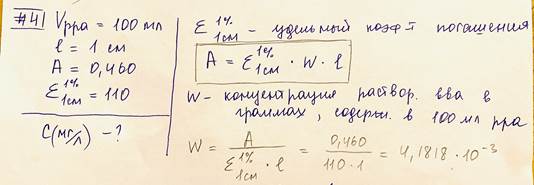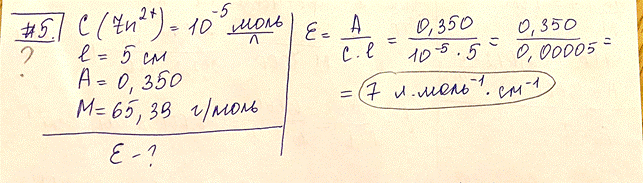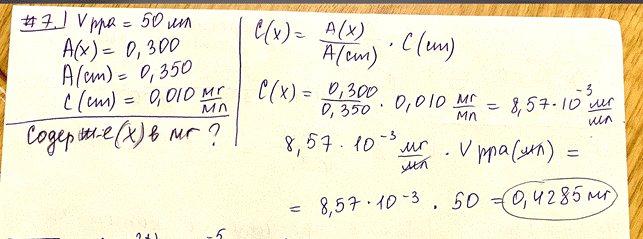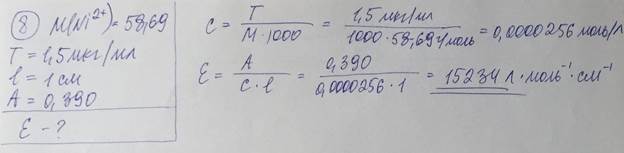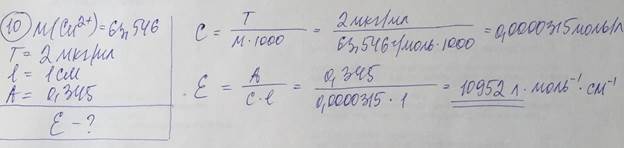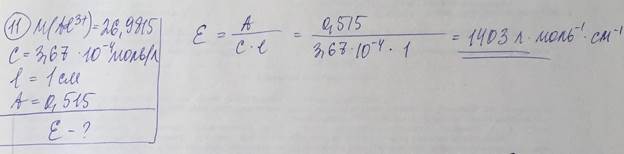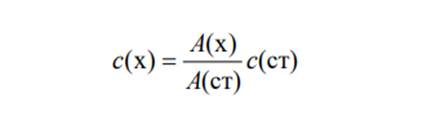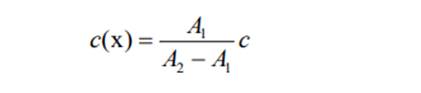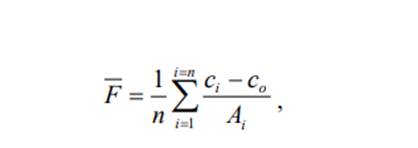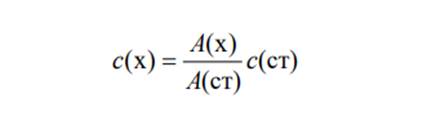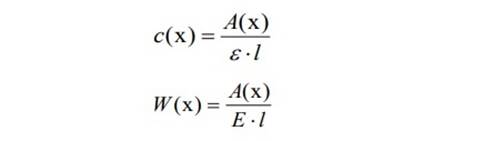Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Потом это число умножаем на 10000Содержание книги
Поиск на нашем сайте
ОБНОВЛЕНИЕ РЕШЕНИЯ 2,072*10^-6 * 1000 / 207,2
Тк 1000 должна быть вверху Основной закон светопоглощения — закон Бугера – Ламберта –Бера. При прохождении монохроматического светового потока через поглощающий раствор интенсивность прошедшего светового потока I отличается от интенсивности падающего светового потока Io на поглощение света раствором. Отношение I/Io называют пропусканием (или прозрачностью) раствора и обозначают Т. О сновной закона светопоглощения (закон Бугера-Ламберта-Беера), который можно представить в экспоненциальной форме: I = Io*e–kcl или в логарифмической форме: A = ε*c*l Io – интенсивность монохроматического излучения (светового потока), падающего на данную светопоглощающую среду; I – интенсивность излучения (светового потока), прошедшего через эту среду (I < Io); k – коэффициент (показатель) поглощения света (коэффициент светопоглощения); с – концентрация светопоглощающих частиц в данной среде; l – длина светопоглощающего слоя; е – основание натуральных логарифмов; А = lg (Io / I) – оптическая плотность (absorbance), которую также называют экстинкцией, погашением; ε = k / 2,3 – коэффициент(показатель) погашения, или коэффициент экстинкции (absovptivity). В количественном анализе используется преимущественно логарифмическая форма основного закона светопоглощения, поскольку оптическая плотность А прямо пропорциональна концентрации с. Величину ε называют молярным коэффициентом (показателем) погашения, или молярным коэффициентом (показателем) экстинкции (molar absorptivity), если концентрация выражена в единицах моль/л, а толщина l поглощающего слоя – в см (оптическая плотность А – безразмерная величина). Молярный коэффициент погашения измеряют в единицах л·моль–1·см–1.
2. Определение свинца(II) проводят спектрофотометрически с дитизоном в хлороформе при длине волны 520 нм и толщине кюветы 1 см. Определите удельный коэффициент погашения (в пересчете на катион металла, М = 207,2): C(Pb 2+) = 2,072 мкг/мл, А = 0,660. Сформулируйте основной закон светопоглощения. Назовите факторы влияющие на молярный и удельный коэффициенты погашения. Первый закон светопоглощения (первый закон фотометрии): каждый тонкий слой постоянной толщины внутри однородной среды поглощает одинаковую долю падающего на него светового потока. Второй закон светопоглощения (второй закон фотометрии): доля светового потока, поглощенного данным тонким слоем внутри однородной среды, пропорциональна числу светопоглощающих частиц в единице объема, т.е. концентрации. Первый закон светопоглощения называют законом Бугера-Ламберта, а второй – законом Бугера-Беера (или просто законом Беера), хотя оба закона светопоглощения открыты П. Бугером и описаны им в 1729 г. Оба закона светопоглощения выражают в виде одного объединенного основного закона светопоглощения (закона Бугера-Ламберта-Беера), который можно представить в экспоненциальной форме: I = Io*e–kcl или в логарифмической форме: A = ε*c*l Io – интенсивность монохроматического излучения (светового потока), падающего на данную светопоглощающую среду; I – интенсивность излучения (светового потока), прошедшего через эту среду (I < Io); k – коэффициент (показатель) поглощения света (коэффициент светопоглощения); с – концентрация светопоглощающих частиц в данной среде; l – длина светопоглощающего слоя; е – основание натуральных логарифмов; А = lg (Io / I) – оптическая плотность (absorbance), которую также называют экстинкцией, погашением; ε = k / 2,3 – коэффициент(показатель) погашения, или коэффициент экстинкции (absovptivity). В количественном анализе используется преимущественно логарифмическая форма основного закона светопоглощения, поскольку оптическая плотность А прямо пропорциональна концентрации с. Величину ε называют молярным коэффициентом (показателем) погашения, или молярным коэффициентом (показателем) экстинкции (molar absorptivity), если концентрация выражена в единицах моль/л, а толщина l поглощающего слоя – в см (оптическая плотность А – безразмерная величина). Молярный коэффициент погашения измеряют в единицах л·моль–1·см–1. Если концентрацию выразить в граммах растворённого вещества, содержащегося в 100 мл раствора, и обозначить её буквой W, а толщину поглощающего слоя l – в см, то основной закон светопоглощения можно представить в форме:
Удельный коэффициент погашения численно равен оптической плотности раствора с концентрацией W = 1г/100мл при толщине поглощающего слоя l = 1 см. - Молярный и удельный коэффициенты погашения зависят от: природы поглощающей среды, длины волны поглощаемого света, температуры. 3. Оптическая плотность раствора, содержащего кобальт (II) и никель (II) равна 0,66. Рассчитайте молярную концентрацию кобальта в этом растворе, если концентрация никеля равна 1,5∙10 ‒4 моль/л, а молярные коэффициенты погашения при 360 нм равны: для кобальта 3500, для никеля 3200. Толщина кюветы 1 см. Сформулируйте основной закон светопоглощения. Какое свойство оптической плотности лежит в основе расчетов в этой задаче? Основной закон светопоглощения — закон Бугера – Ламберта – Бера. При прохождении монохроматического светового потока через поглощающий раствор интенсивность прошедшего светового потока I отличается от интенсивности падающего светового потока Io на поглощение света раствором. Отношение I/Io называют пропусканием (или прозрачностью) раствора и обозначают Т.
В ОСНОВЕ РАСЧЕТОВ ЛЕЖИТ ✨✨✨ СВЕТОПОГЛОЩЕНИЕ ✨✨✨ На измерении светопоглощения окрашенных веществ в видимой области спектра основан фотометрический анализ; это разновидность молекулярно-абсорбционной спектроскопии.
Светопоглощение характеризуют также оптической плотностью А: А=-lgТ или А =lg I0/It,
Величина оптической плотности может принимать любые положительные значения от 0 до ∞; однако, современные приборы могут регистрировать изменение только от 0 до 2.
Зависимость между оптической плотностью раствора и содержанием в нем окрашенного вещества выражается законом светопоглощения Бугера-Ламберта-Бера: который можно представить в экспоненциальной форме: I = Io*e–kcl или в логарифмической форме: A = ε*c*l Io – интенсивность монохроматического излучения (светового потока), падающего на данную светопоглощающую среду; I – интенсивность излучения (светового потока), прошедшего через эту среду (I < Io); k – коэффициент (показатель) поглощения света (коэффициент светопоглощения); с – концентрация светопоглощающих частиц в данной среде; l – длина светопоглощающего слоя; е – основание натуральных логарифмов; А = lg (Io / I) – оптическая плотность (absorbance), которую также называют экстинкцией, погашением; ε = k / 2,3 – коэффициент(показатель) погашения, или коэффициент экстинкции (absovptivity). В количественном анализе используется преимущественно логарифмическая форма основного закона светопоглощения, поскольку оптическая плотность А прямо пропорциональна концентрации с. Величину ε называют молярным коэффициентом (показателем) погашения, или молярным коэффициентом (показателем) экстинкции (molar absorptivity), если концентрация выражена в единицах моль/л, а толщина l поглощающего слоя – в см (оптическая плотность А – безразмерная величина). Молярный коэффициент погашения измеряют в единицах л·моль–1·см–1.
4. Для определения железа в 100 мл раствора провели реакцию с о- фенантролином. Оптическая плотность этого раствора при толщине слоя 1 см оказалась равной 0,460. Определить содержание железа в растворе (в мг/л), если удельный коэффициент погашения окрашенного соединения равен 110. Что такое фотометрическая реакция? Назовите устройства, которые используют в спектрофотометрах для монохроматизации падающего светового потока? Г на 100 мл А нужно мг на л Должен быть ответ 41,8 Фотометрическая реакция – это реакция, которая приводит к появлению или изменению окраски раствора. В основе фотометрических измерений и расчетов (т.е. измерений и расчетов интенсивности светового излучения) лежат два закона светопоглощения (два закона фотометрии), характеризующие зависимость монохроматического (с постоянной длиной волны) излучения от толщины поглощающего слоя и от концентрации светопоглощающих частиц.
Для монохроматизации излучения часто используют светофильтры, т. е. устройства, изменяющие спектральный состав или энергию падающего на него излучения. Основной характеристикой светофильтра является его пропускание. Если в определенном интервале длин волн пропускание не зависит от длины волны, то такой светофильтр называется нейтральным или серым, в противном случае — селективным. 5. Испытуемый раствор содержит окрашенное комплексное соединение катиона цинка(II) с органическим реагентом с концентрацией катиона металла C(Zn 2+) = 1,00∙10 ‒5 моль/л. Рассчитайте молярный коэффициент погашения комплексного соединения в растворе в пересчете на катион металла, если измеренная оптическая плотность в кювете 5 см составила 0,350. (М = 65,39 г/моль). Что такое фотометрическая реакция? Что служит качественной характеристикой определяемого веществав молекулярно-адсорбционных методах анализа? ОБНОВЛЕНИЕ: ТУТ ОТВЕТ 7000, я посчитала как дебил (цифры подставлены верно) Фотометрическая реакция – это реакция, которая приводит к появлению или изменению окраски раствора. В основе фотометрических измерений и расчетов (т.е. измерений и расчетов интенсивности светового излучения) лежат два закона светопоглощения (два закона фотометрии), характеризующие зависимость монохроматического (с постоянной длиной волны) излучения от толщины поглощающего слоя и от концентрации светопоглощающих частиц. Качественной характеристикой определяемого вещества молекулярно- адсорбционных методах анализа является: СПЕКТР ПОГЛОЩЕНИЯ
6. По приведенным ниже данным с применением метода одного стандарта рассчитайте содержание (мг) дихромата калия в 50 мл анализируемого раствора, если при измерении оптическая плотность анализируемого раствора оказалась равной 0,320, а оптическая плотность стандартного раствора с концентрацией 0,012 мг/мл – 0,340. Сформулируйте основной закон светопоглощения. В каких координатах строят градуировочный график при использовании фотометрического метода анализа?
Основной закон светопоглощения — закон Бугера – Ламберта – Бера. При прохождении монохроматического светового потока через поглощающий раствор интенсивность прошедшего светового потока I отличается от интенсивности падающего светового потока Io на поглощение света раствором. Отношение I/Io называют пропусканием (или прозрачностью) раствора и обозначают Т.
закон Бугера – Ламберта – Бера который можно представить в экспоненциальной форме: I = Io*e–kcl или в логарифмической форме: A = ε*c*l Io – интенсивность монохроматического излучения (светового потока), падающего на данную светопоглощающую среду; I – интенсивность излучения (светового потока), прошедшего через эту среду (I < Io); k – коэффициент (показатель) поглощения света (коэффициент светопоглощения); с – концентрация светопоглощающих частиц в данной среде; l – длина светопоглощающего слоя; е – основание натуральных логарифмов; А = lg (Io / I) – оптическая плотность (absorbance), которую также называют экстинкцией, погашением; ε = k / 2,3 – коэффициент(показатель) погашения, или коэффициент экстинкции (absovptivity). В количественном анализе используется преимущественно логарифмическая форма основного закона светопоглощения, поскольку оптическая плотность А прямо пропорциональна концентрации с. Величину ε называют молярным коэффициентом (показателем) погашения, или молярным коэффициентом (показателем) экстинкции (molar absorptivity), если концентрация выражена в единицах моль/л, а толщина l поглощающего слоя – в см (оптическая плотность А – безразмерная величина). Молярный коэффициент погашения измеряют в единицах л·моль–1·см–1. Градуировочный график 1.Построение градуированного графика зависимости A = f(С) при выбранной длине волны ЛЯМБДА ( не могу символ вставить). Если раствор подчиняется основному закону светопоглощения, то график в координатах A–c представляет собой прямую линию, проходящую через начало координат. (В таком случае: Ось абсцисс — концентрация; Ось ординат — соответствующее значение оптической плотности)
2.Построение графика зависимости оптической плотности от длины волны для растворов различных концентраций. Если раствор подчиняется основному закону светопоглощения, то получают серию кривых одинаковой формы, независимо от толщины слоя раствора или концентрации вещества в растворе, сохраняющих положение максимума поглощения при одной и той же длине волны. 7. По приведенным ниже данным с применением метода одного стандарта рассчитайте содержание (мг) перманганата калия в 50 мл анализируемого раствора, если при измерении оптическая плотность анализируемого раствора оказалась равной 0,300, а оптическая плотность стандартного раствора с концентрацией 0,010 мг/мл – 0,350. Основной закон светопоглощения — закон Бугера – Ламберта – Бера. При прохождении монохроматического светового потока через поглощающий раствор интенсивность прошедшего светового потока I отличается от интенсивности падающего светового потока Io на поглощение света раствором. Отношение I/Io называют пропусканием (или прозрачностью) раствора и обозначают Т.
закон Бугера – Ламберта – Бера который можно представить в экспоненциальной форме: I = Io*e–kcl или в логарифмической форме: A = ε*c*l Io – интенсивность монохроматического излучения (светового потока), падающего на данную светопоглощающую среду; I – интенсивность излучения (светового потока), прошедшего через эту среду (I < Io); k – коэффициент (показатель) поглощения света (коэффициент светопоглощения); с – концентрация светопоглощающих частиц в данной среде; l – длина светопоглощающего слоя; е – основание натуральных логарифмов; А = lg (Io / I) – оптическая плотность (absorbance), которую также называют экстинкцией, погашением; ε = k / 2,3 – коэффициент(показатель) погашения, или коэффициент экстинкции (absovptivity). В количественном анализе используется преимущественно логарифмическая форма основного закона светопоглощения, поскольку оптическая плотность А прямо пропорциональна концентрации с. Величину ε называют молярным коэффициентом (показателем) погашения, или молярным коэффициентом (показателем) экстинкции (molar absorptivity), если концентрация выражена в единицах моль/л, а толщина l поглощающего слоя – в см (оптическая плотность А – безразмерная величина). Молярный коэффициент погашения измеряют в единицах л·моль–1·см–1.
Градуировочный график 1.Построение градуированного графика зависимости A = f(c) при выбранной длине волны ЛЯМБДА. Если раствор подчиняется основному закону светопоглощения, то график в координатах A–c представляет собой прямую линию, проходящую через начало координат. (В таком случае: Ось абсцисс — концентрация; Ось ординат — соответствующее значение оптической плотности) 2.Построение графика зависимости оптической плотности от длины волны для растворов различных концентраций. Если раствор подчиняется основному закону светопоглощения, то получают серию кривых одинаковой формы, независимо от толщины слоя раствора или концентрации вещества в растворе, сохраняющих положение максимума поглощения при одной и той же длине волны. 8. Испытуемый раствор содержит комплексное соединение – продукт соответствующей фотометрической реакции определяемого катиона металла с органическим реагентом. По приведенным ниже данным рассчитайте молярный коэффициент погашения этого комплексного соединения в растворе в пересчете на катион металла: Ni2+ (М = 58,69), концентрация 1,50 мкг/мл, толщина слоя 1,00 см, оптическая плотность 0,390. Что такое фотометрическая реакция? На чем основан количественный фотометрический анализ?
Фотометрическая реакция – это реакция, которая приводит к появлению или изменению окраски раствора. В основе фотометрических измерений и расчетов (т.е. измерений и расчетов интенсивности светового излучения) лежат два закона светопоглощения (два закона фотометрии), характеризующие зависимость монохроматического (с постоянной длиной волны) излучения от толщины поглощающего слоя и от концентрации светопоглощающих частиц. Первый закон светопоглощения (первый закон фотометрии): каждый тонкий слой постоянной толщины внутри однородной среды поглощает одинаковую долю падающего на него светового потока. Второй закон светопоглощения (второй закон фотометрии): доля светового потока, поглощенного данным тонким слоем внутри однородной среды, пропорциональна числу светопоглощающих частиц в единице объема, т.е. концентрации. Первый закон светопоглощения называют законом Бугера-Ламберта, а второй – законом Бугера-Беера (или просто законом Беера), хотя оба закона светопоглощения открыты П. Бугером и описаны им в 1729 г. Оба закона светопоглощения выражают в виде одного объединенного основного закона светопоглощения (закона Бугера-Ламберта-Беера), который можно представить в экспоненциальной форме: I = Io*e–kcl или в логарифмической форме: A = ε*c*l Io – интенсивность монохроматического излучения (светового потока), падающего на данную светопоглощающую среду; I – интенсивность излучения (светового потока), прошедшего через эту среду (I < Io); k – коэффициент (показатель) поглощения света (коэффициент светопоглощения); с – концентрация светопоглощающих частиц в данной среде; l – длина светопоглощающего слоя; е – основание натуральных логарифмов; А = lg (Io / I) – оптическая плотность (absorbance), которую также называют экстинкцией, погашением; ε = k / 2,3 – коэффициент(показатель) погашения, или коэффициент экстинкции (absovptivity). В количественном анализе используется преимущественно логарифмическая форма основного закона светопоглощения, поскольку оптическая плотность А прямо пропорциональна концентрации с. Величину ε называют молярным коэффициентом (показателем) погашения, или молярным коэффициентом (показателем) экстинкции (molar absorptivity), если концентрация выражена в единицах моль/л, а толщина l поглощающего слоя – в см (оптическая плотность А – безразмерная величина). Молярный коэффициент погашения измеряют в единицах л·моль–1·см–1.
9. Испытуемый раствор содержит комплексное соединение. По приведенным ниже данным рассчитайте молярный коэффициент погашения этого комплексного соединения в растворе в пересчете на катион металла. Fe3+ (М = 55,847), концентрация 2,00 мг/л, толщина слоя 5,00 см, оптическая плотность 0,350. Сформулируйте основной закон светопоглощения. Назовите факторы влияющие на молярный и удельный коэффициенты погашения.
Основной закон светопоглощения (закона Бугера-Ламберта-Беера): поглощение монохроматического света окрашенным раствором прямо пропорционально концентрации поглощающего свет вещества и толщине слоя раствора, через который он проходит. Экспоненциальная форма закона: I = Io*e–kcl Логарифмическая форма: A = ε*c*l который можно представить в экспоненциальной форме: I = Io*e–kcl или в логарифмической форме: A = ε*c*l Io – интенсивность монохроматического излучения (светового потока), падающего на данную светопоглощающую среду; I – интенсивность излучения (светового потока), прошедшего через эту среду (I < Io); k – коэффициент (показатель) поглощения света (коэффициент светопоглощения); с – концентрация светопоглощающих частиц в данной среде; l – длина светопоглощающего слоя; е – основание натуральных логарифмов; А = lg (Io / I) – оптическая плотность (absorbance), которую также называют экстинкцией, погашением; ε = k / 2,3 – коэффициент(показатель) погашения, или коэффициент экстинкции (absovptivity). В количественном анализе используется преимущественно логарифмическая форма основного закона светопоглощения, поскольку оптическая плотность А прямо пропорциональна концентрации с.
Величину ε называют молярным коэффициентом (показателем) погашения, или молярным коэффициентом (показателем) экстинкции (molar absorptivity), если концентрация выражена в единицах моль/л, а толщина l поглощающего слоя – в см (оптическая плотность А – безразмерная величина). Молярный коэффициент погашения измеряют в единицах л·моль–1·см–1. Если концентрацию выразить в граммах растворённого вещества, содержащегося в 100 мл раствора, и обозначить её буквой W, а толщину поглощающего слоя l – в см, то основной закон светопоглощения можно представить в форме:
Удельный коэффициент погашения численно равен оптической плотности раствора с концентрацией W = 1г/100мл при толщине поглощающего слоя l = 1 см. - Молярный и удельный коэффициенты погашения зависят от: природы поглощающей среды, длины волны поглощаемого света, температуры. 10. Испытуемый раствор содержит комплексное соединение. По приведенным ниже данным рассчитайте молярный коэффициент погашения этого комплексного соединения в растворе в пересчете на катион металла: Сu2+ (М = 63,546), концентрация 2,00 мкг/мл, толщина слоя 1,00 см, оптическая плотность 0,345. Сформулируйте основной закон светопоглощения. Назовите факторы влияющие на молярный и удельный коэффициенты погашения.
Основной закон светопоглощения (закона Бугера-Ламберта-Беера): поглощение монохроматического света окрашенным раствором прямо пропорционально концентрации поглощающего свет вещества и толщине слоя раствора, через который он проходит. Экспоненциальная форма закона: I = Io*e–kcl Логарифмическая форма: A = ε*c*l Io – интенсивность монохроматического излучения (светового потока), падающего на данную светопоглощающую среду; I – интенсивность излучения (светового потока), прошедшего через эту среду (I < Io); k – коэффициент (показатель) поглощения света (коэффициент светопоглощения); с – концентрация светопоглощающих частиц в данной среде; l – длина светопоглощающего слоя; е – основание натуральных логарифмов; А = lg (Io / I) – оптическая плотность (absorbance), которую также называют экстинкцией, погашением; ε = k / 2,3 – коэффициент(показатель) погашения, или коэффициент экстинкции (absovptivity). В количественном анализе используется преимущественно логарифмическая форма основного закона светопоглощения, поскольку оптическая плотность А прямо пропорциональна концентрации с.
Величину ε называют молярным коэффициентом (показателем) погашения, или молярным коэффициентом (показателем) экстинкции (molar absorptivity), если концентрация выражена в единицах моль/л, а толщина l поглощающего слоя – в см (оптическая плотность А – безразмерная величина). Молярный коэффициент погашения измеряют в единицах л·моль–1·см–1. Если концентрацию выразить в граммах растворённого вещества, содержащегося в 100 мл раствора, и обозначить её буквой W, а толщину поглощающего слоя l – в см, то основной закон светопоглощения можно представить в форме:
Удельный коэффициент погашения численно равен оптической плотности раствора с концентрацией W = 1г/100мл при толщине поглощающего слоя l = 1 см. - Молярный и удельный коэффициенты погашения зависят от: природы поглощающей среды, длины волны поглощаемого света, температуры. 11. Испытуемый раствор содержит комплексное соединение. По приведенным ниже данным рассчитайте молярный коэффициент погашения этого комплексного соединения в растворе в пересчете на катион металла: Al3+ (М = 26,9815), концентрация 3,67∙10‒4 моль/л, толщина слоя 1,00 см, оптическая плотность 0,515 Опишите наиболее распространенные методики определения концентрации или массы вещества в фотометрических методах анализа.
При обработке данных фотометрических измерений концентрацию определяемого вещества в анализируемом растворе находят разными методами. Метод градуировочного графика. По результатам измерения оптической плотности А пяти-шести эталонных растворов с различной точно известной концентрацией с при аналитической длине волны строят градуировочный график в координатах А – с. Измеряют оптическую плотность Аx анализируемого раствора в тех же условиях, в которых измеряли оптическую плотность эталонных растворов. По найденному значению Аx находят концентрацию cx определяемого вещества на градуировочном графике. Метод одного стандарта (метод стандартного образца). Готовят стандарт (стандартный раствор) – раствор с точно известной концентрацией определенного вещества с(ст) – и измеряют его оптическую плотность А(ст) при аналитической длине волны по отношению к раствору сравнения. Затем в тех же условиях измеряют оптическую плотность А(x) анализируемого раствора с неизвестной концентрацией c(x) определяемого вещества, которую рассчитывают по формуле:
Определение концентрации по молярному или удельному коэффициенту погашения. Численное значение молярного ε или удельного Е коэффициента погашения должно быть известно. Измеряют оптическую плотность А(x) анализируемого раствора с неизвестной концентрацией c(x) определяемого вещества при аналитической длине волны в кювете с толщиной поглощающего слоя l. По измеренному значению А(x) рассчитывают концентрацию c(x):
где концентрация c(x) выражена в единицах моль/л, а концентрация W(x) – в г/100мл раствора. Метод добавок стандарта. Готовят два раствора: первый – анализируемый раствор с неизвестной концентрацией c(x) определяемого вещества и второй – анализируемый раствор, к которому прибавили точно известное количество (добавка стандарта) определяемого вещества, так что его концентрация во втором растворе равна c(x) + c, где с – точно известное увеличение концентрации за счет прибавления добавки стандарта. Измеряют последовательно оптическую плотность А1 и А2 соответственно первого и второго растворов в одной и той же кювете при аналитической длине волны и рассчитывают концентрацию c(x) по формуле:
Определение концентрации нескольких веществ при их совместном присутствии. Пусть в анализируемом растворе присутствуют два вещества – компонент 1 и компонент 2, не вступающие в химическое взаимодействие друг с другом. Компонент 1 имеет в спектре поглощения полосу с максимумом при 120 длине волны λ1, а компонент 2 – полосу с максимумом при длине волны λ2. Обе полосы частично налагаются друг на друга, так что суммарное светопоглощение раствора при обеих длинах волн складывается из светопоглощения обоих компонентов. Пусть оптическая плотность раствора, измеренная при длинах волн λ1 и λ2 в кювете с толщиной поглощающего слоя l, равна А1 и А2 соответственно. Тогда концентрации с1 и с2 обоих компонентов в анализируемом растворе рассчитываются по формулам:
Аналогично рассчитываются концентрации веществ и в тех случаях, когда в анализируемом растворе одновременно присутствует более двух определяемых веществ. Расчёт концентрации вещества, определяемого методом дифференциальной фотометрии. Для расчетов используют уравнение: Сх = Со + FАx, где сх – концентрация определяемого вещества в анализируемом растворе; со – концентрация определяемого вещества в эталонном растворе, относительно которого проведены измерения оптической плотности; Аx – оптическая плотность анализируемого раствора, измеренная относительно эталонного раствора с концентрацией со; F – фактор пересчёта, среднее значение F которого рассчитывают по формуле:
В формуле (5.15) n – число эталонных растворов с концентрацией сi определяемого вещества и оптической плотностью Аi, измеренной относительно эталонного раствора с концентрацией со. Расчёт минимальной и оптимальной концентрации растворённого вещества, определяемого фотометрическими методами. Минимальная концентрация cmin определяемого вещества в анализируемом растворе рассчитывается по формуле (5.16):
где ε – молярный коэффициент погашения. При этом предполагается, что минимальное значение оптической плотности А, которые можно измерить на обычном спектрофотометре, составляет А = 0,01 при толщине поглощающего слоя l = 1 см. Оптимальная концентрация растворенного вещества при фотометрических измерениях рассчитывается для наименьшей относительной систематической ошибки при значении оптической плотности А = 0,434 по формуле:
где ε – молярный коэффициент погашения, l – толщина поглощающего слоя,см. 12. По приведенным ниже данным рассчитайте удельный коэффициент погашения продукта фотометрической реакции в растворе в пересчете на определяемое вещество: цианокобаламин (М = 1355), концентрация 20,0 мг/л, толщина слоя 1,00 см, оптическая плотность 0,720. Опишите наиболее распространенные методики определения концентрации или массы вещества в фотометрических методах анализа.
При обработке данных фотометрических измерений концентрацию определяемого вещества в анализируемом растворе находят разными методами. Метод градуировочного графика. По результатам измерения оптической плотности А пяти-шести эталонных растворов с различной точно известной концентрацией с при аналитической длине волны строят градуировочный график в координатах А – с. Измеряют оптическую плотность Аx анализируемого раствора в тех же условиях, в которых измеряли оптическую плотность эталонных растворов. По найденному значению Аx находят концентрацию cx определяемого вещества на градуировочном графике. Метод одного стандарта (метод стандартного образца). Готовят стандарт (стандартный раствор) – раствор с точно известной концентрацией определенного вещества с(ст) – и измеряют его оптическую плотность А(ст) при аналитической длине волны по отношению к раствору сравнения. Затем в тех же условиях измеряют оптическую плотность А(x) анализируемого раствора с неизвестной концентрацией c(x) определяемого вещества, которую рассчитывают по формуле:
Определение концентрации по молярному или удельному коэффициенту погашения. Численное значение молярного ε или удельного Е коэффициента погашения должно быть известно. Измеряют оптическую плотность А(x) анализируемого раствора с неизвестной концентрацией c(x) определяемого вещества при аналитической длине волны в кювете с толщиной поглощающего слоя l. По измеренному значению А(x) рассчитывают концентрацию c(x):
где концентрация c(x) выражена в единицах моль/л, а концентрация W(x) – в г/100мл раствора. Метод добавок стандарта. Готовят два раствора: первый – анализируемый раствор с неизвестной концентрацией c(x) определяемого вещества и второй – анализируемый раствор, к которому прибавили точно известное количество (добавка стандарта) определяемого вещества, так что его концентрация во втором растворе равна c(x) + c, где с – точно известное увеличение концентрации за счет прибавления добавки стандарта. Измеряют последовательно оптическую плотность А1 и А2 соответственно первого и второго растворов в одной и той же кювете при аналитической длине волны и рассчитывают концентрацию c(x) по формуле:
Определение концентрации нескольких веществ при их совместном присутствии. Пусть в анализируемом растворе присутствуют два вещества – компонент 1 и компонент 2, не вступающие в химическое взаимодействие друг с другом. Компонент 1 имеет в спектре поглощения полосу с максимумом при 120 длине волны λ1, а компонент 2 – полосу с максимумом при длине волны λ2. Обе полосы частично налагаются друг на друга, так что суммарное светопоглощение раствора при обеих длинах волн складывается из светопоглощения обоих компонентов. Пусть оптическая плотность раствора, измеренная при длинах волн λ1 и λ2 в кювете с толщиной поглощающего слоя l, равна А1 и А2 соответственно. Тогда концентрации с1 и с2 обоих компонентов в анализируемом растворе рассчитываются по формулам:
Аналогично рассчитываются концентрации веществ и в тех случаях, когда в анализируемом растворе одновременно присутствует более двух определяемых веществ. Расчёт концентрации вещества, определяемого методом дифференциальной фотометрии. Для расчетов используют уравнение: Сх = Со + FАx, где сх – концентрация определяемого вещества в анализируемом растворе; со – концентрация определяемого вещества в эталонном растворе, относительно которого проведены измерения оптической плотности; Аx – оптическая плотность анализируемого раствора, измеренная относительно эталонного раствора с концентрацией со; F – фактор пересчёта, среднее значение F которого рассчитывают по формуле: | ||
|
| Поделиться: |