
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Исследование кинетики твердофазных реакцийСодержание книги
Поиск на нашем сайте
Большинство твердофазных процессов относится к классу топохимических, для которых характерно участие в реакции по крайней мере одного твердого вещества и образование газообразного продукта. В качестве примеров топохимических реакций можно привести процессы термического разложения карбоната кальция CaCO3(ТВ) → СaO(ТВ) + СО2(Г) и восстановление оксида железа водородом Fe2O3(ТВ) + 3 Н2(Г) → 2 Fe(ТВ) + 3 H2O(Г). Для топохимических реакций утрачивает смысл понятие «концентрация». Для удобства вывода математических моделей кинетики топохимической реакций скорость процесса определяют как изменение массы твердого вещества в единицу времени:
В случае реакции между двумя и более веществами под dm следует понимать изменение массы того реагента, который взят в недостаточном количестве по сравнению со стехиометрией реакции. Используют также понятие степени превращения исходного вещества: где mo – исходная масса, m – масса вещества в процессе реакции. Различие между понятиями «степень превращения» и «концентрация» состоит в следующем. В отличие от концентрации степень превращения не является однозначной характеристикой системы при фиксированных параметрах состояния (давление, температура). Одинаковое значение степени превращения может быть достигнуто в разнообразных системах идентичного состава, отличающихся структурой реакционной зоны, в которой первоначально образуется и накапливается в дальнейшем продукт реакции. Топохимические реакции имеют кинетические особенности. Во-первых, в процессе превращения происходит изменение скорости реакции во времени, иными словами наблюдается внутренняя нестационарность. В начале процесса скорость мала, затем возрастает, проходит через максимум и снижается до весьма малых значений, в ряде случаев задолго до завершения процесса (рис1 а). В соответствии с этим интегральная кинетическая кривая, отражающая зависимость степени превращения твердого реагента от времени, имеет сигмоидную (S-образную) форму, на которой можно выделить следующие области: I - индукционный период, II - зона активного развития процесса и III - затухание реакции (рис.1 б).
На стадии индукционного периода происходит деформация кристаллической решетки, сопровождающаяся увеличением размеров реакционной зоны. При этом степень превращения составляет обычно не более 0,1. Завершение индукционного периода всегда условно. Продолжительность индукционного периода tинд измеряется приближенно путем графического анализа S-образной кривой (рис.1б). По его продолжительности можно судить об устойчивости вещества к термическому распаду. Продолжительность индукционного периода зависит от температуры, с увеличением которой происходит его уменьшение. Далее происходит резкое ускорение реакции, обусловленное образованием ядер (зародышей) новой фазы, которые представляют собой совокупность частиц твердого продукта, содержащих элементы его собственной кристаллической структуры. Зародышами новой фазы могут стать частицы, обладающие избытком энергии по сравнению со средним уровнем энергии частиц системы. Наиболее вероятные места их образования – потенциальные центры зародышеобразования: грани, ребра, вершины кристаллов и различные дефекты. Появление зародышей сопровождается возникновением поверхности раздела фаз и увеличением наблюдаемой скорости реакции. Поверхность раздела фаз возрастает по мере увеличения количества зародышей до тех пор, пока не произойдет объединения ядер новой фазы. Поверхность раздела фаз является в свою очередь реакционной зоной, толщина которой имеет порядок одной молекулы. Образование зародышей новой фазы катализирует процесс разложения, скорость которого становится максимальной в момент соприкосновения участков новой фазы между собой. По мере уменьшения поверхности раздела фаз происходит снижение наблюдаемой скорости процесса в основном за счет медленной диффузии реагирующего газа через слой твердого продукта реакции, которая является лимитирующей стадией процесса. Реакция завершается образованием сплошного слоя твердого продукта. Вышеизложенная теория протекания топохимических реакций через образование зародышей получила многочисленные экспериментальные подтверждения с помощью современных методов физико-химического анализа. Таким образом, топохимическую реакцию можно представить как последовательность следующих стадий: 1. образование отдельных молекул или элементарных ячеек продукта на поверхности исходного вещества;
Схематически модель протекающего процесса представлена на рис 5.2.
Рис. 2. Схема развития реакционной зоны на зернах порошка Топохимические процессы относятся к автокаталитическим реакциям, поскольку локализованы на границе раздела фаз твердое исходное вещество – твердый продукт реакции. Катализирующее действие в первую очередь связано с облегченным ростом новой фазы вследствие ориентационно-размерного соответствия кристаллических решеток реагентов. Автокаталитический характер восстановления обусловливает зональность, т.е. возникновение пространственного разграничения зон различного фазового состава. Скорость топохимической реакции является не только функцией времени или степени превращения, но и зависит также от давления газообразных компонентов и температуры процесса. Для кинетического описания используют различные топохимические модели, представленные в табл.2. Модельные уравнения получены на основании представлений о геометрии продвижения и формирования реакционной границы раздела фаз и диффузии в твердом теле. Таблица 2 Типы топохимических моделей
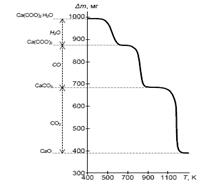
Наиболее простым и наглядным приемом для поиска математической модели процесса является метод афинных преобразований, или метод трансформаций, одним из вариантов которого является метод приведенного времени. Метод приведенного времени заключатся в изменении масштаба времени для облегчения процедуры сравнения. Сначала выбирают стандартный масштаб, к которому приводят экспериментальные данные и модельные кривые. Наиболее часто данные приводят к масштабу τr при α=0,9, при этом τr=τ/ τ0.9 при α=0,5. Для оценки точности соответствия экспериментальных данных выбранной модели применяют метод линеаризации. Для этого экспериментальные данные преобразуют в координаты выбранного уравнения, например для уравнения Ерофеева-Аврами: αэкспер подставляют в интегральную форму уравнения и строят график в координатах (-ln(1- αэкспер)))- τэкспер. Если экспериментальные точки укладываются на прямую, то выбранное уравнение адекватно отражает данные эксперимента. Угловой коэффициент уравнения соответствует константе реакции при данной температуре. Определив константы реакции при разных температурах, строят график в координатах ln(k)-1/T10-3K и находят графическим методом энергию активации процесса, равную R·tg α. По величине энергии активации делают вывод об области протекания процесса. Следует отметить, что сам по себе факт удовлетворительного описания экспериментальных данных каким-либо кинетическим уравнением еще нельзя рассматривать как доказательство применимости конкретного механизма, выводы должны быть подкреплены независимыми доказательствами, например микроскопическими наблюдениями. ТЕРМИЧЕСКИЙ АНАЛИЗ Термический анализ является одним из важнейших методов физико-химического исследования веществ. При воздействии высоких температур протекают химические реакции (дегидратация, разложение и т.д.) и физические превращения (плавление, полиморфные переходы и т.д.). Термический анализ широко используется при исследовании твердофазных процессов, реакций термического разложения и фазовых превращений веществ. В основе метода лежит зависимость физических или химических свойств материалов от температуры. В зависимости от измеряемого параметра различают основные методы исследований: - дилатометрия – измерение линейных и объемных размеров материалов; дифференциально-термический анализ (ДТА) – определение разности температур между образцом и эталоном; - дифференциально-сканирующая калориметрия (ДСК) основан на непрерывной регистрации разности теплового потока от образца и эталона как функция температуры; - термогравиметрический анализ (ТГА) – определение величины и характера изменения массы образца в условиях программируемого подъема температуры. - синхронный термический анализ предполагает одновременное использование термогравиметрии и дифференциальной сканирующей калориметрии (ТГА/ДСК) или термогравиметрии и дифференциального термического анализа (ТГА/ДТА). Наиболее широко применяются термогравиметрический и дифференциальный термический анализы. Термогравиметрический метод анализа основан на регистрации изменения массы образца при повышении температуры. Изменение массы твердых тел обусловлено протекающими физико-химическими процессами. Для процессов разложения и диссоциации характерно уменьшение массы образца, для реакции окисления − напротив, увеличение массы. Установка для термогравиметрических исследований состоит из термовесов, предназначенных для непрерывной регистрации изменений массы, печи, в которую помещен образец, термопары и программного регулятора температуры. Термогравиметрический анализ (ТГА) заключается в измерении зависимости массы твердого образца от температуры среды, в которую он помещен. Кривая потери массы от температуры (кривая ТГ, рис. 2) имеет вид плато, горизонтальный участок которой говорит об устойчивости химического соединения в данном интервале и отсутствии химических превращений (при этом физические превращения не исключается), вертикальный участок на кривой свидетельствует о химическом разложении материала. На основании кривой ТГ можно определить потерю массы при нагревании (Δ m), что позволяет оценить содержание примесей в анализируемом материале. Для этого необходимо знать состав химического соединения, относящегося к данному температурному плато, и состав продукта разложения.
Рис. 3. Термогравиметрическая кривая разложения кристаллогидрата оксалата кальция
К сожалению, кривая ТГ не позволяет точно определить температуру разложения (истинную температуру химической реакции). Температуру химической реакции можно с высокой точностью определить, если воспользоваться дифференциальной формой записи, показывающей скорость изменения массы образца Возможны следующие варианты методов исследований: изотермический, когда масса образца изменяется на протяжении некоторого времени при выбранной температуре, квазистатический, когда образец нагревается при каждой из ряда возрастающих температур до достижения постоянного значения массы, и динамический, когда температура среды, окружаемой нагреваемый образец, изменяется по заданному закону. Из большого числа различных типов химических реакций наиболее хорошо изучены реакции разложения, на протекание которых в статических условиях в значительной степени влияют давление и состав газовой фазы, а в проточных системах - гидродинамические условия. Для определения состава газовой фазы используют химические и инструментальные методы анализа. Для этого должен быть предусмотрен непосредственный контакт ячейки с измерительным прибором (манометром или газовой бюреткой). Для определения количественного состава газовой фазы часто прибегают к вымораживанию, поглощению или превращению продуктов в легко анализируемую форму. Метод дифференциального термического анализа (ДТА) основан на сравнении термических свойств образца исследуемого вещества и термически инертного эталона, в качестве которого применяются вещества, не претерпевающие никаких изменений при нагревании до требуемой температуры. В качестве эталонов применяются прокаленные оксиды алюминия или магния. Нулевой линией называется параллельная оси абсцисс линия, проведенная через начало хода кривой ДТА. Часто после завершения процесса разложения кривая ДТА не возвращается к нулевой линии, а идет параллельно ей или под некоторым углом. Эта линия хода термической кривой носит название базисной линии. Расхождение базисной и нулевой линий обусловлено различными теплофизическими свойствами исследуемого и эталонного веществ. Схематическое изображение простой (Т) и дифференциальной (ДТА) кривых нагревания приведено на рис. 4.
Рис. 4. Схематическое изображение простой (Т) и дифференциальной (ДТА) кривых нагревания
Экстремумы (пики) на кривой ДТА на базисной линии соответствуют термическим эффектам. Так, эндотермические превращения отображаются отклонением кривой ДТА ниже базисной линии, выше базисной линии – экзотермическими. Первые обычно обозначаются знаком «минус», вторые – «плюс». Положение термических эффектов на термограмме кривой ДТА характеризуется температурными границами протекания реакции. Значение температур определяют графически, снося соответствующие точки с кривой ДТА на простую температурную кривую, а затем на ось температур. Устанавливают температуры начала Т 0, максимума Т max и окончания термического эффекта Тк. Вследствие трудностей, связанных с определением графических путей температуры начала реакции, наиболее надежной характеристикой является температура Т mах. Изменения температуры образца вызываются физическими переходами или химическими реакциями, связанными с изменением энтальпии. К ним относятся фазовые переходы, плавление, перестройка кристаллической структуры, реакции дегидратации и разложения, разрушение кристаллической решетки и др. В общем случае фазовые переходы, дегидратация, восстановление и некоторые реакции разложения сопровождаются эндотермическими эффектами, а кристаллизация, окисление и отдельные процессы термолиза – экзотермическими эффектами. Дериватография (от лат. derivatus- отведенный, отклоненный и греч. Apho-пишу)-комплексный метод исследования химических и физико-химических процессов, происходящих в твердом теле в условиях программного подъема температуры, получивший в настоящее время широкое распространение. Дериватография основана на сочетании дифференциального термического анализа с другими физико-химическими методами термогравиметрией, масс-спектрометрией и т.д. Дериватографом называется прибор, совмещающий термогравиметрический и дифференциальный термический анализы. При проведении дериватографических исследований регистрируются четыре кривые (рис. 4.5): - зависимость температуры от времени носит линейный характер и показывает скорость нагрева образца (Т); - термогравиметрическая кривая показывает зависимость изменения массы от температуры нагрева образца (ТГ); - кривая дифференциально-термического анализа отражает тепловые эффекты процессов, происходящих при нагревании вещества (ДТА); - дифференциально-термогравиметрическая кривая отражает скорость изменения массы образца (ДТГ). Основным отличием дериватографа от других термических установок является тождественность условий опыта, что достигается путем одновременной регистрации всех кривых на одном листе для одной и той же навески при соответствующих одинаковых температурах нагрева. Совместное получение простой и дифференциальной кривых дает возможность обнаружить и количественно оценить даже очень слабые эффекты потери массы в изучаемом веществе. Дериватограф Q-1500D позволяет проводить термогравиметрические исследования при нагревании образца до 1500 оС, а также квазитермические и квазиизобарные измерения при температурах до 100 оС. Последние обеспечивают значительно большую селективность по сравнению с традиционными измерениями, при которых нагрев печи производится по линейному закону. При этом происходит удлинение температурного интервала разложения, вызываемое прежде всего перепадом температуры внутри пробы, что несомненно является следствием динамического нагревания печи. Такое явление особенно ярко проявляется при нагреве с высокой скоростью. Однако при медленном нагреве или при изотермическом исследовании значительно реже проявляются погрешности. Желаемый нагрев со скоростью 0,1-0,2 град/мин в практических условиях неосуществим вследствие высокой продолжительности опыта. Решением этой проблемы является Q -дериватография. Квазитермический режим предусматривает нагрев образца с большой скоростью (2-5 о/мин) до момента разложения, затем нагрев прекращается. Регулирование температуры производится таким образом, чтобы изменение массы происходило с очень малой скоростью, величина которой задается путем изменения порога чувствительности усилителя. Схематическое устройство дериватографа марки Q-1500D приведено на рис. 4.5.
Рис.5. Принципиальная схема дериватографа Q-1500D: 1 − тигель с исследуемым образцом; 2 − печь; 3 − керамическая трубка с термопарами; 4 − весы; 5 − программатор нагрева; 6 − датчик скорости изменения массы; 7 − датчик изменения массы; 8 − усилитель выходного сигнала; 9 − дериватограммма; 10 − термопара; 11 − защитный кварцевый стакан; 12 − подвод инертного газа; a – изменение температуры эталона (Т); и- запись дифференциального термического анализа (DTA); с- изменение массы образца (TG); в- скорость изменения массы образца (DTG).
Важнейшей частью дериватографа является термовесовой блок, в котором располагаются равноплечные аналитические весы (4), снабженные пневмозатухающим устройством. На одном плече весов находятся на керамическом стержне с термоэлементом (1) два тигля, в одном из которых находится исследуемый образец, а в другом − инертное вещество. Устройство тиглей изображено на поз. 10. Внутри тигля имеется термопарный чехол, для регистрации температуры внутри образца. Керамическая трубка с тиглем в процессе работы помещается в печь (2), подъем и опускание которой производятся автоматически. Режим работы дериватографа, а именно скорость нагрева, задаются с помощью программатора нагрева (5). Изменение массы регистрируется с помощью датчика изменения массы (7). Определение скорости изменения массы производится с помощью дифференциального трансформатора – датчика изменения массы (6), который преобразует движение плеча весов в соответствующий электрический сигнал. Затем с помощью усилителя выходного сигнала (8) информация преобразовывается в дериватограмму (9), на которой представлено одновременно четыре кривых. В зависимости от условий опыта возможно проведение термического анализа в инертной среде, например в аргоне, для чего в приборе предусмотрен ввод газа (12). Иногда для температурной стабилизации и уменьшения градиента температур используют защитный кварцевый стакан (11). Особое внимание необходимо уделить рассмотрению влияния скорости нагревания на наблюдаемую температуру разложения образца. Неизотермические методы определения кинетических параметров по сравнению с изотермическими обладают рядом преимуществ: требуется гораздо меньше данных; кинетические параметры могут быть рассчитаны для всего диапазона температур; при нагревании до исследуемой температуры образец часто вступает в реакцию, поэтому результаты, полученные изотермическими методами, нередко оказываются недостоверными; для исследования требуется одни образец. Однако неизотермический метод не дает информации о механизме реакции, о достоверных значения энергии активации и порядка реакции. Расчет кинетических параметров по ТГ −кривой основаны на формальном кинетическом уравнении. где Это уравнение хорошо описывает кинетику термического разложения твердых веществ, например оксалатов, перманганатов и перхлоратов металлов. Зависимость удельной константы скорости от температуры описывается уравнением Аррениуса: k = A·e - E / RT , (4.2) где А – предэкспоненциальный множитель; Е - энергия активации; R - универсальная газовая постоянная. Для изучения кинетики разложения используются дифференциальный и интегральный методы, а также метод аппроксимации. Остановимся более подробно на методах расчета кинетических параметров, получивших наибольшее распространение Метод Ньюкирка На основании ТГ -кривой Ньюкирк получил выражение для расчета скорости реакции разложения. Для температур Т1 и Т2 остаточные массы образца составляют Зависимость ln k = f (1/ T) в этом случае носит линейный характер.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 353; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.137.244 (0.016 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||

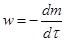
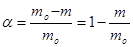 ,
,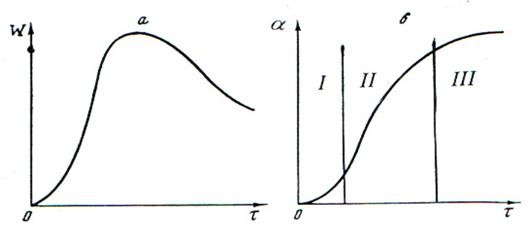 Рис.1. Типичные кинетические кривые топохимических реакций: а – дифференциальная; б - кинетическая
Рис.1. Типичные кинетические кривые топохимических реакций: а – дифференциальная; б - кинетическая


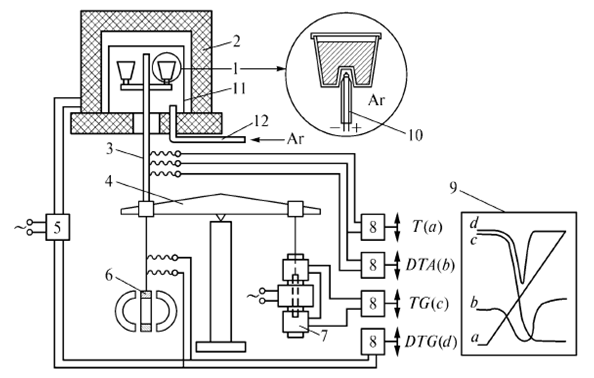
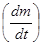 от времени нагрева t. Каждый пик на дифференциальной кривой ДТГ соответствует максимальной скорости изменения массы, т.е. истинной температуре химической реакции.
от времени нагрева t. Каждый пик на дифференциальной кривой ДТГ соответствует максимальной скорости изменения массы, т.е. истинной температуре химической реакции.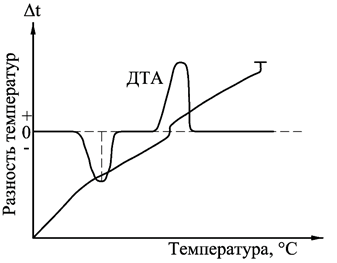
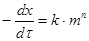 ,
, 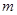 - масса образца, вступившая в реакцию; n - порядок реакции; k - удельная константа скорости реакции.
- масса образца, вступившая в реакцию; n - порядок реакции; k - удельная константа скорости реакции.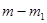 и
и 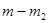 , при этом скорости реакции
, при этом скорости реакции 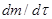 определяются как тангенсы углов наклона касательных к ТГ - кривой в точках 1 и 2. Для реакции первого порядка уравнение имеет следующий вид:
определяются как тангенсы углов наклона касательных к ТГ - кривой в точках 1 и 2. Для реакции первого порядка уравнение имеет следующий вид: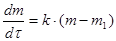 .
. 


