
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Исследование фазового равновесия в системеСодержание книги
Поиск на нашем сайте
«ЖИДКОСТЬ - ТВЕРДОЕ ТЕЛО» Процессы взаимодействия жидкости и твердого тела встречаются при переработке минерального сырья, получении различных солей, минеральных удобрений, ионном обмене. Процессы, протекающие в системе «Ж-ТВ», можно разделить на три группы: · разрушение структуры твердого тела (растворение, выщелачивание); · образование новой фазы (кристаллизация); · не происходит значительного изменения твердой фазы (ионный обмен). Одним из основных методов при изучении равновесия в водно-солевых системах является метод, основанный на определении зависимости растворимости компонентов от температуры, иными словами метод достижения термодинамического равновесия между жидкой и твердой фазой при различных заданных температурах. Изотермический метод изучения растворимости Растворение твердого тела сопровождается образованием устойчивых соединений растворенных частиц с молекулами растворителя. Это явление называется сольватацией (в случае если растворителем является вода гидратацией). Способность веществ к растворению зависит от величины изменения энергии Гиббса: ∆ G. Растворение продолжается до тех пор, пока не будет наблюдаться равенство химических потенциалов, т.е. будет достигнуто равновесие. При этом образуется раствор – однофазная система переменного состава, содержащая два и более компонентов. Предельно возможная концентрация растворенного вещества, отвечающая фазовому равновесию, называется растворимостью вещества, а такой раствор – насыщенным. Насыщенный раствор может существовать только в контакте с растворенным веществом. Растворение может быть физическим (в этом случае возможно выделить путем кристаллизации растворенное вещество) и химическим (растворитель и содержащийся в нем активный компонент так взаимодействуют друг с другом, что последующее выделение растворенного вещества невозможно). Характеристики растворимости подразделяются на качественныеи количественные. Качественные характеристики определяют субъективное мнение исследователя в отношении растворимости данного вещества - хорошо растворимо, плохо растворимо, мало растворимо, нерастворимо и т.п., и являются субъективными. Количественной характеристикой является растворимость. Растворимость измеряется концентрацией растворенного вещества в его насыщенном растворе. Количественно растворимость выражают, чаще всего, количеством вещества, которое можно растворить в 100 г растворителя при данной температуре. Растворимость зависит от природы растворяемого вещества, растворителя, чистоты растворителя и растворяемого вещества, температуры, давления. Для твердых и жидких веществ влияние давления на растворимость менее значимо, чем для газов. Температура имеет различное влияние на различные системы "растворяемое вещество - растворитель". Как правило, в большинстве случаев при увеличении температуры растет растворимость. Для хлорида натрия практически не меняется. Обратной зависимостью обладают, например, многие соли кальция. Качественная и количественная растворимость приводится в справочной литературе. Важным показателем является величина произведения растворимости ПР, которая относится к характеристике труднорастворимых электролитов Величина ПР зависит от природы электролита, растворителя и температуры. Знание величины ПР и факторов, влияющих на нее, позволяет контролировать содержание ионов в растворе. Классическим способом определения растворимости является растворение вещества до его выпадения в осадок, выдерживание такой смеси при определенной температуре, отделение осадка и определение количества растворившегося вещества. В современных условиях для измерения очень малых значений растворимости часто пользуются хроматографическими системами. При измерениях растворимости важно учесть все факторы, которые могут повлиять на растворимость. Условия образования осадков
Величину ПР вычисляют обычно по данным растворимости, которые определяют экспериментальным путем. Для исследования растворимости могут быть использованы установки, представленные на рис. 1. Перед началом эксперимента соли подвергаются сильному измельчению, это необходимо для ускорения достижения равновесия. При изучении растворимости используют следующие приборы: термометр, термостаты. Для измерения температуры используют жидкостные термометры, которые представляют собой стеклянные трубки с капилляром внутри и резервуаром, заполненным различными термометрическими жидкостями. Наблюдение температуры в узком интервале температур (2-5°С) проводят с помощью метастатических термометров Бекмана. Термометры устанавливают в приборах и сосудах по возможности в непосредственном контакте жидкостного резервуара с измеряемой средой. При работе со фтроводородной кислотой или растворами гидроксидов щелочных металлов необходимо устанавливать защитную гильзу из полиэтилена или фторопласта – 4, которые можно использовать до 110°С и 250°С соответственно. Допустимое колебание температуры не должно превышать ± 0,1 - 0,2⁰ С. Для создания необходимого температурного режима используют термостаты – установки, позволяющие поддерживать температуру выше температуры окружающей среды. Термостаты могут быть жидкостными, паровыми, твердотельными и воздушными. Наибольшее распространение в лаборатории получили жидкостные термостаты. В них можно поддерживать постоянную температуру от 25 до 350°С с точностью 0,02°С. Нагревательным элементом служит нихромовая проволока, помещенная в стеклянную или керамическую трубку. Постоянство температуры поддерживается с помощью терморегулятора, в качестве которого наиболее часто используется контактный термометр. Контроль за температурой жидкости в термостате проводится с помощью ртутного термометра. Жидкость в термостате перемешивается пропеллерной ешлкой. Жидкость для термостата выбирают в зависимости от интервала рабочих температур. К ней предъявляются следующие требования:
В качестве жидкостей для термостата могут быть использованы вода (20-80°С), 80%-ный раствор глицерина в воде (80-150°С), кремнийорганические жидкости (150-350°С), нафтеновые масла, жидкие смеси высококипящих углеводородов. Твердотельные термостаты – металлические блоки, обогреваемые электрическим током, например, колбонагреватель. Для создания пониженных температур применяют криостаты – приборы, предназначенные для создания температур ниже температуры окружающей среды. Для определения растворимости твердого вещества используют специальные реакторы с мешалками. Предварительно исследуемую твердую фазу измельчают как можно мельче и переносят в стеклянный сосуд 5 через горло 4 или при помощи воронки через отросток 2. Затем в сосуд помещают растворитель на 2/3 объема и устанавливают мешалку. Сосуд помещают в термостат, и поддерживают температуру с точностью 0,05°С. Контрольный термометр располагают в термостате рядом с сосудом, который опускают таким образом, чтобы уровень жидкости в сосуде находился над уровнем жидкости в термостате. Скорость вращения мешалки устанавливается такой, чтобы твердая фаза находилась во взвешенном состоянии. Отбор проб производится через отросток 2 с помощью пипетки. В момент установления равновесия суспензия переходит в раствор. Рассмотренный изотермический метод обладает высокой точностью и надежностью, но сопряжен с большими затратами времени и труда, также нельзя проводить исследования окрашенных жидкостей.
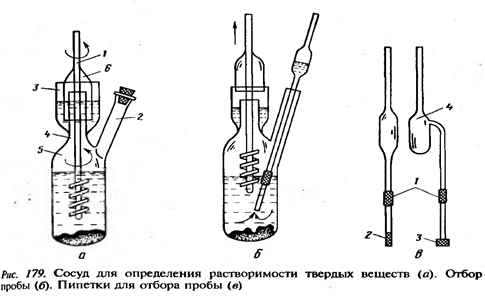
В большинстве случаев для исследования равновесия в системе «жидкость-твердое тело» наблюдения проводят путем периодического анализа проб жидкой фазы: содержание исследуемого компонента или значение какого-либо физического свойства раствора, однозначно определяемого составом жидкой фазы (например, электропроводность). Равновесие считается достигнутым, когда данные аналитических определений отличаются в пределах ошибки опыта. После достижения равновесия проводится полный анализ жидкой и твердой фаз на содержание всех компонентов. Предварительно фазы разделяют. Если температура опыта отлична от комнатной может произойти смещение равновесия. Для исключения таких ошибок применяют обогреваемые (охлаждаемые) фильтры и подбирают соответствующие промывные жидкости. Рассмотрим наиболее подробно способы фильтрования и применяемые материалы. В зависимости от размера, отделяемой от жидкой фазы твердых частиц, различают четыре вида фильтрования:
Для микрофильтрации, ультрафильтрации, диализа и обратного осмоса применяют мембраны. Обычное фильтрование Эффективность обычного фильтрования зависит от среды, температуры, давления и размеров пор фильтра. Плотность (пористость) фильтровальной бумаги каждая фирма-производитель маркирует своими значками. Розовая или красная лента на пачке круглых фильтров обозначает крупную пористость со средним размером пор 3,4 – 4 мкм, белой лентой – среднюю плотность – 3,0 -3,5 мкм, синей – мелкопористую (1,0-1,1 мкм), предназначенную для фильтрации мелкопористых осадков. Используются также стеклянные фильтры, которые представляют собой пластинки из спеченного, предварительно измельченного, сырья. Также как и бумажные, стеклянные фильтры различаются по пористости. Средний размер пор в зависимости от класса фильтра составляет от 3-6 до 250-500 мкм.
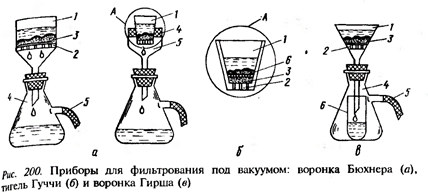
Фильтры из пористого фарфора применяют в тех случаях, когда отфильтрованные осадки нужно прокалить, не снимая с фильтра. Фильтры из пористого фарфора, как и стеклянные, непригодны для фильтрации нагретых концентрированных водных растворов щелочей. В частности, 60%-ный водный раствор КОН при 160°С разрушает пористый фарфор в течение 1 часа. Фильтры из волокнистопористого фторпласта пригодны для работ практически со всеми реагентами до 300°С. Максимальный размер пор не превышает 10-3 мм. Такие фильтры применяют для фильтрации гелей и высокотемпературных растворов щелочей и сильных кислот. Также применяют фильтры из пористого полиэтилена, пористого углерода, из губчатой платины и т.д. В лаборатории часто применяют вакуумное фильтрование. При этом остаток жидкости на фильтре составляет 2-5 %, а при обычном – 15 – 20%. Иногда для фильтрования используют центрифуги, в которых разделение происходит под действием центробежной силы. Механические центрифуги имеют частоту вращения – 2000 – 3000об/мин, а суперцентрифуги – 40 000 об/мин. В случае если остаток (твердая фаза с захваченным в ней маточным раствором) окисляется на воздухе, используют промывку спиртом, затем высушивают и после этого переносят в бюкс или склянку с пришлифованной пробкой. Состав жидкой фазы и остатка определяются аналитическим методом. Результаты экспериментальных исследований могут быть представлены в виде соответствующей диаграммы. Наиболее простой путь изучения системы заключается в прямом анализе составов равновесных жидкой и твердой фаз. Однако при этом возникают трудности полного отделения твердой фазы от маточного раствора. Для анализа составов твердых фаз используется правило соединительной прямой – составы исходной смеси и ее продуктов лежат на одной прямой. Прямая, соединяющая состав равновесной жидкой фазы, и твердой фазы, в которой полностью удален растворитель, называется лучом Скрейнемакерса. Состав равновесных твердых фаз определяется путем построения нескольких лучей и определения точки их пересечения. Этот метод получил названия метод остатков Скрейнемакерса.
ЛЕКЦИЯ № 4
|
||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 78; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.147.141 (0.007 с.) |




