
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Индикаторы комплексонометрии.
Металлохромные индикаторы - органические соединения, содержащие хромофорные группы. В химическом отношении они, как правило, являются органическими кислотами и обладают способностью изменять окраску при образовании комплексных соединений с катионами металлов. Образуют с ионами металлов менее прочные комплексы, чем титрант, цвет которых отличается от цвета самих индикаторов. Взаимодействие металлоиндикаторов с катионами определяемых металлов должно быть обратимым и константа устойчивости металлоиндикаторного комплекса должна быть на 10^4 меньше константы устойчивости комплекса катиона металла с титрантом. • кислотный хромовый черный T - эриохром черный Т • кислотный хромовый синий - кислотный хром синий К • аммонийная соль пурпуровой кислоты - мурексид • ксиленоловый оранжевый • пирокатехиновый фиолетовый • метилтимоловый синий
Выбор индикатора для комплексонометрии осуществляется с помощью кривых титрования. При этом кривую титрования строят по аналогии с кривыми для кислотно-основного титрования, откладывая на оси ординат значение рМ= − lg [Mn+], а на оси абсцисс – количество добавленного комплексона или процент титрования. При постепенном прибавлении раствора ЭДТА к раствору соли металла происходит уменьшение концентрации свободных ионов металла, вблизи точки эквивалентности наблюдается её резкое уменьшение − скачок титрования.
Основные условия титрования. 1) в точке эквивалентности определяемые катионы практически полностью связаны в комплекс (константа нестойкости комплексов должна быть очень малой величины) 2) определяемые катионы должны образовывать с металл-индикатором комплексы, обладающие меньшей прочностью, чем их комплексы с ЭДТА 3) рН раствора. В сильно кислых растворах (рН<3) образуются малоустойчивые кислые комплексы. При повышении рН устойчивость образовавшихся комплексов возрастает, однако в сильно щелочных средах рН>10 происходит образование малоустойчивых оксокомплексов или гидрооксиды Ме. (Из выше приведенных реакций следует, что образование комплексонатов происходит с выделение кислоты, что приводит к увеличению рН. Поэтому, как правило, титрование проводят в присутствии соответствующих буферных растворов поддерживающих рН на определенном уровне).
Применение комплексонометрического титрования. С помощью метода комплексонометрии определяют содержание в растворе различных ионов металлов: Mg2+, Ca2+, Zn2+, Cd2+, Al3+, Ni2+, Cu2+, Co2+, Fe3+ и др. Может использоваться для определения жесткости воды.
Комплексы не удовлетворяют требованиям предъявляемым первичным стандартным веществам, поэтому их точную концентрацию устанавливают путем стандартизации. В качестве первичных стандартных веществ используют соли Са2+ и Mg2+, приготовленные из фиксаналов или металлический Zn (цинк взвешивают на аналитических весах, помещают в мерную колбу и растворяют в небольшом количестве НСl или H2SO4, после растворения Zn, раствор нейтрализуют и доводят объем до метки. По массе цинка и объему полученного раствора рассчитывают точную концентрацию первичного стандартного раствора). (Механизм: 1) образование окрашенного комплекса индикатора с Ме 2) Титрование ЭДТА свободных ионов Ме. Тк индикатор добавляют в таком кол-ве, чтобы связывалось менее 1% ионов Ме. Т.е. 99% ионов Ме находятся в свободном виде и связываются с ЭДТА 3) разрушение комплекса Ме-инд и обр более устойчивого Ме-ЭДТА и свободного индикатора (КТТ). При титровании ЭДТА солей металлов-комплексообразователей протекают следующие реакции: 1) диссоциация комплексона: Na2H2Y 2) взаимодействие с металлами: Me2+ (Ca2+) + H2Y2− Me3+ (Al3+) + H2Y2− Me4+ (Th4+) + H2Y2-
|
|||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 55; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.134.90.44 (0.004 с.) |
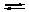 2Na+ + H2Y2−
2Na+ + H2Y2−


