Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Протеогликаны, ассоциированные с клетками
В процессе развития клеток появляются малые протеогликаны, получившие название протеогликанов, ассоциированных с клетками. Это семейство белков включает серглицины, синдеканы, бетаглицины, тромбомодулин, фосфатидилинозитол - заякоренные протеогликаны.
Синдеканы включают 4 типа различных белков. Они являются интегральными протеогликанами и содержат внутриклеточный, трансмембранный и внеклеточный домены. Внеклеточный домен этих белков имеет сходство с доменом протеиназ и способен открывать мембрану клетки, а также содержит и варьирующие цепи гликозаминогликанов, соединённых с синдеканом. Так, синдеканы 1 и 3 содержат гепарансульфат и хондроитинсульфат. Синдекан-1 появляется в эпителиальных клетках в процессе развития, синдекан-2 (фиброгликан) синтезируется фибробластными клетками и гепатоцитами; синдекан-3 (N-синдекан) присутствует в нервной ткани и развивающихся хрящах, а синдекан-4 (риудокан, амфигликан) - в эндотелии, эпителии, гладкомышечных клетках и фибробластах кожи. Синдеканы через внеклеточные домены связывают коллагены, фибронектин, тромбоспондин, тенасцин и фактор роста фибробластов. Внутриклеточные домены синдекана через актин связываются с цитоскелетом.
Серглицины выделены из секреторных везикул. Их состав зависит от типа клеток и клеточной дифференцировки. С коровым белком связаны цепи хондроитин- и гепарансульфата. Особенностью молекул серглицина является высокое содержание сульфатных остатков, что придаёт им устойчивость к протеолизу. Мол. масса серглицинов варьирует в больших пределах (60-750 кДа), а мол. масса корового белка практическ и постоянна (16-18 к Да). Считают, что серглицины вовлечены в регуляцию ферментативной активности секреторных гранул и дифференцировку гемопоэтических клеток. Некоторые серглицины синтезируются эндотелиальными клетками, и их синтез повышается под влиянием фактора некроза опухолей и интерлейкина 1α(ИЛ-1α). Серглицин может принимать участие в миграции лейкоцитов при воспалительных процессах. Недавно установлено, что с другими протеогликанами они участвуют в адгезии и активации лимфоидных клеток.
Протеогликаны базальных мембран
В составе базальных мембран выделена целая группа гетерогенных протеогликанов, содержащих гепарансульфат. В структуре корового белка имеются глобулярные домены, разделённые стержневыми фрагментами. Глобулярные домены обеспечивают связь этих протеогликанов с коллагеном IV типа, ламинином и другими гликопротеинами, а также с клетками, расположенными на базальной мембране.
Перлекан является основным гепарансульфатсодержащим протеогликаном базальных мембран. Полипептидная цепь, состоящая из 3500 аминокислотных остатков, связана с тремя гепарансульфатными цепями через гидроксильные группы серина в N-концевой области. Каждая полисахаридная цепь содержит до 200 мономеров. В молекуле перлекана определяется около трёх десятков глобулярных доменов, раз- делённых короткими стержневидными фрагментами, обеспечивающих связь между клетками и компонентами межклеточного матрикса.
Сохранение биомеханических и физиологических особенностей соединительной ткани во многом определяется поддержанием баланса между процессами биосинтеза и деградации коллагенов и протеогликанов. Распад и синтез протеогликанов регулируют: 1) гормоны - соматотропин, тироксин, инсулин; 2) цитокины - ИЛ-1, кахектины; 3) витамины группы А и С; 4) микроэлементы; 5) факторы роста.
Синтез протеогликанов
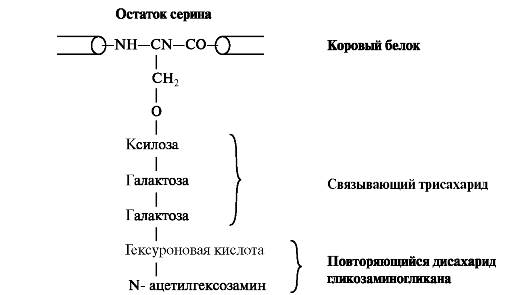
Синтез протеогликанов начинается с биосинтеза корового белка на полирибосомах. Уже в процессе трансляции белка в шероховатой эндоплазматической сети происходит связывание трисахаридов через амидные группы остатков аспарагина. В качестве донора олигосахаридов выступают долихол-связанные олигосахариды с высоким содержанием маннозы. После присоединения N-сцепленных олигосахаридов стержневой белок подвергается ксилозилированию и фосфорилированию. УДФ-ксилозатрансфераза, осуществляющая перенос остатков ксилозы на гидроксильную группу стержневого белка, является одним из ключевых ферментов биосинтеза протеогликанов. Дальнейшие процессы образования цепей гликозаминогликанов происходят в аппарате Гольджи. Полисахаридные цепи гликозаминогликанов синтезируются путём последовательного присоединения моносахаридов, донорами которых обычно являются соответствующие УДФ-сахара. На мембранах аппарата Гольджи локализованы гликозилтрансферазы, при участии которых белковая молекула и подвергается гликозилированию (рис. 1.18).
Рис. 1.18. Присоединение гликозаминогликана к коровому белку через связывающий трисахарид. К серину, треонину или аспарагину через О- или N-гликозидную связь присоединяется связующий олигосахарид, состоящий из двух остатков галактозы и одного остатка ксилозы.
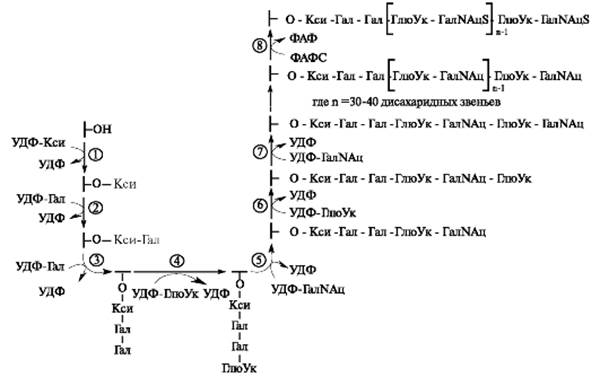
УДФ-галактозилтрансфераза I переносит на ксилозу первый остаток галактозы, УДФ-галактозилтрансфераза II - второй остаток галактозы, а завершается формирование связующего трипептида присоединением к нему остатка глюкуроновой кислоты. Эту реакцию катализирует УДФ-глюкуронилтрансфераза I. Дальнейший синтез полисахаридной цепи осуществляется последовательным присоединением N-ацетилгалактозамина (или N-ацетилглюкозамина, галактозы) и глюкуроновой (или идуроновой) кислоты (рис. 1.19).
Рис. 1.19. Синтез хондроитинсульфата в составе протеогликана. Ферменты:
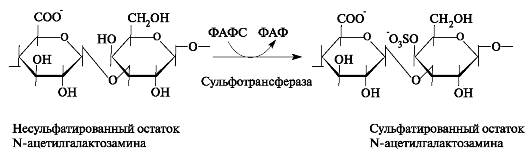
Модификацией цепей гликозаминогликанов является сульфатирование, то есть присоединение сульфата к С-4 и (или) к С-6 N-ацетилгалактозамина. Сульфат переносится на молекулу-акцептор с помощью специфических сульфотрансфераз (рис. 1.20). Донором сульфатной группы выступает 3'-фосфоаденозин-5'-фосфосульфат (ФАФС).
Рис. 1.20. Реакция сульфатирования остатка N-ацетилгалактозамина в процессе синтеза цепи хондроитинсульфата.
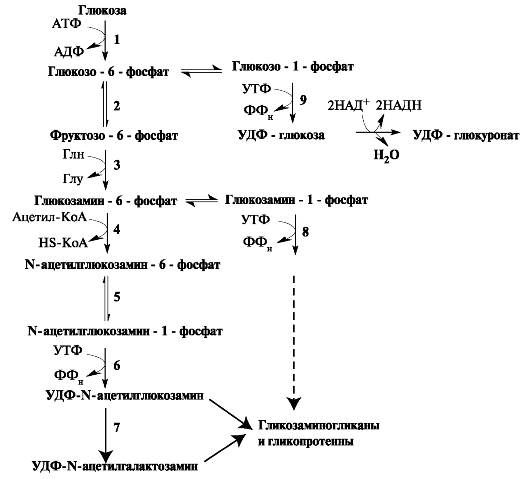
Аминосахара и гексуроновые кислоты синтезируются из глюкозы. Непосредственным же предшественником N-ацетилглюкозамина и N-ацетилгалактозамина является фруктозо-6-фосфат. Источником NН2-группы для сахаров выступает глутамин. Образовавшийся аминосахар далее ацетилируется с помощью ацетил-КоА (рис. 1.21).
Рис. 1.21. Синтез гликозаминогликанов. Ферменты: 1 - гексокиназа;
В реакциях эпимеризации после включения глюкуроната в углеводную цепь из D-глюкуроновой кислоты образуется L-идуроновая кислота.
На синтез гликозаминогликанов влияют соматотропин и ретиноевая кислота, которые активируют включение сульфата в молекулы. Напротив, синтез гиалуроновой кислоты и сульфатированных гликозаминогликанов тормозят глюкокортикоиды и половые гормоны.
Распад протеогликанов
Распад протеогликанов - физиологический процесс, заключающийся в регулярном обновлении внеклеточных и внутриклеточных макромолекул. В деградации протеогликанов участвуют протеиназы и гликозидазы. Вначале коровый и связующие белки подвергаются воздействию свободных радикалов и в межклеточном матриксе гидролизуются матриксными металлопротеиназами - коллагеназой, желатиназой, стромелизином. Протеиназы расщепляют коровый белок, а гликозидазы гидролизуют цепи гликозаминогликанов и олигосахаридов. Все протеогликаны, содержащие цепи хондроитинсульфата, дерматансульфата, гепарансульфата и кератансульфата, первоначально расщепляются на фрагменты. Затем фрагменты протеогликанов захватываются бластными клетками и подвергаются внутриклеточной деградации. Эти фрагменты могут также с лимфой и кровью переноситься в печень. В гепатоцитах происходит их дальнейший гидролиз, в котором участвуют аспартильные, сериновые и другие протеиназы.
Распад гликозаминогликанов
Гликозаминогликаны отличаются высокой скоростью обмена: период полужизни (Т1/2) многих из них составляет от 3 до 10 сут и только для кератансульфата Т1/2 120 сут. В разрушении полисахаридных цепей участвуют экзо- и эндогликозидазы (гиалуронидаза, β-глюкуронидаза, β-галактозидаза, β-идуронидаза) и сульфатазы.
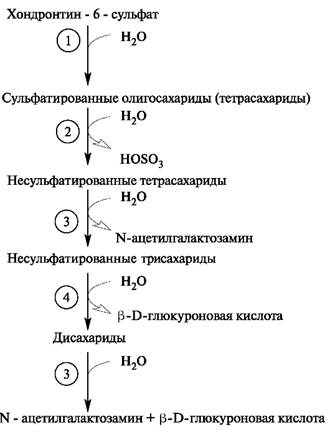
Из внеклеточного пространства по механизму эндоцитоза гликозаминогликаны поступают в клетку, где эндоцитозные пузырьки сливаются с лизосомами. Активные лизосомальные ферменты обеспечивают полный постепенный гидролиз гликозаминогликанов до мономеров. Расщепление интактных гликозаминогликанов в клетках начинается с их распада на фрагменты под действием эндогексозаминидаз и эндоглюкуронидазы. Образовавшиеся в реакциях гидролиза олигосахариды подвергаются последовательным действиям экзогликозидаз и сульфатаз, которые отщепляют мономеры с невосстанавливающегося конца. Так, гидролиз фрагментов хондроитинсульфата, содержащих на невосстанавливающем конце остаток N-ацетилгалактозамина, инициируется сульфатазой, за ней в процесс включается β-N-ацетилгалактозаминидаза, а затем β-глюкуронидаза. В итоге образуется неорганический сульфат и моносахариды (рис. 1.22).
Рис. 1.22. Распад хондроитинсульфата. Ферменты: 1 - эндогликозидаза;
В распаде гиалуроновой кислоты до олигосахаридов участвует гиалуронидаза. Гидролиз образовавшихся олигосахаридов осуществляют β-N-ацетилглюкозаминидаза и β-D-глюкуронидаза.
Внеклеточный распад гликозаминогликанов характерен только для гепарансульфата, который расщепляется гепараназой, синтезируемой тромбоцитами или Т-лимфоцитами.
Мукополисахаридозы
Мукополисахаридозы - тяжёлые наследственные заболевания, обусловленые дефектами гидролаз, участвующих в катаболизме гликозаминогликанов. В лизосомах тканей, для которых характерен синтез наибольшего количества гликозаминогликанов, накапливаются не полностью разрушенные гликозаминогликаны и с мочой выделяются их олигосахаридные фрагменты. Существует несколько типов мукополисахаридозов, вызванных дефектами разных ферментов, участвующих в расщеплении гликозаминогликанов.
Мукополисахаридозы проявляются нарушениями умственного развития у детей, поражениями сердечно-сосудистой системы, деформациями костного скелета, значительно выраженными в челюстнолицевой области, гипоплазией твёрдых тканей зубов, помутнением роговицы глаз, снижением продолжительности жизни (табл. 1.3).
Таблица 1.3 Болезни, связанные с нарушением метаболизма гликозаминогликанов
В настоящее время эти болезни не поддаются лечению, поэтому при подозрении на носительство дефектных генов необходимо проводить пренатальную диагностику. В этих случаях определяют активность лизосомальных гидролаз.
1.4. НЕКОЛЛАГЕНОВЫЕ БЕЛКИ СО СПЕЦИАЛЬНЫМИ СВОЙСТВАМИ
|
||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 238; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.36.141 (0.019 с.) |