Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Неколлагеновые белки хрящевой ткани
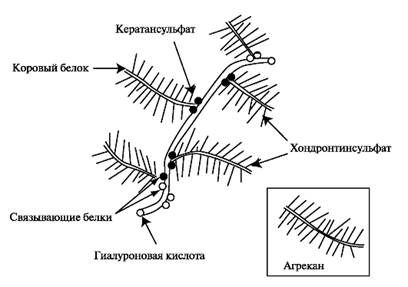
Протеогликаны. В целом содержание протеогликанов в хрящевом матриксе достигает 3%-10%. Основным протеогликаном хрящевой ткани является агрекан, который собирается в агрегаты с гиалуроновой кислотой. По форме молекула агрекана напоминает бутылочный ёршик и представлена одной полипептидной цепью (коровый белок) с присоединёнными к ней до 100 цепей хондроитинсульфата и около 30 цепей кератансульфата (рис. 2.2).
Рис. 2.2. Протеогликановый агрегат хрящевого матрикса. Протеогликановый агрегат состоит из одной молекулы гиалуроновой кислоты и около 100 молекул агрекана.
В структуре корового белка агрекана выделяют N-концевой домен, который обеспечивает связывание агрекана с гиалуроновой кислотой и низкомолекулярными связывающими белками, и С-концевой домен, связывающий агрекан с другими молекулами межклеточного матрикса. Синтез компонентов протеогликановых агрегатов осуществляется хондроцитами, и окончательный процесс их формирования завершается в межклеточном матриксе.
Наряду с большими протеогликанами в хрящевом матриксе приутствуют малые протеогликаны: декорин, бигликан и фибромодулин. Они составляют всего 1-2% от общей массы сухого вещества хряща, однако их роль очень велика. Декорин, связываясь в определённых участках с волокнами коллагена II типа, участвует в процессах фибриллогенеза, а бигликан участвует в формировании белковой матрицы хряща в процессе эмбриогенеза. С ростом эмбриона количество бигликана в хрящевой ткани уменьшается и после рождения этот протеогликан исчезает совсем. Регулирует диаметр коллагена II типа фибромодулин.
Таблица 2.1 Неколлагеновые белки хрящевой ткани
Помимо коллагенов и протеогликанов, во внеклеточном матриксе хряща содержатся неорганические соединения и небольшое количество неколлагеновых белков, характерных не только для хряща, но и для других тканей. Они необходимы для связывания протеогликанов с коллагеновыми волокнами, клеток, а также отдельных компонентов хрящевого матрикса в единую сеть. Это адгезивные белки - фибронектин, ламинин и интегрины. Большинство специфических неколлагеновых белков в хрящевом матриксе присутствует только в период морфогенеза, обызвествления хрящевого матрикса или появляются при патологических состояниях (табл. 2.1). Чаще всего это Са-связывающие белки, содержащие остатки 7-карбоксиглутаминовой кислоты, а также гликопротеины, богатые лейцином.
2.2. ФОРМИРОВАНИЕ ХРЯЩЕВОЙ ТКАНИ
На ранней стадии эмбрионального развития хрящевая ткань состоит из недифференцированных клеток, содержащихся в виде аморфной массы. В процессе морфогенеза клетки начинают дифференцироваться, аморфная масса увеличивается и приобретает форму будущего хряща (рис. 2.3).
Рис. 2.3. Этапы формирования хрящевой ткани.
Во внеклеточном матриксе развивающейся хрящевой ткани количественно и качественно меняется состав протеогликанов, гиалуроновой кислоты, фибронектина и коллагеновых белков. Переход от прехондрогенных мезенхимальных клеток к хондробластам характеризуется сульфатированием гликозаминогликанов, увеличением количества гиалуроновой кислоты и предшествует началу синтеза специфического для хряща большого протеогликана (агрекан). На начальных этапах морфогенеза синтезируются высокомолекулярные связующие белки, которые позднее подвергаются ограниченному протеолизу с образованием низкомолекулярных белков. Молекулы агрекана при помощи низкомолекулярных связующих белков связываются с гиалуроновой кислотой и формируются протеогликановые агрегаты. В последующем количество гиалуроновой кислоты снижается, что связано как со снижением синтеза гиалуроновой кислоты, так и с повышением активности гиалуронидазы. Несмотря на снижение количества гиалуроновой кислоты, длина отдельных её молекул, необходимых для формирования протеогликановых агрегатов при хондрогенезе, возрастает. Синтез коллагена II типа хондробластами происходит позднее синтеза протеогликанов. Вначале прехондрогенные клетки синтезируют коллагены I и III типа, поэтому в цитоплазме зрелых хондроцитов обнаруживают коллаген I типа. Далее в процессе хондрогенеза происходит смена компонентов внеклеточного матрикса, контролирующих морфогенез и дифференцировку хондрогенных клеток.
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 241; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.158.47 (0.005 с.) |