Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Регуляция активности матриксных металлопротеиназ
Активность матриксных металлопротеиназ находится под постоянным контролем.
Во-первых, они синтезируются в виде препроферментов. Сигнальный пептид обеспечивает направленную секрецию молекулы и после его отщепления образуется профермент. Профермент содержит последовательность аминокислот, в которой остаток цистеина связывает молекулу Zn2+, находящуюся в активном центре. В последующем после отщепления полипептида сформировавшаяся активная форма ММП содержит два основных домена. N-концевой домен содержит цинк-связывающий участок, в котором Zn2+ связывается тремя остатками гистидина и обладает каталитической активностью. В катализе, помимо цинка, принимает участие остаток глутаминовой кислоты. С-концевой домен отвечает за связывание с субстратами и ингибиторами ММП. Между N- и С-концевыми доменами располагается небольшой связывающий домен, который обеспечивает субстратную специфичность (рис. 1.26, А).
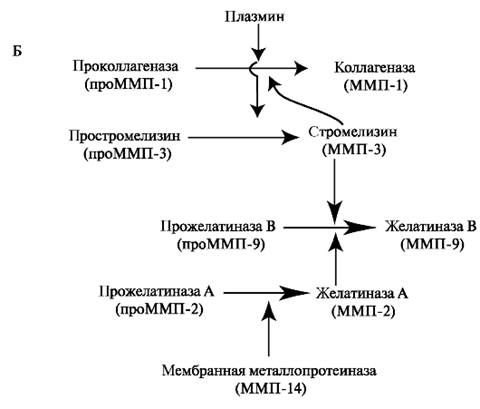
В отщеплении сигнального пептида участвуют различные протеиназы. Так, в реакции активации проММП-1 и проММП-3 участвует трипсиноподобная протеиназа плазмин, проММП-2 мембранная металлопротеиназа, проММП-9 желатиназа А. Таким образом, активация ферментов происходит в виде каскада и в этот процесс вовлечено одновременно множество проферментов и вновь образующихся активных энзимов (рис. 1.26, Б).
Рис. 1.26. Строение проММП-1: А - активация фермента происходит при отщеплении сигнального пропептида; Б - в ограниченном протеолизе проММП участвуют различные протеиназы.
Во-вторых, активность ферментов зависит от уровня экспрессии их генов. Большинство ММП относится к «индуцируемым» ферментам, синтез которых на уровне транскрипции контролируется рядом факторов: цитокинами и другими факторами, действующими на поверхность клетки (эстроген, прогестерон и др.). Промоторы ММП содержат общие элементы, отвечающие за механихм регуляции экспрессии генов.
В-третьих, в физиологических условиях в тканях содержится незначительное количество ММП и их активность зависит от присутствия активаторов и ингибиторов в окружающей среде. Активность ММП находится под контролем специфических белков - тканевых ингибиторов металлопротеиназ (ТИМП). В настоящее время хорошо изучены четыре вида ТИМП, выделенных из различных тканей человека: ТИМП-1, ТИМП-2, ТИМП-3, ТИМП-4. ТИМП способны связываться как с активными, так и неактивными формами ММП. Эти белки различаются по их специфическому действию на металлопротеиназы. Так, ТИМП-1 значительно лучше ингибирует ММП-9, в то время как ТИМП-2 подавляет активность ММП-2. ТИМП инактивируются путём гидролиза с участием различных протеиназ - трипсина, химотрипсина, стромелизина-3 и эластазы нейтрофилов.
ГЛАВА 2 ХРЯЩЕВАЯ ТКАНЬ
Хрящевая ткань является особым видом соединительной ткани и в сформированном организме выполняет опорную функцию. В челюстно-лицевой области хрящ входит в состав ушной раковины, слуховой трубы, носа, суставного диска височно-нижнечелюстного сустава, а также обеспечивает связь между мелкими костями черепа.
В зависимости от состава, метаболической активности и способности к регенерации различают три типа хрящевой ткани - гиалиновый, эластический и волокнистый.
Гиалиновый хрящ формируется первым на эмбриональной стадии развития, и в определённых условиях из него образуются остальные два вида хряща. Эта хрящевая ткань определяется в составе реберных хрящей, хрящевого остова носа и образует хрящи, покрывающие поверхности суставов. Он обладает более высокой метаболической активностью по сравнению с эластическим и волокнистым типами и содержит большое количество углеводов и липидов. Это позволяет осуществлять активный синтез белков и дифференцировку хондрогенных клеток для обновления и регенерации гиалинового хряща. С возрастом в гиалиновом хряще происходит гипертрофия и апоптоз клеток с последующим обызвествлением внеклеточного матрикса.
Эластический хрящ имеет сходное строение с гиалиновым хрящом. Из такой хрящевой ткани сформированы, например, ушные раковины, слуховая труба и некоторые хрящи гортани. Для этого типа хряща характерно присутствие в хрящевом матриксе сети эластических волокон, содержится малое количество липидов, углеводов и хондроитинсульфатов. Ввиду низкой метаболической активности эластический хрящ не обызвествляется и практически не регенерируется.
Волокнистый хрящ по своей структуре занимает промежуточное положение между сухожилием и гиалиновым хрящом. Характерной особенностью волокнистого хряща является наличие в межклеточном матриксе большого количества коллагеновых волокон, преимущественно I типа, которые располагаются параллельно друг другу, а клетки в виде цепочки между ними. Волокнистый хрящ благодаря своему особому строению может испытывать значительные механические нагрузки как при сжатии, так и растяжении.
Хрящевой компонент височно-нижнечелюстного сустава представлен в виде диска волокнистого хряща, который располагается на поверхности суставного отростка нижней челюсти и отделяет его от суставной ямки височной кости. Так как волокнистый хрящ не имеет надхрящницы, то питание клеток хряща осуществляется через синовиальную жидкость. Состав синовиальной жидкости зависит от транссудации метаболитов из кровеносных сосудов синовиальной оболочки в суставную полость. Синовиальная жидкость содержит низкомолекулярные компоненты - ионы Na+, K+, мочевую кислоту, мочевину, глюкозу, которые близки в количественном соотношении к плазме крови. Однако содержание белков в синовиальной жидкости в 4 раза выше, чем в плазме крови. Помимо гликопротеинов, иммуноглобулинов синовиальная жидкость богата гликозаминогликанами, среди которых первое место занимает гиалуроновая кислота, присутствующая в виде натриевой соли.
2.1. СТРУКТУРА И СВОЙСТВА ХРЯЩЕВОЙ ТКАНИ
Хрящевая ткань, подобно любой другой ткани, содержит клетки (хондробласты, хондроциты), которые погружены в большой межклеточный матрикс. В процессе морфогенеза хондрогенные клетки дифференцируются в хондробласты. Хондробласты начинают синтезировать и секретировать в хрящевой матрикс протеогликаны, которые стимулируют дифференцировку хондроцитов.
Межклеточный матрикс хрящевой ткани обеспечивает её сложную микроархитектонику и состоит из коллагенов, протеогликанов, а также неколлагеновых белков - в основном гликопротеинов. Коллагеновые волокна переплетены в трёхмерную сеть, которая связывает остальные компоненты матрикса.
В цитоплазме хондробластов содержится большое количество гликогена и липидов. Распад этих макромолекул в реакциях окислительного фосфорилирования сопровождается образованием молекул АТФ, необходимых для синтеза белков. Синтезируемые в гранулярной эндоплазматической сети и комплексе Гольджи протеогликаны и гликопротеины упаковываются в везикулы и выделяются в межклеточный матрикс.
Упругость хрящевого матрикса определяется количеством воды. Для протеогликанов характерна высокая степень связывания воды, чем и обусловлены их размеры. Хрящевой матрикс содержит до 75% воды, которая связана с протеогликанами. Высокая степень гидратации обусловливает большие размеры межклеточного матрикса и позволяет осуществлять питание клеток. Высушенный агрекан после связывания воды может увеличиться в объёме в 50 раз, однако ввиду обусловленных коллагеновой сетью ограничений набухание хряща не превышает 20 % от максимально возможного значения.
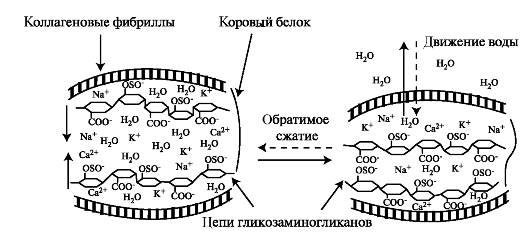
При сжатии хряща вода вместе с ионами вытесняется из областей вокруг сульфатированных и карбоксильных групп протеогликана, группы сближаются, и силы отталкивания между их отрицательными зарядами препятствуют дальнейшему сжатию ткани. После снятия нагрузки происходит электростатическое притяжение катионов (Na+, К+, Са2+) с последующим притоком воды в межклеточный матрикс (рис. 2.1).
Рис. 2.1. Связывание воды протеогликанами в матриксе хряща. Вытеснение воды при его сжатии и восстановление структуры после снятия нагрузки.
|
||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 276; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.4.181 (0.009 с.) |