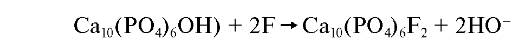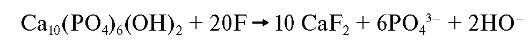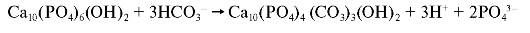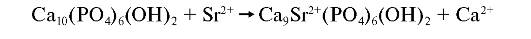Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Заболевания, связанные с пороками развития хрящевой ткани
В стоматологической практике наиболее часто манипуляции проводят на верхней и нижней челюстях. Существует ряд особенностей их эмбрионального развития, которые связаны с различными путями эволюции этих структур. У зародыша человека на ранних этапах эмбриогенеза в составе верхней и нижней челюстей обнаруживается хрящ.
На 6-7-й неделе внутриутробного развития в мезенхиме нижнечелюстных отростков начинается образование костной ткани. Верхняя челюсть развивается вместе с костями лицевого скелета и подвергается окостенению намного раньше, чем нижнечелюстная кость. К 3-месячному возрасту эмбриона на передней поверхности кости уже отсутствуют места слияния верхней челюсти с костями черепа.
На 10-й неделе эмбриогенеза в составе будущих ветвей нижней челюсти образуются вторичные хрящи. Один из них соответствует мыщелковому отростку, который в середине плодного развития замещается костной тканью по принципу эндохондрального окостенения. Также вторичный хрящ образуется вдоль переднего края венечного отростка, который исчезает перед самым рождением. В месте сращения двух половинок нижней челюсти имеются один или два островка хрящевой ткани, которые окостеневают на последних месяцах внутриутробного развития. На 12-й неделе эмбриогенеза появляется мыщелковый хрящ. На 16-й неделе мыщелок ветви нижней челюсти вступает в контакт с закладкой височной кости. Необходимо отметить, что гипоксия плода, отсутствие или слабое движение зародыша способствует нарушению образования суставных щелей или полному слиянию эпифизов противолежащих закладок костей. Это приводит к деформации отростков нижней челюсти и их сращению с височной костью (анкилоз).
ГЛАВА 3 МИНЕРАЛИЗОВАННЫЕ ТКАНИ
Минерализованные ткани, к которым относятся костная ткань, дентин, клеточный и бесклеточный цемент и эмаль зуба, характеризуются высоким содержанием минерального компонента, главной составной частью которого являются фосфорнокислые соли кальция.
3.1. ХИМИЧЕСКИЙ СОСТАВ МИНЕРАЛИЗОВАННЫХ ТКАНЕЙ
Образование и распад минерального компонента в этих тканях тесно связан с обменом кальция и фосфора в организме. В межклеточном матриксе минерализованных тканей происходит депонирование кальция, который выполняет также структурную функцию. В клетках кальций исполняет роль вторичного посредника в механизмах внутриклеточного переноса сигналов.
Особенностью всех минерализованных тканей, за исключением эмали и бесклеточного цемента, является малое количество клеток с длинными отростками, а большой межклеточный матрикс заполнен минералами. В белках матрикса формируются центры кристаллизации для формирования кристаллов минерального компонента - апатитов. Эмаль и бесклеточный цемент зубов образуются из эктодермы, а остальные минерализованные ткани из стволовых клеток мезодермы. Насыщенность минеральными соединениями зависит от вида твёрдой ткани, топографической локализацией внутри ткани, возраста и экологических условий.
Все минерализованные ткани различаются по содержанию воды, минеральных и органических соединений (табл. 3.1).
Таблица 3.1 Процентное распределение воды, неорганических и органических веществ в минерализованных тканях
В эмали по сравнению с другими твёрдыми тканями определяется наиболее высокая концентрация кальция и фосфатов, и количество этих минералов снижается в направлении от поверхности к эмалеводентинной границе. В дентине, наряду с ионами кальция и фосфатов, определяется достаточно высокая концентрация магния и натрия. Наименьшее количество кальция и фосфатов присутствует в костной ткани и цементе (табл. 3.2).
Таблица 3.2. Химический состав минерализованных тканей
В состав твёрдых тканей зубов и костей входят соли HPO42-, или PO43-. Ортофосфаты кальция могут быть в форме однозамещенных (H2PO4-), двузамещенных (HPO42-) или фосфат ионов (PO43-). Пирофосфаты встречаются только в зубных камнях и костной ткани. В растворах ион пирофосфата оказывает существенный эффект на кристаллизацию некоторых ортофосфатов кальция, что выражается в регуляции величины кристаллов.
Характеристика кристаллов
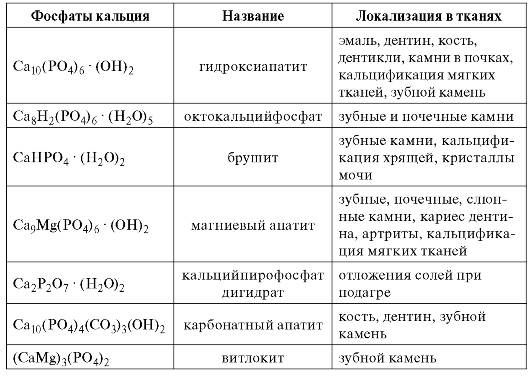
Большинство фосфорно-кальциевых солей кристаллизуются с образованием кристаллов разной величины и формы в зависимости от входящих элементов (табл. 3.3). Кристаллы присутствуют не только в минерализованных тканях, но и способны образовываться в других тканях в виде патологических образований.
Таблица 3.3. Кристаллические образования, присутствующие в различных тканях
Расположение атомов и молекул в кристалле можно исследовать при помощи рентгеноструктурного анализа кристаллических решеток. Как правило, частички располагаются в кристалле симметрично; их называют элементарными ячейками кристалла. Сеточка, образуемая ячейками, называется матрицей кристалла. Имеется 7 разных категорий ячеек кристаллов и соответственно 7 типов кристаллов: триклинные, моноклинные, орторомбические, тригональные, тетрагональные, гексагональные и кубические.
В минерализованных тканях животного мира преобладают апатиты. Они имеют общую формулу Ca10(PO4)6X2, где X – это гидроксильная группа (OH-) или анионы фтора.
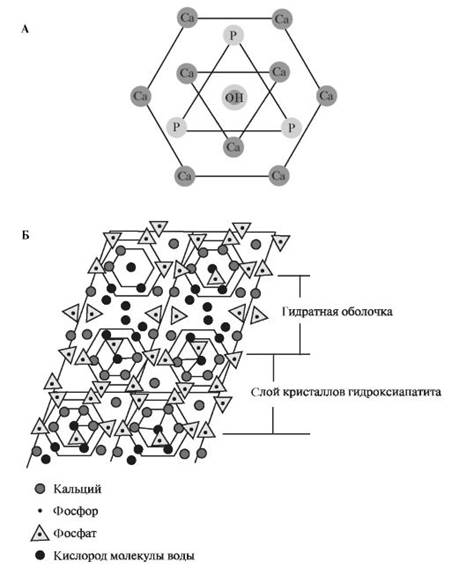
Гидроксиапатит (гидроксилапатит) - основной кристалл минерализованных тканей; составляет 95-97% в эмали зуба, 70-75% в дентине и 60-70% в костной ткани. Формула гидроксиапатита - Ca10(PO4)6(ОН)2. В этом случае молярное соотношение Са/Р (кальциево-фосфатный коэффициент) равно 1,67. Решётка гидроксиапатита имеет гексагональную структуру (рис. 3.1, А). Гидроксильные группы расположены вдоль гексагональной оси, тогда как фосфатные группы, имеющие наибольшие размеры по сравнению с ионами кальция и гидроксилами, распределяются как равнобедренные треугольники вокруг гексагональной оси. Между кристаллами имеются микропространства, заполненные водой (рис. 3.1, Б).
Рис. 3.1. Гидроксиапатит: А - гексагональная форма молекулы гидроксиапатита;
Гидроксиапатиты являются довольно устойчивыми соединениями и имеют очень стабильную ионную решётку, в которой ионы плотно упакованы и удерживаются за счёт электростатических сил. Сила связи прямо пропорциональна величине заряда ионов и обратно пропорциональна квадрату расстояния между ними. Гидроксиапатит электронейтрален. Если в структуре гидроксиапатита содержится 8 ионов кальция, то кристалл приобретает отрицательный заряд. Он может заряжаться и положительно, если количество ионов кальция достигает 12. Такие кристаллы обладают реакционной способностью, возникает поверхностная электрохимическая неуравновешенность и они становятся неустойчивыми.
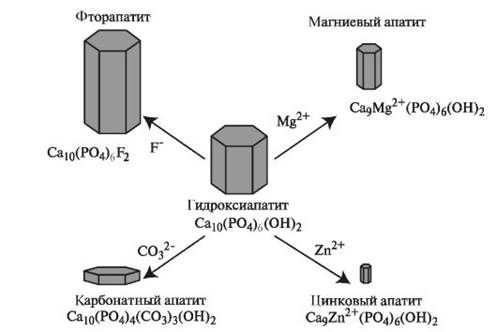
Гидроксиапатиты легко обмениваются с окружающей средой, в результате чего в их составе могут появляться другие ионы (табл. 3.4). Наиболее часто встречаются следующие варианты обмена ионов: • Са2+ замещается катионами Sr2+, Ba2+, Mo2+, реже Mg2+, Pb2+. Катионы Ca2+ поверхностного слоя кристаллов, могут на короткое время замещаться катионами К+, Na+. • PO43- обменивается с НРО42-, СО32-. • ОН- замещается анионами галогенов Cl-, F-, I-, Br-.
Таблица 3.4 Замещаемые и замещающие ионы и молекулы в составе апатитов
Элементы кристаллической решётки апатитов могут обмениваться с ионами раствора, окружающего кристалл и изменяться за счёт ионов, находящихся в этом растворе. В живых системах это свойство апатитов делает их высокочувствительными к ионному составу крови и межклеточной жидкости. В свою очередь, ионный состав крови и межклеточной жидкости зависит от характера пищи и потребляемой воды. Сам процесс обмена элементов кристаллической решётки протекает в несколько этапов с разной скоростью.
Обмен ионов в кристаллической решётке гидроксиапатита изменяет его свойства, в том числе прочность, и существенно влияет на размеры кристаллов (рис. 3.2).
Рис. 3.2. Размеры кристаллов различных апатитов [Edwards P. A., 2005].
Некоторые ионы (К+, Cl-) в течение несколькольких минут путём диффузии из окружающей биологической жидкости заходят в гидратный слой гидроксиапатита, а затем также легко его покидают. Другие ионы (Na+, F-) легко проникают в гидратную оболочку и, не задерживаясь, встраиваются в поверхностные слои кристалла. Проникновение ионов Са2+, PO43-, СО32-, Sr2+, F- в поверхность кристаллов гидроксиапатита из гидратного слоя происходит очень медленно, в течение нескольких часов. Только немногие ионы: Са2+, PO43-, СО32-, Sr2+, F- встраиваются вглубь ионной решётки. Это может продолжаться от нескольких дней до нескольких месяцев. Преимущественным фактором, определяющим возможность замены, является размер атома. Схожесть в зарядах имеет второстепенное значение. Такой принцип замены носит название изоморфного замещения. Тем не менее, в ходе такого замещения поддерживается общее распределение зарядов по принципу: Сa10х(HPO4)х(PO4)6х(OH)2х, где 0<х<1. Потеря Ca2+ частично компенсируется потерей OH- и частично H+, присоединённых к фосфату.
В кислой среде ионы кальция способнызамещаться протонами по схеме:
Это замещение несовершенно, поскольку протоны во много раз меньше катиона кальция.
Такое замещение приводит к разрушению кристалла гидроксиапатита в кислой среде.
Фторапатиты Ca10(PO4)6F2 наиболее стабильные из всех апатитов. Они широко распространены в природе и, прежде всего, как почвенные минералы. Кристаллы фторапатита имеют гексагональную форму. В водной среде реакция взаимодействия фтора с фосфатами кальция зависит от концентрации фтора. Если она сравнительно невысока (до 500 мг/л), то образуются кристаллы фторапатита:
Фтор резко уменьшает растворимость гидроксиапатитов в кислой среде. При высоких концентрациях фтора (>2 г/л) кристаллы не образуются:
Заболевание, развивающееся при избыточной концентрации фтора в воде и почве, зубах и костях в период формирования костного скелета и зубных зачатков назывется флюорозом.
Карбонатный апатит содержит в своем составе несколько процентов карбоната или гидрокарбоната. Процесс минерализации биологических апатитов в значительной степени определяется присутствием и локализацией карбонатных ионов в кристаллической решётке. Карбонатные радикалы СО32- могут замещать как ОН- (А-узел), так и РО43- (В-узел) в решётке гидроксиапатита. Например, около 4% апатита эмали зуба составляют карбонатные группы, которые замещают как фосфатные, так и гидроксильные ионы в пропорции 9:1 соответственно. Подобная ситуация характерна и для других гидроксиапатитов естественного происхождения. Условно химическая формула карбонированного гидроксиапатита может быть записана в виде Ca10[(PO4)6-x(CO3)x][(OH)2-2y(CO3)y], где х характеризует В-замещение, а у характеризует А-замещение. Для гидроксиапатита эмали зуба x =0,039, y =0,001. Карбонат уменьшает кристалличность апатита и делает его более аморфным и хрупким. Чаще всего фосфат-анионы апатитов замещаются ионами НСО3- по схеме:
Интенсивность замены зависит от числа образующихся гидрокарбонатов. В организме постоянно происходят реакции декарбоксилирования, и образующиеся молекулы СО2 взаимодействуют с молекулами Н2O. Анионы НСО3- образуются в реакции, катализируемой карбоангидразой, и замещают фосфат-анионы.
Карбонатные апатиты более характерны для костной ткани. В тканях зуба они образуются в непосредственной близости от эмалево-дентинной границы за счёт продукции анионов НСО3- одонтобластами. Возможно образование молекул НСО3- за счёт активного метаболизма аэробной микрофлоры зубного налёта. Образующееся количество НСО3- в этих участках может превышать PO43-, что способствует образованию карбонатного апатита в поверхностных слоях эмали. Накопление карбонатапатита свыше 3-4% от общей массы гидроксиапатита повышает кариесвосприимчивость эмали. С возрастом количество карбонатных апатитов увеличивается.
Стронциевый апатит. В кристаллической решётке апатитов Sr2+ может вытеснять или заменять вакантные места для Ca2+.
Это приводит к нарушению структуры кристаллов. В Забайкалье, вдоль берегов небольшой реки Уров, описано заболевание, получившее название «уровская» болезнь. Оно сопровождается поражением костного скелета, уменьшением конечностей у людей и у животных. В местности, загрязненной радионуклидами, неблагоприятное значение стронциевого апатита для организма человека связано с возможностью депонирования радиоактивного стронция.
Магниевый апатит образуется при замещении Ca2+ на ионы Mg2+.
Органические вещества минерализованных тканей в основном представлены белками, а также углеводами и липидами.
3.2. БЕЛКИ МЕЖКЛЕТОЧНОГО МАТРИКСА МИНЕРАЛИЗОВАННЫХ ТКАНЕЙ МЕЗЕНХИМНОГО ПРОИСХОЖДЕНИЯ
Белки минерализованных тканей составляют основу для прикрепления минералов и определяют процессы минерализации. Особенностью всех белков минерализованных тканей является наличие остатков фосфосерина, глутамата и аспартата, которые способны связывать Ca2+ и таким образом участвовать в образовании кристаллов апатита на начальном этапе. Второй особенностью является присутствие углеводов и последовательности аминокислотных остатков арг-гли-асп в первичной структуре белков, что обеспечивает их связывание с клетками или с белками, формирующими межклеточный матрикс.
Часть белков встречается в межклеточном матриксе большинства минерализованных тканей. Это белки адгезии, кальций-связывающие белки, протеолитические ферменты, факторы роста. Другие белки со специальными свойствами присущи только данной ткани и связаны с определёнными процессами, характерными для этого типа ткани.
Остеонектин - гликопротеин, присутствующий в большом количестве в минерализованной ткани. Белок синтезируется остеобластами, фибробластами, одонтобластами и в небольшом количестве хондроцитами и эндотелиальными клетками. В N-концевой области остеонектина располагается большое количество отрицательно заряженных аминокислот. В сформированной α-спирали на N-концевой области имеется до 12 участков связывания Ca2+, входящего в состав гидроксиапатита. Через углеводный компонент остеонектин связывается с коллагеном I типа. Таким образом, остеонектин обеспечивает взаимодействие компонентов матрикса. Он также регулирует пролиферацию клеток и принимает участие во многих процессах на этапе развития и созревания минерализованных тканей.
Остеопонтин - белок с мол. массой ~32 000 кДа, содержит несколько повторов, богатых аспарагиновой кислотой, которые придают остеопонтину способность связываться с кристаллами гидроксиапатита. В средней части молекулы содержится последовательность RGD (арг-глу-асп), ответственная за прикрепление клеток. Этот белок играет ключевую роль в построении минерализованного матрикса, взаимодействии клеток и матрикса и транспорте неорганических ионов.
Костный сиалопротеин - специфичный белок минерализованных тканей с мол. массой ~70 кДа, на 50% состоящий из углеводов (из них 12% составляет сиаловая кислота). Большинство углеводов представлены О-связанными олигосахаридами, которые содержатся в N-концевой области белка. Этот белок подвергается в реакциях сульфатирования тирозина различным модификациям. В составе костного сиалопротеина определяется до 30% фосфорилированных остатков серина и повторяющихся последовательностей глутаминовой кислоты, которые участвуют в связывании Ca2+. Костный сиалопротеин выявлен в костях, дентине, цементе, гипертрофированных хондроцитах и остеокластах. Данный белок отвечает за прикрепление клеток и участвует в минерализации матрикса.
Костный кислый гликопротеин-75 - белок с мол. массой 75 кДа, по своему составу на 30% гомологичный остеопонтину. Присутствие большого количества остатков глутаминовой (30%), фосфорной (8%) и сиаловых (7%) кислот обеспечивает его способность связывать Ca2+. Белок обнаружен в костной ткани, дентине и хрящевой ростовой пластинке и не определяется в неминерализованных тканях. Костный кислый гликопротеин-75 ингибирует процессы резорбции в минерализованных тканях.
Gla-белки. Отличительной особенностью семейства Gla-белков является присутствие в их первичной структуре остатков 7-карбоксиглутаминовой кислоты. Они различаются по мол. массе и количеству остатков 7-карбоксиглутаминовой кислоты. Образование 7-карбоксиглутаминовой кислоты происходит в процессе посттрансляционной модификации в витамин К-зависимой реакции карбоксилирования остатков глутаминовой кислоты. Наличие дополнительной карбоксильной группы в 7-карбоксиглутаминовой кислоте обеспечивает лёгкое связывание и отдачу ионов Ca2+.
К Gla-белкам относят остеокальцин и матриксный Gla-белок.
Остеокальцин (костный глутаминовый белок) - белок с мол. массой 6 кДа. Состоит из 49 аминокислотных остатков, из которых 3 представлены 7-карбоксиглутаминовой кислотой. Белок присутствует в костной ткани и дентине зуба. Синтезируется в виде предшественника (рис. 3.3).
Рис. 3.3. Образование активной формы остеокальцина.
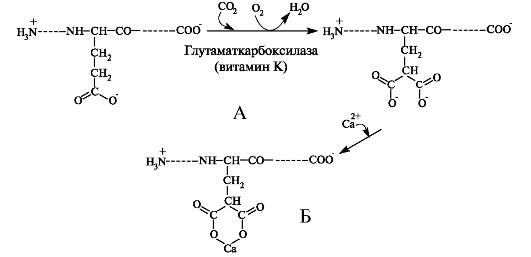
После отщепления сигнального пептида образуется про-остеокальцин, который далее подвергается посттрансляционной модификации. Вначале остатки глутаминовой кислоты окисляются, а затем происходит присоединение молекул СО2 при участии витамин К-зависимой глутаматкарбоксилазы (рис. 3.4). Активность этого фермента снижается в присутствии варфарина - антагониста витамина К.
Рис. 3.4. Посттрансляционная модификация остатков глутаминовой кислоты в молекуле про-остеокальцина. А - гидроксилирование глутаминовой кислоты; Б - связывание ионов кальция 7-карбоксиглутаминовой кислотой.
Нативный остеокальцин связывает Ca2+, идущие на образование кристаллов гидроксиапатита. В плазме крови содержится как нативный остеокальцин, так и его фрагменты.
Матриксный Gla-белок содержит 5 остатков 7-карбоксиглутаминовой кислоты и способен связываться с гидроксиапатитом. Белок обнаружен в пульпе зуба, легких, сердце, почках, хряще и появляется на ранних стадиях развития костной ткани.
Протеин S содержит остатки 7-карбоксиглутаминовой кислоты и синтезируется главным образом в печени. Определяется в костной ткани, а при его дефиците обнаруживают изменения костного скелета.
ГЛАВА 4 СТРУКТУРА И РАЗВИТИЕ ТКАНЕЙ ПОСТОЯННЫХ ЗУБОВ
Эмаль зуба является уникальным сложносоставным биокерамическим материалом и самой твёрдой тканью человеческого организма. В отличие от других твёрдых тканей организма эмаль не обладает клеточной структурой.
4.1. СТРУКТУРА И СВОЙСТВА ЭМАЛИ
Основная масса неорганических компонентов представлена кристаллами гидроксиапатита (75%), карбонатного апатита (12%), фторапатита (1%) и других форм апатитов, прочно связанных с органической матрицей. Имеются и аморфные участки неорганического матрикса. Тонкие, длинные кристаллы гидроксиапатитов эмали имеют размеры от десятков до сотен нанометров и отличаются от кристаллов других плотных тканей своими размерами.
Основной функцией эмали является защита дентина и пульпы зуба от воздействия внешних раздражителей в окружении большого количества бактерий без катастрофических последствий для организма.
В зрелой эмали определяется до 3,8% воды, из них примерно 3,0-3,3% составляет связанная вода, присутствующая в гидратной оболочке на поверхности кристаллов. В незрелой эмали количество воды достигает 20%; с возрастом её количество уменьшается. Около 0,5% приходится на свободную воду, располагающуюся в микропространствах. Жидкость, присутствующую в эмали и содержащую ионы, называют «эмалевым ликвором», или «эмалевой жидкостью». Кристаллы гидроксиапатита создают в эмали эффект молекулярного сита, через которое в эмалевую жидкость проникают небольшие органические молекулы и минеральные ионы. Эмалевая жидкость распределяется неравномерно. В поверхностных участках эмали жидкости немного и её количество увеличивается по направлению к эмалево-дентинной границе. В отличие от воды гидратных оболочек кристаллов, эмалевая жидкость более подвижна и её можно удалить, прогревая зубные ткани при относительно невысоких температурах. Движение жидкости обусловлено капиллярным механизмом, и по жидкости диффундируют ионы и молекулы. Хотя эмаль не содержит клеток и не способна к регенерации, однако в ней постоянно происходит обмен веществ. В эмаль поступают ионы, преимущественно из слюны, а также через дентин из пульпы зуба.
Химический состав эмали
Неорганические вещества зрелой эмали составляют 94-95%, в незрелой формирующейся эмали их намного меньше - всего 5%, а в эмали молочных зубов - 80%. После удаления минеральных компонентов остается тонкая сеть органической матрицы.
Кроме солей фосфата кальция в составе эмали обнаружены свыше 30 разных элементов. В относительно больших количествах присутствуют ионы Mg2+, Na+, а также Cl-, K+, Zn2+ и Fe2+. Минеральный состав эмали может колебаться в зависимости от характера питания, но процентное соотношение кальция, фосфора и карбоната довольно постоянно. Содержание Sr2+, Pb2+ и некоторых других микроэлементов в эмали колеблется значительно и зависит от их количества в почве данной местности.
Минеральные вещества в эмали распределены неравномерно. Поверхностные более плотные слои содержат меньше воды, карбонатов и больше фтора. Количество неорганических компонентов уменьшается в направлении от поверхности к зоне перехода эмали в дентин (табл. 4.1).
Таблица 4.1. Распределение химических элементов в эмали зуба (по Curzon M.E.J., 1983)
Содержание кальция и фосфора в эмали соответственно составляет 33,6-39,4 и 16,1-18,0% по отношению к остальным элементам эмали и в направлении от поверхности зуба к дентину их содержание снижается. Обычно снаружи она для ионов Ca2+ составляет 37,8, а внутри - 34,5% и для фосфатов - 18 и 15%. Однако при этом соотношение кальция и фосфатов остаётся постоянным (2,1 и 2,3 - весовое и 1,62-1,78 - молярное соотношение). Такая же закономерность распределения концентрационного градиента в эмали относится и к хлоридам. Напротив, содержание карбонатов, натрия, магния и железа в эмали увеличивается по направлению к дентину. Свинец присутствует в низких концентрациях. Он накапливается в поверхностных слоях эмали, в то время как медь и стронций равномерно распределяются по всей толщине эмали.
Органические вещества эмали
Доля органических веществ в зрелой эмали составляет 1,2-2,0%. Органический матрикс представлен небольшим количеством углеводов и липидов, а также специфическими для данной ткани белками. Они находятся между кристаллами апатита в виде пучков, пластинок или спирали. Количество липидов, в основном глицерофосфолипидов, достигает 540-570 мг на 100 г ткани. Помимо липидов в эмали содержатся следы углеводов, преимущественно галактозы, глюкозы, маннозы и глюкуроновой кислоты. Также определяется цитрат в количестве 0,1%.
Белки эмали в сформированных постоянных зубах образуют тонкую сетку и представлены энамелинами и амелогенинами в соотношении 1:1. Кроме этих белков в эмали определяются отдельные свободные аминокислоты (глицин, валин, пролин, гистидин, лизин и аргинин) и пептиды. Считают, что белковая матрица, окружающая апатиты, предотвращает контакт кислот с ними и тем самым смягчает воздействие этих кислот на кристаллы гидроксиапатита. Органические компоненты эмали влияют на биохимические и физические процессы, происходящие в эмали зуба. С возрастом увеличивается уровень белка в наружном слое эмали и при этом снижается кариесрезистентность твёрдых тканей зуба.
4.2. АМЕЛОГЕНЕЗ
Образование эмали зуба (амелогенез) связано с дифференцировкой клеток внутреннего эмалевого эпителия. Преэнамелобласты начинают развиваться параллельно с преодонтобластами. Эти клетки содержат большое количество свободных рибосом, митохондрий, комплекс Гольджи и включения гликогена. Дифференцировка клеток эмалевого органа регулируется ТФР-β, инсулиноподобным-1 и эпидермальным факторами роста.
Отложение первых слоёв дентина индуцирует образование секреторно-активных энамелобластов, которые начинают продуцировать эмаль поверх образующегося слоя дентина. Амелогенез связан с секрецией энамелобластами набора специфических белков и состоит из трёх стадий.
Первая стадия (секреторная) включает: • контроль над дальнейшим ростом кристаллов в длину и ширину;
Вторая стадия (созревания) состоит из: • удаления остатков белковых молекул, при этом состав компонентов приближается к таковым зрелой эмали; • завершения роста кристаллов; • длительного насыщения ионами магния и фтора;
Третья стадия (зрелая эмаль) заканчивается:
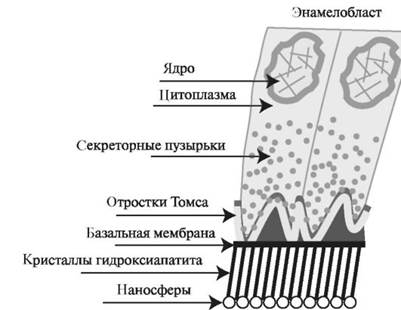
На первой стадии формируется органический матрикс, который лишён минералов и состоит из белков, располагающихся на наружной стороне клеток. Развитие и дальнейшее существование эмали зависит от синтетической активности клеток только на этапе формирования (рис. 4.1).
Рис. 4.1. Строение секреторного энамелобласта.
Преэнамелобласты превращаются в секреторно-активные энамелобласты. В секреторно-активных энамелобластах происходит следующее. В цистернах гранулярной эндоплазматической сети синтезируются белки, преимущественно амелогенины. Они составляют 90% от всех белков, выделяемых энамелобластами, и только 10% протеинов представлены энамелинами, кальций-связывающими и другими белками.
В настоящее время методом двухмерного электрофореза в растворимой клеточной фракции незрелой эмали грызунов было выявлено до 34 различных белков, участвующих в амелогенезе. Эти белки различаются по аминокислотному составу, мол. массе и подвижности в электрическом поле. Некоторые из них идентифицированы, это: • Кальций-связывающие белки: кальбиндин, кальретикулин, аннексин V, кальмодулин и связанные с ним кальцинейтрины А и В. • Белки, участвующие в образовании цитоскелета: тропомиозин, актин, цитокератин (4 изоформы), виментин. • Ферменты: F-субъединица АТФ-синтазы, креатинкиназа, эндоплазмин, энолаза, малатдегидрогеназа, фосфоглюкомутаза, энамелизин (ММП-20), калликреин-4, эмалевая матриксная сериновая протеиназа-1. • Белки, участвующие в формировании межклеточного матрикса: 6 фракций амелогенинов с мол. массой 28, 27, 25, 23, 21 и 19 кДа, энамелины, амелобластины (шеатлины/амелин), альбумины. Помимо белков из созревающей эмали выделены пептиды, липиды, моносахариды.
В процессе синтеза белки подвергаются посттрансляционной модификации, которая включает фосфорилирование и гликозилирование полипептидных цепей. Фосфат присоединяется к остаткам серила (рис. 4.2). В комплексе Гольджи синтезированные белки подвергаются гликозилированию, то есть происходит присоединение остатков галактозамина, глюкозамина и сиаловых кислот.
Рис. 4.2. Посттрансляционная модификация белков: А - серил в составе белка; Б - фосфосерил в составе белка.
Амелогенины содержат большое количество остатков пролина, лейцина, гистидина и глутаминовой кислоты. В их составе отсутствуют гидроксипролин и цистеин, которые характерны для коллагена и кератинов. Это гетерогенная фракция, состоящая из белков с различной мол. массой (19-28 кДа). Белки, выделенные у разных видов животных, имеют подобный аминокислотный состав и не имеют отличий в первых 33 аминокислотных остатках в N-концевой области. По мере созревания происходит расщепление высокомолекулярных амелогенинов и увеличивается доля низкомолекулярных амелогенинов с мол. массой 6 и 13 кДа. В синтезе амелогенинов на ранней стадии развития зуба участвуют как амелобласты, так и одонтобласты, однако большая часть этих белков синтезируется амелобластами в соотношении 320:1. На стадии созревания эмали это соотношение меняется в сторону уменьшения (20:1).
Энамелины, как и амелогенины, относятся к гликофосфопротеинам. Это кислые белки, богатые аспарагиновой и глутаминовой кислотами, пролином и глицином. Они сильно гликозилированы и содержат до 4% гексозаминов, а также 3,8% нейраминовой кислоты. Энамелин присутствует в развивающемся зубе в нескольких изоформах. Вначале синтезируется белок-предшественник с мол. массой 130 кДа. На разных стадиях развития эмали появляются его изоформы с меньшей мол. массой. Установлено, что энамелины с разной мол. массой выполняют различные функции. Из энамелина с мол. массой 89 кДа образуется энамелин с мол. массой 32 кДa, который является амелопротеиназой, участвующей в деградации высокомолекулярных белков. Энамелин с мол. массой 67 кДа содержит большое количество аспарагиновой и глутаминовой кислот, аланина, лейцина и лизина. Он по аминокислотному составу близок к сывороточному альбумину.
Амелобластин (его также называют амелином, или шеатлином) энамелобласты и преодонтобласты секретируют в стадию секреции. Вначале синтезируется амелобластин с мол. массой 68 кДа, и в результате его ограниченного протеолиза появляются множество белков с мол. массой 52, 40, 37, 19, 17, 16, 15, 14 и 13 кДа. Белки с мол. массой 16-17 кДа гидрофобны и нерастворимы в воде. В стадию созревания эмали амелобластин уже исчезает.
Тафтелин - кислый фосфорилированный гликопротеин с мол. массой 43,8 кДа. В его составе определяется 1 гликозилированный участок и 5 остатков цистеина. Он формируется на короткое время только в процессе развития эмали.
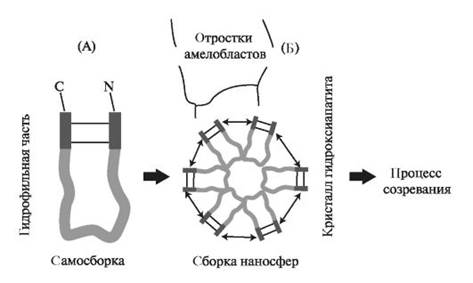
Белки, синтезируемые энамелобластами, упаковываются в везикулы, и далее происходит перемещение секреторных гранул к апикальной поверхности клеток. Гидрофобные молекулы амелогенина агрегируют между собой и собираются в наносферы (рис. 4.3). Сборкананосфер осуществляется в цитоплазме без участия АТФ. В момент образования наносфер осуществляется направленная поставка ионов октакальция фосфата для формирования кристаллов.
Рис. 4.3. Формирование наносфер в процессе амелогенеза: А - образование связи в амелогенине между аминокислотами N- и С-концевой области; Б - собранные из 6 амелогенинов наносферы выделяются отростками амелобластов и участвуют в процессе созревания эмали.
Неорганические ионы к поверхности эмали поступают из капилляров зубного мешочка. Поступление секреторных гранул во внеклеточное пространство обеспечивают сократительные белки цитоскелета - актин и тропомиозин. Содержимое секреторных гранул освобождается и распределяется поверх новообразованного слоя дентина.
Взаимосвязь между белками внеклеточного матрикса обеспечивает белок с мол. массой 39 кДа, сходный по строению с тафтелином и получивший название тафтелин-интерактивный белок (TIP-39). Он синтезируется как амелобластами, так и одонтобластами. TIP-39, как и тафтелин, способен к образованию доменов, в которых присутствуют надвторичные структуры типа спираль-петля-спираль. В С-концевой области располагается домен, обеспечивающий его связывание с клатрином, который выстилает секреторные гранулы. Предполагают, что TIP-39 участвует в транспорте синтезированных амелобластами белков в межклеточный матрикс эмалевого органа. Этот белок также участвует во внутриклеточном переносе амелогенина. Комплексы тафтелина и TIP-39 обеспечивают связь между дентином и амелобластами в процессе образования дентино-эмалевой границы.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 134; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.240.178 (0.138 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||