
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Разложение и взаимодействие со щелочами солей аммония.Содержание книги
Поиск на нашем сайте
Все соли аммония способны разлагаться при нагревании: (NH4)2CO3 = 2NH3↑ + CO2↑ + H2O NH4Br = NH3↑ + HBr↑ Соли аммония способны реагировать как с кислотами, так и с щелочами, при этом должно выполняться хотя бы одно из условий протекания обменных реакций: (NH4)2S + 2HCl = H2S↑ + 2NH4Cl NH4Cl + KOH = KCl + NH3↑ + H2O 94. Взаимодействие бурого газа NO 2 с водой и щелочами Бурый газ NO2 является кислотным оксидом, но не существует кислоты со степенью окисления азота N в ней +4, как в данном оксиде, поэтому NO2 при взаимодействии с водой образует сразу 2 кислоты, одновременно понижая и повышая свою степень окисления до +3 и +5: +4 -2 +1 -2 +1 +3 -2 +1 +5 -2 2NO2 + H2O = HNO2 + HNO3 При взаимодействии со щелочами NO2, соответственно, образуется 2 соли:
+4 -2 +1 -2 +1 +1 +3 -2 +1 +5 -2 +1 -2 2NO2 + 2KOH = KNO2 + KNO3 + H2O Взаимодействие фосфата кальция с углем и оксидом кремния при нагревании. Получение фосфора. Сплавление фосфатов с углем и песком при высокой температуре +2 +5 -2 +4 -2 0 t +2 +4 -2 +2 -2 0 Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 5CO↑ + 2P Образование кислых солей фосфорной кислоты. В зависимости от соотношения фосфорной кислоты или оксида фосфора могут получаться разные типы солей. P2O5 + 6KOH = 2K3PO4 + 3H2O P2O5 + 2KOH + Н2О = 2KН2PO4 P2O5 + 4KOH = 2K2НPO4 + H2O
H3PO4 + 3КOH = К3PO4 + 3H2O H3PO4 + 2KOH = K2HPO4 + 2H2O H3PO4 + KOH = KH2PO4 + H2O
97. Окислительные и восстановительные свойства пероксида водорода. H2O2 как окислитель: +1 -1 0 +1 -1 +2 -1 +1 -2 H2O2 + Zn + 2HCl = ZnCl2 + 2H2O +1 -1 +1 +3 -2 +1 +5 -2 +1 -2 H2O2 + KNO2 = KNO3 + H2O +1 -1 +2 +6 -2 +1 -2 +1 +1 +7 -2 +1 +6 -2 +1 -2 5H2O2 + 2MnSO4 + 6KOH = 2KMnO4 + 2K2SO4 + 8H2O +1 -1 +3 -1 +1 -2 +1 +1 +6 -2 +1 -1 +1 -2 3H2O2 + 2CrCl3 + 10NaOH = 2Na2CrO4 + 6NaCl + 8H2O
H2O2 как восстановитель: +1 -1 +1 +5 -2 0 +1 +5 -2 0 H2O2 + 2AgNO3 = 2Ag↓ + 2HNO3 + O2↑ +1 -1 +1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
5H2O2 + 2KMnO4 + 6HCl = 2KCl + 2MnCl2 + 5O2↑+ 8H2O +1 -1 +1 +6 -2 +1 +6 -2 +1 +6 -2 +3 +6 -2 0 +1 -2 3H2O2 + K2Cr2O7 + 4H2SO4 = K2SO4 + Cr2(SO4)3 + 3O2↑ + 7H2O Разложение пероксида водорода. В растворе пероксид водорода H2O2 неустойчив и может легко разлагаться: 2H2O2 = 2Н2О + О2↑ 99. Взаимодействие серы со щелочами. 0 +1 -2 +1 +1 +4 -2 +1 -2 +1 -2 3S + 6NaOH = Na2SO3 + 2Na2S + 3H2O 100. Восстановительные свойства сероводорода, его взаимодействие с SO 2, H 2 SO 4. +4 -2 +1 -2 0 +1 -2 SO2 + 2H2S = 3S + 2H2O +6 -2 +1 -2 +4 -2 +1 -2 3SO3 + H2S = 4SO2 + H2O +1 +6 -2 +1 -2 +4 -2 +1 -2 3H2SO4 + H2S = 4SO2 + 4H2O 101. Полное и неполное горение сероводорода, окисление сульфидов. В избытке кислорода сероводород окисляется до оксида серы (IV): +1 -2 0 +4 -2 +1 -2 2H2S + 3О2 = 2SO2 + 2H2O В недостатке кислорода сероводород окисляется до серы: +1 -2 0 0 +1 -2 2H2S + О2 = 2S + 2H2O
Сера S в сероводородной кислоте H2S находится в минимальной степени окисления –2, поэтому H2S может проявлять только восстановительные свойства. H2S является сильным восстановителем, поэтому активно реагирует с окислителями. +1 -2 +1 +6 -2 +4 -2 +1 -2 H2S + 3H2SO4 = 4SO2 + 4H2O +1 -2 +2 -2 0 0 +1 -2 H2S + CuO = Cu + S + H2O +1 -2 +4 -2 +2 -2 0 +1 -2 H2S + NO2 = NO + S + H2O
1) Восстановительные свойства сульфидов Сульфиды – соли сероводородной кислоты, также являются сильными восстановителями. +1 -2 +1 +7 -2 +1 -2 +1 +1 +6 -2 0 +1 -2 +1 Na2S + 2KMnO4 + 2KOH = 2K2MnO4 + S + 2NaOH +1 -2 +1 -1 0 +1 -2 +1
K2S + H2O2 = S + 2KOH Взаимодействие конц серной кислоты с галогенидами, получение газообразного хлороводорода Если взять концентрированную серную кислоту и безводный хлорид натрия, то в условиях отсутствия воды мы получим газообразный хлороводород, и поэтому такая обменная реакция пойдет, так как выполняется условие протекания реакции ионного обмена – выделение газа H2SO4(к) + 2NaCl = Na2SO4 + 2HCl↑
При взаимодействии NaCl с обычной разбавленной H2SO4 не образуется газ, так как HCl отлично растворяется в воде, и не выполняется ни одно из условий протекания обменных реакций, поэтому реакция не идет:
103. Обугливание конц серной кислотой глюкозы H2SO4(к) как сильный окислитель способна обугливать сложные органические соединения (сахар): +1 +6 -2 0 +1 -2 +4 -2 0 +4 -2 +1 -2 2H2SO4(к) + С12H22O11 = 2SO2↑ + 11C + CO2↑ + 13H2O 104. Разложение (NH 4)2 Cr 2 O 7 – реакция «вулканчика» Получить в лаборатории Cr2O3 можно с помощью реакции «вулкана» – разложения бихромата аммония: -3 +1 +6 -2 t +3 -2 0 +1 -2 (NH4)2Cr2O7 = Cr2O3 + N2↑ + 4H2O
Переход хроматов в дихроматы и наоборот. Качественные при этом признаки. Хроматы (соли хромовой кислоты) в растворе имеют жёлтый цвет, дихроматы (соли дихромовой кислоты) – оранжевый цвет. Из данных видов солей наибольший интерес представляют хромат калия K2CrO4 и дихромат калия K2Cr2O7. Хроматы в кислой среде переходят в дихроматы (жёлтый цвет раствора меняется на оранжевый): 2K2CrO4 + 2HCl = 2KCl + K2Cr2O7 + H2O
Бихроматы, в свою очередь, переходят в хроматы в щелочной среде (оранжевый цвет раствора меняется на желтый): K2Cr2O7 + 2KOH = 2K2CrO4 + H2O Разложение хлоратов и перхлоратов. +1 +7 -2 t +1 -1 0 KClO4 = KCl + 2O2↑ +1 +5 -2 t +1 +7 -2 +1 -1 4KClO3 = 3KClO4 + KCl
|
||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 104; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.123.240 (0.012 с.) |

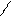 H2SO4 + 2NaCl = Na2SO4 + 2HCl
H2SO4 + 2NaCl = Na2SO4 + 2HCl


