Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
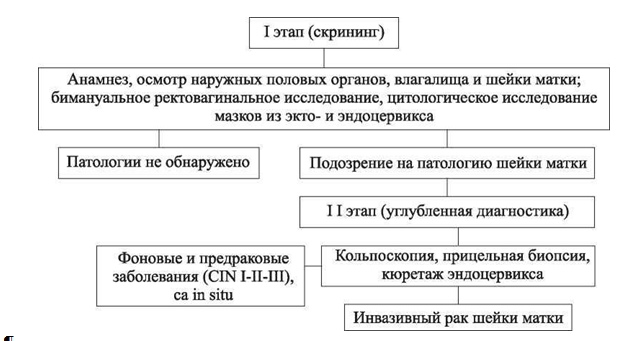
Схема диагностического алгоритма
В последующем, с целью определения распространенности опухолевого процесса и корректного стадирования, применяются: физикалъные методы - пальпация лимфоузлов, осмотр шейки матки и влагалища в зеркалах, ректовагинальное исследование; л учевые методы - экскреторная урография, ирригоскопия, рентгенологическое исследование органов грудной клетки, сканирование костей; инвазивные методы - биопсия, конизация шейки матки, кольпоскопия, цистоскопия, ректороманоскопия, выскабливание цервикального канала; д ополнителъные методы - КТ, МРТ, УЗИ, лимфография, лапароскопия. Важный метод диагностики - УЗИ внутренних гениталий и других органов брюшной полости, забрюшинных лимфоузлов таза и поясничной области, мочевыводящих путей. Возможности методики возрастают при применении трансвагинальной эхографии и допплерографии, но ограничены в начальных стадиях заболевания. Для определения глубины инвазии опухоли, ее распространения на окружающие ткани, метастатического поражения регионарных лимфоузлов более эффективно сочетанное применение КТ и МРТ. МРТ применяется для стадирования процесса, позволяет визуализировать распространение опухоли на шейку матки и параметральную клетчатку. ЛЕЧЕНИЕ РАКА ШЕЙКИ МАТКИ ЛЕЧЕНИЕ РАКА ШЕЙКИ МАТКИ Хирургическое лечение РШМ На протяжении более чем ста лет хирургический метод лечения РШМ является либо основным (при ранних стадиях), либо используется при запущенном РШМ в комбинации с другими методами, такими, как лучевая терапия и полихиомиотерапия. В настоящее время при преинвазивном РШМ применяются: конусовидная электроэксцизия; ножевая ампутация, криодеструкция; лазерная деструкция, лазерная конусовидная эксцизия; ультразвуковая ампутация шейки матки. При микроинвазивном РШМ наиболее распространенным и надежным методом лечения является экстирпация матки без придатков у пациенток репродуктивного периода и экстирпация матки с придатками у пациенток старше 50 лет. Наряду с этим, в последние годы стали рассматриваться варианты органосохраняющего лечения (удаление только шейки матки) у молодых пациенток, желающих сохранить генеративную функцию. Такие пациентки требуют строгого динамического наблюдения с обязательным цитологическим и кольпоскопическим контролем.
С 1970 г. методом выбора хирургического лечения РШМ является чрезбрюшная радикальная гистерэктомия в сочетании с тазовой лимфаденэктомией. Влагалищная экстирпация матки в ее различных модификациях при лечении цервикального рака стала играть ограниченную роль. Однако из-за простоты выполнения, операция оказалась все еще полезной и сегодня. Ее осуществляют либо у очень пожилых пациенток, либо у очень молодых женщин с ранним инвазивным раком, с достаточно высоким риском рецидивирования. Основными наиболее обычными и частыми осложнениями при выполнении радикальной экстирпации матки и лимфаденэктомии считаются повреждения больших тазовых сосудов и стенки мочевого пузыря, влекущие за собой мочевую инфекцию (20%), дисфункцию пузыря (10%) и мочеточниковые фистулы (3 %). С появлением световолоконной оптики и созданием лапароскопа, начиная с 1989 года, были сделаны попытки комбинировать влагалищную радикальную экстирпацию матки с лапараскопической тазовой и парааортальной лимфаденэктомией. РШМ нередко возникает у молодых женщин, которые хотели бы сохранить способность к рождению ребенка. Для этого контингента больных с ранней стадией инвазивного рака была разработана и выполнена чрезвлагалищная радикальная экстирпация шейки матки (с удалением параметральной клетчатки) в сочетании с лапараскопической лимфаденэктомией, сохраняющая функцию матки. Чрезвлагалищную резекцию (экстирпацию) шейки матки у пациенток с цервикальным раком обозначают как «операцию Schauta». Усовершенствованная модификация - сочетание чрезвлагалищной экстирпации шейки матки с лапараскопической лимфаденэктомией и резекцией параметральной клетчатки - во франкоязычной литературе получила название - операция Dargent. По мнению большинства авторов, такая операция относительно проста (но, безусловно, требует определенного онкогинекологического навыка) и обеспечивает необходимый при инвазивном раке шейки матки радикализм и сохранение репродуктивной функции у молодых пациенток. В 2001 году предложена еще одна модификация радикальной ампутации шейки матки. Применяется лапароскопическая лимфаденэктомия предварительно либо параллельно брюшной экстирпации шейки матки, такая операция технически выполнима и позволяет обученному онкогинекологу проводить более широкую параметральную резекцию, чем при радикальной влагалищной ампутации шейки матки с меньшей опасностью вероятных интра- и послеоперационных осложнений.
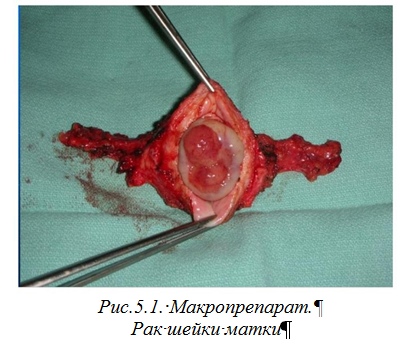
Онкогинекологические критерии излечения МРШМ включают в себя следующие принципы: тщательное изучение послеоперационного препарата (рис.5.1), особенно края разреза, выполнение серийно-ступенчатых срезов, обязательное исследование состояния лимфатических сосудов удаленного органа, длительное динамическое наблюдение за пациенткой (не менее 5 лет) с цитологическим контролем. Рис.5.1. Макропрепарат. Рак шейки матки Лучевая терапия при РШМ используется как в комбинированном лечении или в самостоятельном плане. Предоперационное облучение, направленное на повышение абластичности операции, а также на достижение резектабельности опухоли: - внутриполостная брахитерапия на матку РОД 7 Гр, СОД 14 Гр 1р/5 дней; - сочетанная лучевая терапия (дистанционная лучевая терапия РОД 2 Гр, СОД 30 Гр и внутриполостная брахитерапия РОД 7 Гр, СОД 14 Гр). Послеоперационная лучевая терапия, направленная на профилакику местных рецидивов: - проводится курс сочетанной лучевой терапии на культю влагалища, ложе матки и зоны регионарных лимфатических узлов (дистанционная лучевая терапия РОД 2-2,5 Гр, 4-5 фракций/неделю, СОД 40-46 Гр и внутриполостная брахитерапия РОД 5 Гр, СОД 25 Гр). Самостоятельная сочетанная лучевая терапия применяется как альтернатива хирургическому лечению, а также при наличии абсолютных противопоказаний к хирургическому лечению или отказе от операции (дистанционная лучевая терапия РОД 2-2,5 Гр, 4-5 фракций/неделю, СОД 40-50 Гр и внутриполостная брахитерапия РОД 7 Гр/РОД 8 Гр, СОД 28 Гр/СОД 24 Гр). Паллиативная лучевая терапия проводится при местнораспространенном РШМ при инвазии в соседние органы (мочевой пузырь, прямая кишка), а также на солитарные метастатические очаги в печени, костях, головном мозге. Указанные канцерицидные дозы при лечении РШМ достигаются за счет сочетания дистанционной и внутриполостной (контактной) гамма-терапии.
Химиотерапия РШМ Цитостатики усиливают лучевое повреждение опухолевых клеток за счет нарушения механизма репарации ДНК, синхронизации вступления опухолевых клеток в фазы клеточного цикла, которые наиболее чувствительны к лучевому воздействию. Цитостатики уменьшают число опухолевых клеток, находящихся в фазе покоя, и способствуют девитализации резистентных к ЛТ опухолевых клеток, находящихся в гипоксии. Эффективность химиотерапии у непролеченных пациенток с РШМ колеблется от 21% до 50%, после лучевой или химиотерапии - 0-11%. Из цитостатиков в лечении РШМ применяются иринотекан (кампто), капецитабин (кселода), таксаны (таксол, таксотер), гемцитибин, навельбин. Используются дуплеты на основе препаратов платины или с применением новых цитостатиков: цисплатин+фторурацил, цисплатин+ифосфамид, таксаны, цисплатин+гемцитабин (цитогем), цисплатин+иринотекан (ирнакам), винорельбин и другие схемы ПХТ. Выявлено, что опухоль бывает более химиочувствительной перед ЛТ или операцией. В связи с этим уменьшение объема опухоли за счет предшествующей химиотерапии (XT) может привести к увеличению эффективности ЛТ или способствовать повышению возможности хирургического удаления опухоли со значительным снижением риска интраоперационной диссеминации.
В настоящее время нет однозначного мнения о том, какой из режимов ХТ является стандартом в сочетании с ЛТ. Учитывая умеренно выраженную токсичность и уменьшение риска смерти больных при применении платиносодержащих схем, при проведении химиолучевого лечения предпочтительнее терапия с включением препаратов платины. Проведение курса неоадьювантной ПХТ позволяет в последующем выполнять радикальные операции с удалением потенциально резистентных метастатических очагов и улучшает безрецидивную выживаемость. Схема лечения выглядит следующим образом: дистанционная ЛТ на область малого таза проводится до суммарной очаговой дозы 45 Гр, через 2 недели брахитерапия до суммарной дозы на точку А - 85 Гр; одновременно проводится ХТ цисплатином в дозе 75 мг/м2 и 5-фторурацилом 4 г/м2 (в/в), такой же цикл ХТ повторяется на 22-й день и затем одновременно с проведением брахиотерапии. Перспективным представляется применение внутриартериальной химиотерапии при местнораспространенных формах РШМ. Исследования, несмотря на немногочисленные по составу группы больных и применение разнородных комбинаций цитостатиков, демонстрируют, что эффективность метода и выраженность общетоксических реакций не уступают таковым при системном использовании цитостатиков. Целесообразность назначения химиотерапии в послеоперационном периоде оправдана лишь в случае выявления метастазов в регионарных лимфатических узлах с обязательным включением препаратов платины.
Химиолучевая терапия при метастатическом и/или рецидивирующем РШМ Этот контингент больных составляют пациентки с IV стадией, имеющие отдаленные метастазы или рецидивы заболевания после радикального лечения. Прогноз - неблагоприятный, и поэтому для данной категории больных основным видом лечения является системная паллиативная химиотерапия либо лучевой метод. Основные трудности химиотерапии метастатического РШМ могут быть связаны как с генетической, так и с цитокинетической резистентностью опухолевых клеток. Кроме того, вследствие ранее проведенной лучевой терапии возникает выраженный фиброз мягких тканей и облитерация сосудов малого таза, что нарушает транспорт цитостатиков к опухоли и снижает их эффективность. К тому же предшествующее облучение малого таза значительно уменьшает резервы костномозгового кроветворения, часто вызывает нарушение функции почек, что, в свою очередь, повышает токсичность химиотерапии.
Результаты лечения РШМ Обобщая анализ лечебной помощи больным РШМ, следует отметить, что с позиций обеспечения качества и продолжительности жизни, своевременно выявляемой стадией заболевания можно признать только I стадию, которая составляет не более 20%. Довольно высокий удельный вес III-IV стадий позволяет оценить существующую ситуацию как относительно неблагоприятную, требующую выявлять опухоли в более ранних фазах. Согласно данным Американской ассоциации акушеров-гинекологов, пятилетняя выживаемость для инвазивных форм РШМ следующая: микрокарцинома - до 95%; IA- IB - до 85%; IIA - 75%; IIB- IIIB - не выше 45%; IV - менее 15%. Определяющим фактором прогноза у операбельных больных РШМ IA- IIA стадий является метастатическое поражение регионарных лимфоузлов. 5- летняя выживаемость снижается на 50% при поражении лимфоузлов таза и не превышает 25% при метастазах в поясничные лимфоузлы. При двусторонних множественных метастазах риск регионарного рецидива РШМ в 2 раза выше, чем у больных с 1-3 метастазами, локализованными в лимфоузлах таза с одной стороны. При размерах первичной опухоли менее 2 см 5-летняя выживаемость составляет 90%, до 4 см - 40%. В связи с многообразием методов лечения РШМ, трудностями выбора наиболее оптимального варианта и сложностями его осуществления больные должны находиться в специализированных онкостационарах, располагающих необходимыми диагностическими, радиотерапевтическими установками и должным арсеналом цитостатических средств. Лечебные учреждения указанного профиля должны быть укомплектованы квалифицированными кадрами, обладающими опытом выполнения сложных оперативных вмешательств, навыками лучевой терапии и химиотерапевтических воздействий.
Осложнения лучевых методов лечения РШМ Осложнения лучевых методов лечения представляют собой одну из проблем современной онкологии. При лечении РШМ основным фактором, ограничивающим подведение к ткани опухоли запланированных очаговых доз, является опасность лучевого повреждения влагалища, мочевого пузыря и слизистой кишечника, развитие лучевых реакций и повреждений. Использование современных методик дистанционного и внутриполостного облучения при сочетанном лучевом лечении РШМ способствует изменению частоты, тяжести и характера лучевых реакций и осложнений. Факторами, способствующими развитию ранних и поздних лучевых осложнений, являются повышенная индивидуальная чувствительность прилегающих к опухоли тканей, наличие хронических и острых воспалительных процессов в органах, гистогенез опухоли и прочие.
Качество жизни пациентов - основная задача в лечении РШМ «Качество жизни - это интегральная характеристика физического, психологического, эмоционального, духовного и социального функционирования больного, основанная на его субъективном восприятии». Проблема психологической реабилитации больных раком шейки матки приобрела в последнее время заметное социальное значение в связи с важными тенденциями. Но комбинированное лечение и совершенствование методов лучевой терапии цервикального рака, позволивших заметно улучшить показатели пятилетней выживаемости; адекватно выполненные хирургические операции, сохраняющие функцию яичников, не только избавляют от страданий, но и улучшают качество жизни пациенток. Увеличение продолжительности жизни основной массы больных РШМ сегодня ставит вопрос не только о том, сколько прожила пациентка, но и как она их прожила ЭТИОЛОГИЯ И ПАТОГЕНЕЗ, КЛИНИКА РАКА ТЕЛА МАТКИ ЭТИОЛОГИЯ И ПАТОГЕНЕЗ РАКА ТЕЛА МАТКИ Рак эндометрия встречается реже, чем рак молочной железы. Пик заболеваемости раком тела матки (РТМ) наблюдается в возрастном интервале 60-64 лет. Факторы, увеличивающие риск развития РТМ: · бесплодие и нарушения менструального цикла, связанные с ановуляцией и гиперэстрогенией; отсутствие родов (увеличивает риск РТМ в 2- 3раза); · поздняя менопауза (менопауза после 52 лет увеличивает риск РТМ в 2,4 раза); · ожирение (при массе тела на 10-22,5 кг выше нормы риск РТМ увеличивается в 3 раза, более 22,5 кг - в 10 раз); · синдром Штейна-Левенталя (увеличивает риск РТМ в 14 раз); · заместительная гормонотерапия в постменопаузе (увеличивает риск РТМ в 4-8 раз), одновременная прогестагенная терапия полностью снижает риск; · прием тамоксифена при раке молочной железы увеличивает риск РТМ в 2-3 раза; сахарный диабет увеличивает риск РТМ в 1,3-2,8 раза; · гиперпластические процессы в эндометрии увеличивают риск заболевания. Рассматриваются два патогенетических варианта РТМ: · первый, наиболее частый, возникает у молодых, на фоне гиперэстрогении, сахарного диабета, гипертонической болезни, ожирения (в подобных случаях высокодифференцированный рак развивается на фоне гиперплазии эндометрия, отличается благоприятным прогнозом); · второй, возникает в старшем возрасте в глубокой постменопаузе, на фоне атрофии эндометрия, без гиперэстрогенэмии (в подобных случаях рак, как правило, низкодифференцированный, отличается неблагоприятным прогнозом).
Предраковые заболевания тела матки К предраковым заболеваниям тела матки относят железистую гиперплазию и эндометриальные полипы. Железистая гиперплазия эндометрия (ЖГЭ) часто определяется у больных с ановуляторными маточными кровотечениями. Клиницисты не усматривают существенных различий между железистой и железисто-кистозной гиперплазией эндометрия. Полипы эндометрия развиваются вследствие пролиферации желез базального слоя эндометрия. Непременное анатомическое свойство полипа - наличие ножки, состоящей из фиброзной и гладкомышечной ткани. Признак «органоидности» отличает полип от полиповидной формы железистой гиперплазии эпителия, которую иногда обозначают как полипоз эндометрия. Атипическая гиперплазия эндометрия (АГЭ) является предраковым заболеванием тела матки. Микроскопически АГЭ характеризуется значительным преобладанием железистых элементов над стромальными, чего не бывает при ЖГЭ. Дискуссионным остается вопрос о правомерности диагноза «Са in situ» эндометрия, так как с точки зрения биологического поведения тяжелая АГЭ эквивалентна современным представлениям о преинвазивном раке и гистологически ее трудно отличить от высокодифференцированной аденокарциномы эндометрия. По сводным литературным данным, прогрессия АГЭ в инвазивный рак отмечается в 20-50% наблюдений (в среднем 40%) на протяжении от одного года до 13 лет, что определяет необходимость ее выявления и безотлагательного лечения.
|
|||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 67; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.121.214 (0.036 с.) |