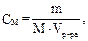Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Растворы слабых кислот и оснований
Растворы слабых электролитов характеризуются двумя величинами: степенью диссоциации (α), которая показывает долю распавшихся молекул, и константной диссоциации (Кдис). Константа диссоциации есть не что иное, как константа равновесия для реакции диссоциации. Константа диссоциации определяет глубину протекания процесса диссоциации, чем меньше Кдис, тем слабее электролит. Согласно закону разбавления Оствальда эти величины связаны соотношением:
Пример 1. Вычислите рН 0,02 М раствора сероводородной кислоты. Решение: Двухосновная слабая кислота диссоциирует в две ступени: H2S ↔ H+ + HS–; HS– ↔ H+ + S2–, каждой из которых отвечает своя константа диссоциации:
По данным справочной литературы, Кl (H2S) = 8,9 · 10–8, Kll (H2S) = 2,5 · 10–13
Так как Кl превышает Кll более чем в 1000 раз, то вычисляем [H+], учитывая только первую ступень диссоциации. Примем концентрацию ионов водорода за х и учтем, согласно уравнению диссоциации сероводородной кислоты по I ступени, что концентрация [H+] = [HS–] = х, а равновесная концентрация недиссоциированных молекул [H2S] = CH2S – x ≈ CH2S. Тогда
отсюда рН = –lg 4,2 · 10–5 = 4,34. Пример 2. Вычислите рН 0,001 М раствора аммиака
Решение: В водном растворе аммиака имеет место равновесие NH3 · H2O ↔ NH4+ + OH–;
Так как По аналогии с предыдущей задачей:
Из ионного произведения воды KW=[H+] · [OH–] = 1,01 · 10–14 находим концентрацию катионов водорода:
pH = –lg 7,6 · 10–11 = 10,10.
Пример 3. Какая масса азотистой кислоты содержится в 0,40 л раствора, имеющего рН = 3,00? (Ка = 4,6 · 10–4) Решение: Так как рН = 3,00, то [H+] = 10–3 моль/л. HNO2 ↔ H+ + NO2–. Из закона разбавления Оствальда следует, что [H+]2 = Ka · Отсюда
m(HNO2) = CM · M · Vр-ра = 2,2 10–3 · 47 · 0,40 = 4,14 · 10–2 г.
Контрольные вопросы 1. Почему шкала значений рН водных растворов кислот, оснований и других соединений находится в пределах от 0 до 14? Может ли рН водного раствора быть больше 14? 2. Назовите все ионы, которые присутствуют в водном растворе серной кислоты. 3. Расположите в ряд по возрастанию величины рН следующие растворы:
а. рН = 3,00; b. pOH = 3,00; c. [OH–] = 10–5 моль/л; d. [H+] = 10–6 моль/л; е. [H+] = [OH–]. 4. При равной молярной концентрации растворы каких кислот будут иметь меньшее значение рН: а) HCl или CH3COOH; b) HNO2 или HClO; c) HCl или HClO2? 5. Какой концентрации ионов водорода соответствуют значения рН: 3,00; 7,00; 10,00; 12,00? 6. Дайте определение степени диссоциации слабого электролита. Как степень диссоциации связана с константой диссоциации? 7. Как зависит степень диссоциации от концентрации электролита в растворе? 8. Напишите уравнения ступенчатой диссоциации Pb(OH)2 и H3PO4 и выражения для констант диссоциации по каждой из ступеней. 9. Катион Cr3+ и катион Fe3+ присутствуют в растворах с одинаковой ионной силой. Отличается ли активность этих ионов в растворах?
Задачи для самостоятельного решения 1. Рассчитайте концентрации ионов Н+ и ОН– в 0,01 М растворе КОН. 2. Раствор Ва(ОН)2 имеет рН = 11,00. Определите молярную концентрацию и молярную концентрацию эквивалента гидроксида бария. 3. Вычислите рН 0,01 М раствора уксусной кислоты, если константа ее диссоциации равна 1,75 · 10–5. 4. Вычислите рН 0,01 М раствора уксусной кислоты, если степень ее диссоциации равна 4,00 %. 5. В растворе какой кислоты при одинаковой молярной концентрации, равной 0,10 моль/л, степень диссоциации кислоты наименьшая: а). HNO2; b). HClO; c). HCN? 6. Рассчитайте ионную силу раствора, в одном литре которого присутствуют 0,01 моль катионов натрия и 0,005 моль сульфат-анионов. 7. Рассчитайте ионную силу раствора, в одном литре которого растворено 11,10 г CaCl2. 8. Раствор гидроксида калия разбавили водой до изменения рН раствора на 1. Во сколько раз разбавили этот раствор? 9. Рассчитайте [H+] в растворе, если рН равно: 3,70; 11,60. 10. Рассчитайте рН следующих растворов: 0,10М HCl; 0,10М Н3ВО3; 0,10М NH3∙H2O 11. Рассчитайте молярную концентрацию муравьиной кислоты, если степень диссоциации 0,05 %. 12. В 0,05М растворе циановодородной кислоты степень диссоциации равна 1,26 · 10–4. При какой концентрации кислоты степень ее диссоциации увеличится в 5 раз? 13. Вычислите равновесные концентрации всех продуктов диссоциации по ступеням в 0,01М растворе фосфорной кислоты.
14. Какая масса НСООН содержится в 0,30 л раствора этой кислоты, имеющей рН = 4,00? 15. Чему равна константа диссоциации кислоты, если рН 0,080М раствора кислоты равен 2,40? 16. Вычислите рН раствора, в 0,40 л которого содержится 0,40 моль аммиака. 17. Рассчитайте молярную концентрацию фосфорной кислоты в растворе с рН = 2,70. 18. Вычислите рН 0,05М раствора азотной кислоты. 19. Рассчитайте ионную силу раствора и рН в растворе следующего состава: 0,20М H2SO4 и 0,10М K2SO4. 20. Рассчитайте ионную силу, активность иона ОН– и рН в растворе содержащего 0,05М Ва(ОН)2 и 0,10М КСl. 21. Рассчитайте рН 0,30М раствора серной кислоты с учетом ионной силы раствора. 22. Рассчитайте, как изменится рН 0,50М раствора КОН при введении в него 0,50 моль/л KCl. 23. Раствор содержит 500 г воды; 0,25 моль сульфата натрия и 0,30 гидроксида натрия. Определите рН этого раствора. 24. Раствор содержит 0,98 г серной кислоты; 0,12 г хлорида натрия и 0,29 г сульфата натрия в 100 г воды. Вычислите рН этого раствора. 25. Рассчитайте рН раствора, полученного при сливании 50 мл 0,05М раствора серной кислоты и 50 мл 0,08М раствора гидроксида натрия. 26. Определите рН полученного раствора, если к 200 мл 1,00 % КОН прибавить 10 мл 8,00 % раствора азотной кислоты (плотность 1,04 г/мл). 27. Вычислите рН раствора, полученного при сливании 200 мл 0,01М Ва(ОН)2 и 5,00 мл 2,00 % раствора серной кислоты (плотность 1,01 г/мл).
|
||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 86; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.121.214 (0.012 с.) |
 при α << 1 формулу можно упростить Кдис
при α << 1 формулу можно упростить Кдис  α2С.
α2С.

 моль/л;
моль/л;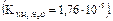 .
.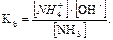
 < 10–4, то равновесная концентрация недиссоциированных молекул аммиака практически равна его общей концентрации [NH3] = 0,001 моль/л.
< 10–4, то равновесная концентрация недиссоциированных молекул аммиака практически равна его общей концентрации [NH3] = 0,001 моль/л.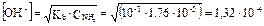 моль/л.
моль/л.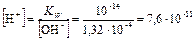 моль/л;
моль/л;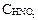
 поскольку
поскольку