
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ионные равновесия в растворахСтр 1 из 10Следующая ⇒
АНАЛИТИЧЕСКАЯ ХИМИЯ Ионные равновесия в растворах Учебно-методическое пособие для студентов I курса
Петрозаводск 2010
Рассмотрено и рекомендовано к печати
Печатается по решению редакционно-издательского совета
Составители: В. В. Вапиров, профессор; Р. Д. Сальникова, доцент; В. И. Беличенко, доцент; Е. Я. Ханина, доцент; Н. В. Вапирова, доцент
© Петрозаводский государственный университет, 2010
От составителей В данном издании рассматриваются различные типы химических равновесий, применяемые в курсе аналитической химии.
Учебно-методическое пособие разделено на пять частей-модулей: § равновесия в водных растворах кислот и оснований; § буферные системы; § равновесия в растворах гидролизующихся солей; § равновесия в растворах малорастворимых соединений; § равновесия в растворах координационных соединений.
Каждый модуль содержит: o краткое теоретическое пояснение к теме; o разбор и решение типовых задач; o контрольные вопросы; o задания для самостоятельной работы студентов; o справочные данные в виде таблиц.
Программа работы с модулем для студентов:
1. Ознакомиться с содержанием темы и ответить на предлагаемые контрольные вопросы. 2. Разобрать способы решения типовых задач, выделив в каждом основные этапы. 3. Проанализировать условие задачи для самостоятельного решения и выбрать необходимые справочные величины из таблиц. 4. Записать математические формулы, произвести в них возможные преобразования и выполнить расчеты. Реализованный в данном пособии метод подхода должен активизировать самостоятельную деятельность студентов, развивать их логическое мышление и способствовать закреплению материала по курсу аналитической химии. Расчет рН растворов кислот и оснований Расчет рН в разбавленных растворах электролитов
Пример 1. Вычислите рН 0,0001 М раствора соляной кислоты. Решение: HCl → H+ + Cl–; [H+] = CHCl = 0,0001 моль/л; pH = – lg 𝑎H+ = – lg[H+;] pH = – lg 10–4 = 4,00.
Пример 2. Вычислите рН раствора, в 500 мл которого содержится 0,20 г NaOH.
Решение: NaOH → Na+ + OH–; [OH–] = CNaOH = pH = 14 – pOH; pOH = –lg[OH–] = –lg0,01 = 2,00; pH = 14 – 2 = 12,00.
Решение типовых задач Пример 1. В 250 мл 0,10М раствора уксусной кислоты растворено 1,025 г ацетата натрия. Вычислите рН буферной системы. Ка = 1,74 · 10–5.
Решение: 1. рН буферной смеси рассчитаем по формуле: рН = рКа – lg 3. Рассчитаем молярную концентрацию соли: См = См = 4. рН = 4,76 – 0,30 = 4,46.
Пример 2. Вычислите рН раствора, полученного путем смешивания 20,0 мл 0,05М раствора азотистой кислоты и 30,0 мл 1,5М раствора нитрита натрия. Кα = 6,9 · 10–4. Как изменится рН при разбавлении буферного раствора в 10 раз? Решение: 1. Рассчитаем молярные концентрации компонентов буферной смеси при сливании разных объемов азотистой кислоты и нитрита натрия. Объем буферной смеси станет равным: V1 + V2 = 50,0 мл, соответственно, концентрации кислоты и соли будут:
Отсюда видно, что отношение концентраций, стоящее под знаком логарифма 2. Рассчитаем рН: рН = рКα – lg 3. Рассмотрим, как изменится рН буферного раствора при разбавлении его в 10 раз. При разбавлении буферного раствора количество веществ не меняется и, следовательно, рН не изменяется.
Пример 3. К 10,0 мл 0,10М раствора уксусной кислоты добавили 5,0 мл 0,05М раствора гидроксида натрия. Чему равен рН полученного раствора? Решение: 1. При смешивании двух растворов протекает реакция: СН3СООН + NaОH → СН3СООNa + Н2О; СН3СООН + ОH– → СН3СОО– + Н2О и образуется ацетатный буферный раствор. 2. Рассчитаем количество кислоты и щелочи до смешивания растворов: n NaOH =
Количество соли (СН3СООNa), образовавшейся в результате реакции, равно количеству добавленной щелочи: nNaOH = Слабый протолит уксусная кислота находится в избытке, ее количество определяется вычитанием количества кислоты, вступившей в реакцию, от количества кислоты до реакции: n (CH3COOH) = 0,001 – 0,00025 — 0,00075 моль. 3. рН данного буферного раствора рассчитаем согласно уравнению: рН = рКа – lg Пример 4. Сколько граммов ацетата натрия необходимо добавить к 100 мл 0,10М раствора уксусной кислоты, чтобы рН стал равен 4,00?
Решение: 1. Запишем протолитическое равновесие данной системы CH3COOH + Н2О ↔ СН3СОО– + Н3О+. CH3COONa → CH3COO - + Na+ 2. рН буферного раствора рассчитываем по уравнению: рН = – lg Ка – lg 3. Выразим молярную концентрацию уксусной кислоты через количества вещества: n = CV следовательно рН = – lg Ка – lg рН = – lg Ка – lg 4,00 = 4,76 – lg nС = 10–2,76 = 0,0017 моль, mС = nM = 0,0017 · 82 = 0,142 г.
Пример 5. Как изменится рН аммонийной буферной системы, содержащей по 0,10 моль аммиака и хлорида аммония в литре раствора, если прибавлено: а) 0,02 моль HCl; б) 0,02 моль NaOH? Решение: 1. Для расчета рН исходного раствора аммиачного буфера воспользуемся формулой рН = 14 – рКв + lg pH = 14 – 4,76 + lg рН исходного раствора аммиачного буфера равен 9,24. а) К исходной буферной смеси добавили 0,02 моль соляной кислоты. Согласно механизму действия буферной системы количество аммиака уменьшится (NH3 + HCl = NH4Cl): n (NH3)= 0,10 – 0,02 = 0,08 моль, а количество соли увеличится: n (NH4Cl)= 0,10 + 0,02 = 0,12 моль. Изменится соотношение компонентов буферной системы и рН изменится: рН = 14 – 4,76 + lg б) К исходной буферной смеси добавили 0,02 моль гидроксида натрия. В системе увеличивается концентрация слабого протолита (аммиака): NH4+ + OH– ↔ NH3 + H2O, n (NH3) = 0,10 + 0,02 = 0,12 моль, а концентрация соли уменьшится: n (NH4Cl) = 0,10 – 0,02 = 0,08 моль, рН = 14 – 4,76 + lg Пример 6. Вычислите объемы растворов гидрофосфата и дигидрофосфата натрия с концентрацией солей 0,15 моль/л для приготовления буферного раствора объемом 1 л с рН = 7,00. Решение: В растворе фосфатной буферной смеси (NaH2PO4 + Na2HPO4) диссоциация ее компонентов протекает по уравнениям: NaH2PO4 → Na+ + H2PO4–; Na 2HPO4 → 2Na+ + HPO42–. Ион H2PO4– диссоциирует как слабая кислота H2PO4– ↔ Н+ + HPO42–. Диссоциация иона HPO42– крайне незначительна (KII > KIII), следовательно, NaH2PO4 играет роль кислоты, а Na2HPO4 — ее соли. 1. Запишем протолитическое равновесие H2PO4– + H2O ↔ Н3О+ + НРО42–. 2. Найдем соотношение концентраций компонентов в буферном растворе, который надо приготовить: рН = рКII – lg Обозначим объем раствора гидрофосфата натрия через х л, тогда объем раствора дигидрофосфата натрия (1 – х) л. Так как количества этих веществ находятся в одном и том же объеме, отношение концентраций можно заменить отношением количеств веществ: 7,00 = 7,21 – lg х = 0,38 л, то есть V(Na2HPO4) = 0,38 л; V(NaH2PO4) = 0,62 л.
Пример 7. Имеется раствор, содержащий уксусную кислоту, и ацетат натрия в соотношении 3:1. Чему будет равно соотношение кислоты и соли при изменении рН на единицу? Ka (CH3COOH) = 1,74 · 10–5. Решение: 1. Рассчитаем рН исходного раствора по уравнению: рН = рКа – lg 2. При значении рН = 3,28 соотношение кислоты и соли рассчитываем: 3,28 = 4,76 – lg следовательно 3. Если значение рН увеличилось до 5,28, то соотношение кислоты и соли становится: 5,28 = 4,76 – lg Таким образом, при изменении рН на ± 1 соотношение компонентом изменится с 3:1 до 30:1 и 1:3 соответственно.
Пример 8. Буферная емкость раствора по кислоте равна 0,04 моль/л. Вычислите, какой объем раствора серной кислоты с молярной концентрацией 0,20 моль/л можно добавить к 150 мл этого раствора, чтобы сместить рН не более чем на 0,50 единицы?
Решение: Буферную емкость по кислоте рассчитывают по формуле:
Необходимо перевести молярную концентрацию в молярную концентрацию эквивалента Рассчитаем молярную концентрацию эквивалента серной кислоты. Фактор эквивалента (fэ) H2SO4 равен ½.
Сэ(H2SO4) = 2 · 0,20 = 0,40 моль/л.
Тогда 0,04 = V(H2SO4) = Контрольные вопросы 1. Дайте определение буферной системе. 2. Какие существуют способы приготовления буферных растворов? 3. Какие из перечисленных веществ и в каких сочетаниях можно взять для приготовления буферных растворов: аммиак, уксусная кислота, соляная кислота, гидроксид калия, дигидрофосфат натрия, хлорид натрия, сульфат калия, гидрофосфат калия? 4. Приведите примеры буферных систем, имеющих рН > 7 и рН < 7. Укажите сопряженные протолитические пары в этих растворах. 5. Перечислите факторы, от которых зависит рН буферного раствора. 6. рН раствора необходимо поддерживать приблизительно 6,5. Какую буферную систему следует для этого выбрать: а) ацетатную; б) фосфатную; в) аммиачную? 7. Что называется буферной емкостью раствора? От каких факторов зависит буферная емкость? 8. Почему прибавление небольшого количества HNО3 к аммиачной буферной смеси не вызовет значительного изменения рН раствора? 9. Почему прибавление небольшого количества щелочи не вызовет изменения рН фосфатной буферной смеси?
Задачи для самостоятельного решения 1. Вычислите рН буферных смесей, полученных при сливании равных объемов 0,01М растворов НАс и NaAc; 0,01М раствора НАс и 0,02М раствора NaAc; 0,02М раствора НАс и 0,01М раствора NaAc. 2. Вычислите рН формиатной буферной смеси, в литре которой содержится 0,50 моль НСООН и 0,40 моль НСООК. Как изменится рН, если к 1 литру этого раствора прибавить 0,10 моль НС1? 3. Вычислите рН аммиачной буферной смеси, содержащей равное число молей NH3 и NH4CI. Как изменится рН при разбавлении раствора в 2 раза? 4. Вычислите массу хлорида аммония, которую следует добавить к раствору аммиака с концентрацией 0,137 моль/л и объемом 2,0 л, чтобы получить буферный раствор с рН = 10,34. 5. Имеется 100,0 мл раствора уксусной кислоты, в котором степень ее диссоциации равна 1,90 %. Вычислите массу ацетата калия, которую следует добавить в этот раствор для получения буферного раствора с рН = 4,00. 6. Вычислите, какие объемы растворов формиата натрия с концентрацией 0,20 моль/л и муравьиной кислоты с концентрацией 0,30 моль/л необходимо взять для приготовления буферного раствора объемом 250,0 мл с рН = 4,25.
7. Вычислите, какой объем раствора хлорида аммония с концентрацией 0,20 моль/л и объем раствора аммиака с концентрацией 0,30 моль/л необходимы для приготовления буферного раствора объемом 300,0 мл с рН = 9,50. 8. Вычислите массу ацетата натрия, которую следует добавить к 2 л раствора с концентрацией уксусной кислоты 0,316 моль, чтобы получить буферный раствор с рН = 4,87 (изменением объема пренебречь). 9. Ацетат натрия массой 16,40 г растворили в дистиллированной воде, объем полученного раствора при этом составил 0,20 л. Уксусную кислоту массой 12,00 г растворили в дистиллированной воде, и объем полученного раствора довели до 0,50 л. В каком объемном соотношении смешали два эти раствора, если образовавшийся буферный раствор имеет рН = 4,75? 10. Как изменится рН фосфатного буферного раствора, содержащего 100,0 мл раствора дигидрофосфата натрия и 300,0 мл раствора гидрофосфата натрия (концентрации исходных растворов равны по 0,10 моль/л), при добавлении к нему 20,0 мл раствора NaOH с концентрацией 0,10 моль/л? 11. Буферные растворы приготовлены смешением растворов:
Расположите буферные растфоры в порядке убывания их буферной емкости. Ответ подтвердите расчетом. 12. Вычислите рН раствора, полученного смешением 5,00 мл раствора дигидрофосфата натрия с концентрацией 0,20 моль/л и 10,00 мл раствора гидроксида натрия с концентрацией 0,20 моль/л. 13. Вычислите рН раствора, полученного смешением 5,00 мл раствора гидрофосфата натрия с концентрацией 0,20 моль/л и 10,00 мл раствора соляной кислоты с концентрацией 0,02 моль/л. 14. К раствору, содержащему ацетат натрия массой 16,40 г, добавили 50,0 мл соляной кислоты с концентрацией хлороводорода 1,00 моль/л. Объем полученного раствора довели дистиллированной водой до 1 л. Вычислите рН конечного раствора. 15. Какие из перечисленных растворов обладают буферным действием? Ответ подтвердите расчетом и рассчитайте рН полученного буферного раствора.
16. Какие из перечисленных растворов обладают буферным действием? Ответ подтвердите расчетом и рассчитайте рН полученного буферного раствора.
Гидролиз солей I. Гидролиз солей по аниону Анионы слабых кислот (СО32–, SO32–, S2–, SiO32–, PO43–, AsO43– и т. д.) в реакциях гидролиза ведут себя как основания Бренстеда. Гидролиз многозарядных ионов идет в основном по первой ступени с образованием кислых солей:
SO32– + НОН ↔ НSO3– + ОН–. В молекулярном виде уравнение гидролиза имеет вид: К2SO3 + H2O ↔ KHSO3 + KOH. рН растворов таких солей имеет значение больше 7, т. е. среда щелочная. Данное протолитическое равновесие характеризуется константой гидролиза (Kг) и степенью гидролиза (hг):
В общем случае для гидролиза солей по аниону имеем следующие расчетные формулы: 1. Для константы гидролиза: Kw — ионное произведение воды (Kw = 10–14, t = 25 °C, p = 1 атм); Кα — константа сопряженной кислоты, т. е. константа диссоциации слабой кислоты (см. Приложение, табл. 2). 2. Для степени гидролиза: 3. Величина рН растворов таких солей рассчитывается по уравнению: рН = 7 – ½ lgKα + ½ lgCс.
Решение типовых задач Пример 1. Рассчитайте Kг, hг, pH 0,01М раствора гипохлорита натрия. Кα(HClO) = 2,95 · 10–8. Решение: Гипохлорит натрия — соль образована сильным основанием NaOH и слабой кислотой HClO, следовательно, она подвергается гидролизу по аниону. 1. Запишем уравнение гидролиза: ClO– + H2O ↔ HClO + OH–. 2. Рассчитаем константу гидролиза: 3. Определим степень гидролиза соли:
4. Найдем концентрацию ОН–: из уравнения реакции гидролиза видно, что [HClO] = [OH–]
pOH = – lg(5,8 · 10–5) = 4,23; pH = 14 – 4,25 = 9,77. Применив расчетную формулу, также можно вычислить рН данного раствора: рН = 7 – ½ lg (2,95 · 10–8) +1/2 lg10–2 = 7 + 3,77 – 1 = 9,77.
Пример 2. рН раствора ацетата натрия CH3COONa равно 9,50. Рассчитайте См, Kг, hг соли. Кα(CH3COOН) = 1,76 · 10–5. Решение: Соль ацетат натрия образована сильным основанием NaOH и слабой кислотой CH3COOН, следовательно, гидролизу подвергается по аниону. 1. Запишем уравнение гидролиза: CH3COO– + Н2О ↔ CH3COOН + ОН–. 2. Определим концентрацию соли, используя значение рН данного раствора:
3. Рассчитаем константу и степень гидролиза:
Пример 3. Вычислите рН раствора, полученного при растворении 5,35 г хлорида аммония в 1 л H2O. Kв(NH3∙Н2О) = 1,75 · 10–5. Решение: Хлорид аммония — соль, образованная сильной кислотой HCl и слабым основанием NH3∙Н2О, следовательно, гидролизуется по катиону. 1. Запишем уравнение гидролиза в ионной форме: NH4+ + H2O Û NH3 + H3O+. 2. Рассчитаем молярную концентрацию хлорида аммония:
3. Находим концентрацию катионов водорода:
рН = –lg7,56 · 10–6 = 5,10.
Пример 4. Вычислите степень гидролиза и константу гидролиза бромида аммония в 0,10М растворе, рН которого равен 5. Кв = 1,75 · 10–5. Решение: 1. Запишем ионное уравнение гидролиза: NH4+ + H2O ↔ NH3 + H3O+. 2. Определим концентрацию ионов водорода в растворе соли: рН = 5,00; [H+] = 10–5 моль/л. 3. Рассчитаем степень гидролиза бромида аммония: [NH3] = [H+], тогда hг = 4. Константу гидролиза рассчитаем согласно уравнении.
Зная константу ионизации слабого электролита и ионное произведение воды, запишем:
Пример 5. Рассчитайте константу диссоциации (Кα) азотистой кислоты, если концентрация раствора нитрита калия равна 1 · 10–3 моль/л, рН раствора соли равен 7,15. Решение: 1. Запишем уравнение гидролиза: NO2– + H2O Û HNO2 + OH–. 2. [HNO2] = [OH–],
3. Среда раствора при гидролизе этой соли определяется наличием в растворе гидроксильных групп. рН + рОН = 14, тогда рОН = 14 – рН, рОН = 14 – 7,15 = 6,85, рОН = –lg[OH–] [OH–] = 1,4 · 10–7 моль/л. 4. Рассчитаем константу диссоциации слабого протолита (HNO2); подставить в формулу (I) численные значения.
Пример 6. Во сколько раз надо изменить концентрацию 0,1М раствора ацетата натрия (CH3COONa), чтобы степень гидролиза соли удвоилась? Решение: Степень гидролиза любого растворенного вещества увеличивается при уменьшении концентрации раствора, значит, раствор следует разбавить, добавив воды.
При уменьшении концентрации Сс в х раз степень гидролиза увеличивается в
Пример 7. Оцените рН 1,0М раствора гидросульфита калия (KHSO3). Решение: 1. Гидросульфит калия в растворе полностью диссоциирован на ионы: KHSO3 → К+ + HSO3–. KI = 1,6 ·10-2
2. Ионы HSO3– участвуют в двух равновесиях: — диссоциации по второй ступени: HSO3– + H2O Û Н3О+ + SO32–, КII = 6 · 10–8; —гидролиза: HSO3– + H2O Û H2SO3 + OH–, Если Кll > Kr, то реакция среды практически полностью определяется равновесием диссоциации иона HSO3–.
рН = –lg[H+] = –lg (2,40 · 10–4) = 3,60.
Контрольные вопросы 1. В чем состоит различие между гидратацией иона и гидролизом иона? 2. Как влияет на глубину протекания гидролиза соли заряд катиона и его радиус? 3. Какие факторы влияют на степень гидролиза соли? 4. Расположите перечисленные катионы в ряд по возрастанию способности к гидролизу: Al3+, Cr3+, Fe3+. 5. В какой цвет окрасится каждый из растворов К2СО3 и NH4Cl при добавлении следующих индикаторов: а) метилового оранжевого; б) фенолфталеина? Напишите реакции гидролиза этих солей. 6. Напишите уравнения реакций гидролиза следующих солей: сульфат меди (II), карбонат аммония, фосфат натрия, хлорид железа (III). 7. Укажите реакцию среды водных растворов следующих солей: а) иодид калия, бромид аммония, сульфид натрия; б) дигидрофосфат калия, нитрат калия, цинкат натрия; в) хлорид хрома (III), хлорид бария, сульфат калия. 8. Какие условия необходимо создать, чтобы подавить гидролиз сульфата железа (II)? 9. Как изменится степень гидролиза цианида натрия при добавлении к раствору: а) гидроксида натрия; б) хлороводородной кислоты? 10. Почему гидролиз сульфида хрома (III) идет необратимо? Ответ подтвердите уравнением реакции. 11. При взаимодействии растворов Fe2(SO4)3 и K2CO3 выпадает осадок гидроксида железа (III)? Дайте пояснения, напишите реакции. 12. При равных концентрациях солей степень гидролиза какой соли больше: NH4NO2 или NH4СN? Ответ подтвердите расчетами. 13. В какой последовательности уменьшаются значения рН водных растворов приведенных ниже солей с одинаковой молярной концентрацией: а) нитрит калия; б) нитрат калия. в) сульфат меди (II) 14. Какую реакцию среды (кислую, нейтральную, щелочную) имеют водные растворы следующих солей: а) цианид аммония; б) ацетат аммония; в) фторид аммония.
Задания для самостоятельной работы 1. Почему при растворении в воде хлорида висмута (III) раствор подкисляют? Напишите уравнение гидролиза, выражение константы гидролиза. Какие факторы надо использовать, чтобы подавить гидролиз этой соли? 2. В 1 л раствора содержится 1,96 г ацетата калия. Рассчитайте степень гидролиза и концентрацию уксусной кислоты, которая образовалась в результате гидролиза соли. 3. Во сколько раз надо изменить концентрацию 0,10 М раствора цианида натрия, чтобы степень гидролиза соли удвоилась? 4. рН 0,01М раствора калиевой соли слабой одноосновной кислоты равно 9,50. Вычислите: а) константу гидролиза этой соли б) степень гидролиза этой соли. 5. Вычислите константу гидролиза и рН раствора гидроселенита калия. 6. Какую массу сульфата аммония растворили в 1 л воды, если в результате гидролитического процесса рН раствора равен 5,60? 7. Вычислите степень гидролиза и рН 0,012М раствора сульфата меди (II). 8. Рассчитайте рН раствора арсената натрия, содержащего 3,05 г соли в 250 мл раствора. 9. Как изменится рН 0,10 моль/л раствора карбоната натрия, если этот раствор разбавить в 10 раз? 10. Рассчитайте молярную концентрацию раствора силиката натрия, если рН раствора равен 8,50. 11. Рассчитайте константу гидролиза и степень гидролиза раствора цианида аммония. 12. Какие факторы подавляют гидролиз солей, образованных сильным основанием и слабой кислотой (например, K2S, K2CO3, K2SO3): а) разбавить водой; б) понизить температуру; в) повысить температуру; г) добавить кислоту; д) добавить щелочь? Обоснуйте ответ, написав реакции гидролиза этих солей. 13. Рассчитайте рН 0,10 моль/л растворов следующих солей: Na3PO4, Na2HPO4, NaH2PO4. Прокомментируйте полученные результаты. 14. Вычислите степень гидролиза ацетата аммония: а) при t = 25 °C; б) при t = 100 °C. Какой вывод можно сделать из полученных результатов? 15. При обнаружении ацетат-ионов исследуемый раствор нагревают на водяной бане с хлоридом железа (III). Образуется красно-бурый осадок. Напишите уравнение реакции. Какой процесс при этом протекает? 16. Рассчитайте константу диссоциации метановой кислоты, если концентрация раствора формиата натрия равна 1 · 10–2 моль/л, рН раствора соли 7,50. 17. Вычислите значение констант гидролиза при t = 25 °C растворов: а) цианида калия; б) ацетата калия. Прокомментируйте полученные результаты. 18. К раствору хлорида хрома (III) прибавили раствор карбоната натрия. При этом образовался осадок, растворимый в избытке щелочи и кислоты. Напишите уравнения реакций, дайте пояснения. 19. Пробирку с раствором хлорида железа (III) нагрели и поместили в нее кусочек цинка (предварительно очищенного). Какой газ при этом выделяется? Напишите уравнения соответствующих реакций. 20. Расположите соединения Na2СO3, NaHСO3, NaОH. в порядке увеличения рН, если растворы имеют одинаковую концентрацию равную 0,10 моль/л.
Варианты контрольных задач по темам: расчеты рН и рОН сильных и слабых электролитов, буферных растворов, растворов гидролизующихся солей Вариант № 1 1. Рассчитайте [H+] и рН в растворах: а) HCl; б) Ва(ОН)2 Молярную концентрацию растворов считать равной 0,015 моль/л. 2. Рассчитайте коэффициент активности активности ионов водорода в растворе уксусной кислоты, если молярная концентрация кислоты равна 0,006 моль/л и рН = 3,49. 3. Как изменится [H+] в растворе, если величина рН раствора: а) уменьшится на 2 единицы; б) увеличится на 2 единицы. 4. Вычислите значения рН растворов, содержащих в 1 л: а) 0,10 г КОН; б) 6,30 г HNO3 5. Рассчитайте рН буферного раствора, полученного растворением 9,60 г CH3COOH и 0,82 г CH3COONa в 500 мо воды. 6. Концентрация нитрита калия в растворе равна 1 · 10–3 моль/л, рН раствора 7,15. Рассчитайте константу диссоциации азотистой кислоты Кα. 7. Сколько граммов NH4Cl надо растворить в 20,0 мл 0,50М раствора аммиака, чтобы получить концентрацию гидроксид-ионов, равную 5 · 10–4 моль/л?
Вариант № 2 1. Рассчитайте [H+] и рН в растворах: а) NH3 · H2O; б) HCl Молярную концентрацию растворов считать равной 0,015 моль/л. 2. Рассчитайте коэффициент активности ионов водорода в растворе серной кислоты, если См (H2SO4) = 0,01 моль/л; рН = 1,76. 3. Вычислите молярную концентрацию растворов муравьиной кислоты, значения рН которых составляют: а) 2,30; б) 3,10. 4. Вычислите активность ОН- и значения рН для раствора КОН с массовой долей раствора 2,00 %, ρр-ра = 1,02 г/мл. 5. Определите рН в растворе, содержащем 0,10 моль аммиака и 0,01 моль NH4Cl в 100 мл раствора. КВ = 1,80 · 10–5. Как изменится рН раствора при добавлении 0,70 г HCl? 6. рН раствора ацетата натрия составляет 9,50. Рассчитайте СМ, Кг, hг раствора полученной соли. 7. Сколько граммов нитрита натрия надо растворить в 0,60 л воды, чтобы рН полученного раствора стало равным 6,00?
Вариант № 3
1. Рассчитайте рН раствора серной кислоты объемом 100 мл и массовой долей 3,00 % (ρр-ра = 1,0 г/мл). Как изменится рН раствора после добавления 0,05 моль сульфата алюминия? 2. Какая масса НСООН содержится в 300 мл раствора, если рН = 3,00? 3. Степень диссоциации 0,10М раствора аммиака равна 1,33 %. Вычислите рН этого раствора. 4. Как изменится концентрация ионов водорода в воде, если температура воды увеличилась от 20 до 80 °С? 5. В 1,0 л раствора содержится 1,96 г ацетата калия. Рассчитайте степень гидролиза и концентрацию уксусной кислоты, образовавшейся в результате гидролиза соли. 6. Сколько граммов цианида калия надо добавить к 500 мл 0,40М раствора HCN, чтобы раствор стал нейтральным? 7. Сколько граммов KH2PO4 надо растворить в 25,0 мл 0,20М раствора К2НРО4, чтобы рН = 7,20?
Вариант № 4 1. Как изменится рН раствора серной кислоты объемом 100 мл с СЭ = 0,05 моль/л после добавления 20,0 мл 0,50М раствора сульфата калия? 2. Рассчитайте значение рН раствора, полученного при смешении равных объемов растворов 0,06М H2SO4 и 0,02М HCl. 3. Вычислите концентрацию сероводородной кислоты в растворе, рН которого 4,60. 4. При разбавлении раствора в 10 раз его рН изменился точно на единицу. Что можно сказать на основании этого факта о концентрации раствора и природе растворенного электролита? 5. рН 0,10М раствора калиевой соли некоторой одноосновной органической кислоты равна 9,00. Вычислите константу гидролиза и константу диссоциации этой кислоты. 7. Во сколько раз надо изменить концентрацию 0,10М раствора ацетата натрия, чтобы степень гидролиза соли удвоилась? 7. Сколько граммов уксусной кислоты надо добавить к 100 мл 0,50М раствора ацетата калия, чтобы раствор имел рН = 5,00?
Вариант № 5 1. рН желудочного сока равен 0,90. Определите молярную концентрацию (моль/л) соляной кислоты. 2. Рассчитайте активность Н+ в 0,01М растворе H2SO4, содержащем 0,20 моль/л Na2SO4. 3. В растворе какой кислоты и во сколько раз [Н+] больше: а) Н2СО3 или H2SiO3; б) HCl или HCIO? Молярные концентрации кислот считать одинаковыми. 4. Вычислите КВ и рКВ в растворе аммиака (NH3 · H2O) ω = 1,00 % и ρ = 1,0 г/мл, если степень диссоциации α = 0,77%. 5. Рассчитайте рН 0,10М растворов следующих солей: а) Na3PO4; b) Na2HPO4; с) NaH2PO4. Напишите соответствующие уравнения реакций, прокомментируйте полученные результаты. 6. Сколько молей NH4Cl следует добавить в один литр 0,10М раствора NH3 · H2O, чтобы молярная концентрация гидроксид-ионов стала равной константе диссоциации этого слабого основания? 7. К 210 мл 0,10М раствора карбоната натрия добавили 90 мл 0,10М HCl. Вычислите рН полученного раствора.
Вариант № 6 1. Рассчитайте [Н+] и рН растворов а) H2SO4; б) Са(ОН)2. Молярная концентрация растворов равна 0,0125 моль/л. 2. Чему равен рН раствора ортоборной кислоты молярной концентрации эквивалента 0,08 моль/л? 3. Какую массу азотистой кислоты необходимо растворить в 200,0 мл воды, чтобы рН раствора был равен 2,50? 4. Вычислите активность Н+ и значение рН раствора NaОH объемом 300,0 мл ω = 3,00% и ρ = 1,02 г/мл. 5. К 500,0 мл раствора муравьиной кислоты с молярной концентрацией 0,20 моль/л прибавили 3,40 г формиата натрия. Определите рН полученного раствора. Как изменится рН раствора при добавлении 1,00 г NaОH? 6. Рассчитайте Kг, hг, рН раствора нитрата аммония СМ = 0,025 моль/л. 7. Сколько граммов карбоната натрия растворено в 0,50 л воды, если рН полученного раствора равен 9,90?
Вариант № 7 1. Рассчитайте [Н+] и рН растворов: а) HCN; б) NaOH. Молярная концентрация растворов равна 0,003 моль/л. 2. Какую массу уксусной кислоты необходимо растворить в 500 мл воды, чтобы получить раствор с рН = 2,50 (плотность полученного раствора принять за 1 г/мл)? 3. Чему равен рН раствора Са(ОН)2 с молярной концентрацией эквивалента, равной 0,08 моль/л? 4. Вычислите активность Н+ и значение рН раствора H2SO4 ω = 2,5 % и ρ = 1,019 г/мл. 5. Рассчитайте рН раствора, содержащего 5,0 г аммиака и 2,0 г нитрата аммония в 0,59 л раствора. Как изменится рН раствора при добавлении 1,0 г HCl? 6. Рассчитайте Kг, hг, рН для 0,05М раствора K2SO3. 7. В каком объеме воды надо растворить 0,03 г ацетата натрия, чтобы рН стало равным 8,00? Вариант № 8 1. Рассчитайте [Н+] и рН растворов: а) Ва(ОН)2; б) HNO3. Молярная концентрация растворов равна 0,02 моль/л.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 171; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.135.224 (0.285 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

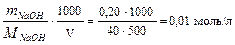
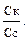
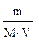 [моль/л];
[моль/л];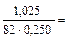 0,05 моль/л.
0,05 моль/л.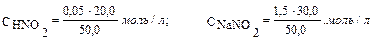
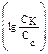 , можно заменить на отношение количеств веществ
, можно заменить на отношение количеств веществ 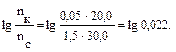
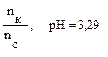 – lg 0,022 = 4,94.
– lg 0,022 = 4,94.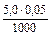 = 0,00025 моль/л;
= 0,00025 моль/л;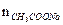 =
= 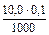 = 0,001 моль.
= 0,001 моль.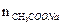 = 0,00025 моль.
= 0,00025 моль.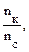 pH = 4,76 – lg
pH = 4,76 – lg 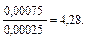
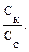
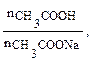
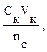
 –0,76 = – lg
–0,76 = – lg 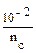 отсюда
отсюда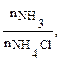
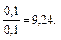
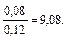
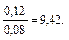
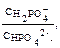 где рКII = 7,21.
где рКII = 7,21. 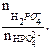 lg
lg 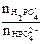 = lg
= lg 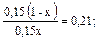
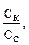 pH = 4,76 – lg
pH = 4,76 – lg 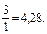
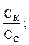 отсюда lg
отсюда lg 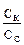 = 1,48,
= 1,48,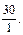
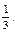
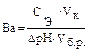
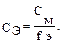
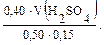
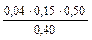 = 0,0074 л = 7,50 мл.
= 0,0074 л = 7,50 мл.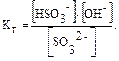 ?
?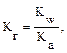 где
где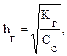 где Сс — молярная концентрация соли (моль/л).
где Сс — молярная концентрация соли (моль/л).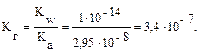
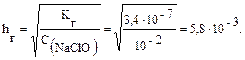
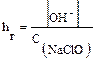 [OH–] = hr · C(NaClO) = 5,8 · 10–3∙10-2=5,8∙10-5;
[OH–] = hr · C(NaClO) = 5,8 · 10–3∙10-2=5,8∙10-5;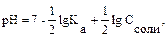 обозначим [CH3COONa] = х моль/л,
обозначим [CH3COONa] = х моль/л,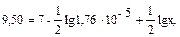 0,24 = lgx, x = 1,74 моль/л.
0,24 = lgx, x = 1,74 моль/л.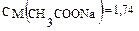 моль/л.
моль/л.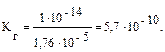
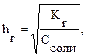
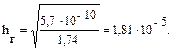
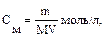
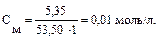
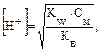
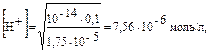
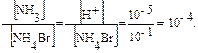
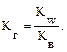
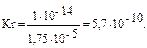
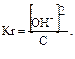
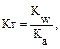 следовательно?
следовательно?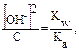
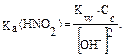 (I)?
(I)?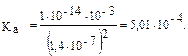
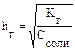
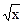 раз Û чтобы hr удвоилась, раствор нужно разбавить в 4 раза.
раз Û чтобы hr удвоилась, раствор нужно разбавить в 4 раза.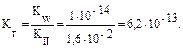
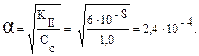 Равновесная концентрация [H+] = 𝑎· См при С = 1 моль/л. [H+] = 2,4 · 10–4 моль/л,
Равновесная концентрация [H+] = 𝑎· См при С = 1 моль/л. [H+] = 2,4 · 10–4 моль/л,


