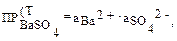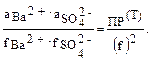Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Произведение растворимости (ПР, Ks )
Одним из основных аналитических эффектов химических реакций является образование осадков. Осадки, особенно если они окрашены, легко фиксируются визуально. Многие реакции, которые сопровождаются образованием осадка, используются в качественном анализе для разделения катионов на аналитические группы, а также для обнаружения отдельных ионов. Реакции осаждения широко применяются в титриметрическом анализе. Классический гравиметрический метод анализа основан на реакциях образования малорастворимых соединений. Осадительные аналитические реакции проводят в таких условиях, которые обеспечивают наибольшую полноту осаждения и содержат минимальное количество примесей посторонних веществ. Для большинства веществ существует определенный предел растворения, при достижении которого вещество перестает растворяться. Такие растворы называют насыщенными. Насыщенный раствор является гетерогенной системой, поскольку равновесие устанавливается на границе раздела фаз. В насыщенном растворе растворенное вещество находится в равновесии со своей твердой фазой. Концентрацию вещества в его насыщенном растворе называют растворимостью данного вещества (S). Различают: — массовую растворимость вещества (Sm), которая показывает массу растворенного вещества в 1 литре его насыщенного раствора: Sm = m/V (г/л); — молярную растворимость (Sm), которая показывает количество растворенного вещества в 1 литре его насыщенного раствора: SМ = n/V (моль/л). Осадок с раствором образуют гетерогенную систему: BaSO4 ↔ Ba2+ + SO42– осадок ↔ раствор К данному состоянию равновесия можно применить закон действия масс:
Произведением растворимости (ПР) называют произведение концентрации ионов данного малорастворимого электролита в его насыщенном растворе при данной температуре. Произведение растворимости характеризует молярную растворимость электролита. Величины произведений растворимости для некоторых малорастворимых электролитов приведены в Приложении (табл. 3).
Для двухионного электролита: BaSO4 ↔ Ba2+ + SO42– х х х Из х моль BaSO4 образуется х моль Ba2+ и х моль SO42–, тогда
Для трехионного электролита:
Ag2CrO4 ↔ 2Ag+ + CrO42– х 2х х
Обратите внимание, что в произведении растворимости концентрации ионов выводятся в степени, равных стехиометрическим коэффициентам в уравнении реакции диссоциации.
x = [CrO42–] = Аналогично выводятся расчетные формулы для четырех- и пятиионных электролитов: х = x = Растворимость малорастворимых соединений можно сравнивать как по величине растворимости (S), так и по произведению растворимости (ПР) для однотипных электролитов. Чем больше величина ПР, тем больше ионов находится в растворе и тем больше растворимость данного электролита. ПРAgCl = 1,8 · 10–10 ПРAgBr = 5,3 · 10–13 ПРAgJ = 8,3 · 10–17
Растворимость веществ увеличивается, если в растворе малорастворимого соединения присутствуют ионы посторонних сильных электролитов, которые создают ионное взаимодействие, то это взаимодействие следует учитывать. Зная связь концентрации с активностью ионов, можно записать выражение произведения растворимости для насыщенного раствора сульфата бария:
Различают термодинамическую величину произведения растворимости ПР(Т) и концентрационную ПР(К) ПР(Т) = f (p, t), µ = 0 — это табличная величина. Произведение растворимости, выраженное через равновесные концентрации, называют концентрационным: ПР(К) = f(p, t, µ). Эта величина зависит не только от t и р, но и от ионной силы раствора. Для бинарного электролита, например BaSO4: ПР(К) = [Ba2+][SO42–] = При небольшой величине ионной силы и приближенных расчетах нередко приравнивают величины ПР(Т) = ПР(К), используя табличное значение произведения растворимости.
Решение типовых задач
|
|||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 111; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.190.93 (0.006 с.) |
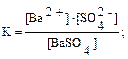 K[BaSO4] = [Ba2+]∙[SO42–],
K[BaSO4] = [Ba2+]∙[SO42–], = [Ba2+]∙[SO42–].
= [Ba2+]∙[SO42–]. = [Ba2+][SO42–] = х2 и х = [Ba2+][SO42–] =
= [Ba2+][SO42–] = х2 и х = [Ba2+][SO42–] = 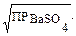 (I)
(I)
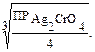 (II)
(II) (III)
(III) (IV)
(IV)