
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
III . Влияние добавок сильного электролита с одноименным ионом на растворимость малорастворимых электролитов.Содержание книги
Поиск на нашем сайте Пример 4. Сравните растворимость СаСО3 в воде и в 0,01М растворе (NH4)2CO3. ПР СаСО3 = 4,80 · 10–9. Решение: 1. Растворимость СаСО3 в воде: S1 СаСО3 = 2. Растворимость СаСО3 в присутствии электролита карбоната аммония, который имеет одноименный ион с осадком, определяется концентрацией карбонат-ионов в растворе: (NH4)2CO3 → CO32– + 2NH4+ 0,01 моль/л → 0,01 моль/л S2 = [Ca2+] =
Растворимость малорастворимых электролитов понижается при введении в их раствор сильных электролитов с одноименным ионом. Одноименный ион оказывает более значительное влияние на растворимость соединения, чем ионная сила раствора.
IV. Условия образования и растворения осадков.
Свойство насыщенного раствора сохранять постоянным произведение активностей (концентраций) ионов в соответствующих степенях называют правилом произведения растворимости.
Следствия из правила произведения растворимости:
I. Для насыщенного раствора всегда соблюдается равенство: величина произведения растворимости равна произведению концентраций ионов (ПКИ), т. е. ПР ВаSO4 = [Ba2+][SO42–]. II. Если произведение концентрацией ионов превышает величину ПР, то осадок образуется: ПР ВаSO4 < [Ba2+][SO42–]. III. Если произведение концентраций ионов меньше величины произведения растворимости, то образование осадка не происходит: ПР ВаSO4 > [Ba2+][SO42–].
Пример 5. Образуется ли осадок хлорида свинца (II), если смешать равные объемы растворов 0,1М Pb(NO3)2 и 0,1М КСl? ПР PbCl2 = 1,6 · 10–5. Решение: Pb(NO3)2 + 2КСl = PbCl2 + 2К NO3 После смешивания равных объемов растворов их концентрация уменьшилась в 2 раза: [Pb2+] = 0,1/2 = 0,05 моль/л; [Cl–] = 0,1/2 = 0,05 моль/л. Произведение концентраций ионов (ПКИ) равно: [Pb2+][Cl–]2 = 5 · 10–2 · (5 · 10–2)2 = 1,25 · 10–4. Поскольку ПКИ (1,25 · 10–4) превышает величину ПР (1,6 · 10–5), то осадок образуется. Растворение соединения, т. е. переход вещества из твердого состояния в раствор, будет происходить до тех пор, пока произведение концентраций ионов в соответствующих степенях не станет равным произведению растворимости.
Пример 6. Рассчитайте рН осаждения гидроксида магния из 0,01М раствора сульфата магния.
Решение:
[OH–] = Содержание ионов магния в растворе определяется концентрацией сульфата магния: MgSO4 → Mg2+ + SO42– 0,01 моль/л → 0,01 моль/л Тогда: [OH–] = рОН = –lg[OH–] = –lg 2,45 · 10–4 = 3,61. рН – 14 – 3,61 = 10,39. Для растворения осадка необходимо, чтобы произведение концентраций ионов стало меньше величины произведения растворимости. Это достигается снижением концентрации ионов в растворе над осадком. Уменьшение концентрации ионов в растворе может быть осуществлено: 1) сильным разбавлением; 2) связыванием ионов осадка в слабодиссоциирующее соединение; 3) связыванием ионов осадка в комплексное соединение; 4) Окислением или восстановлением ионов.
|
||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 479; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.007 с.) |

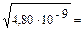 7,0 · 10–5 моль/л.
7,0 · 10–5 моль/л. 4,8 · 10–7 моль/л.
4,8 · 10–7 моль/л.
 = 6,0 · 10–10.
= 6,0 · 10–10.
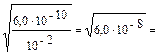 2,45 · 10–4 моль/л.
2,45 · 10–4 моль/л.


