
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Количественные характеристики буферных растворов
Количественными характеристиками буферных растворов являются рН буферного раствора и буферная емкость. Выведем уравнение для расчета рН на примере ацетатной буферной системы. В растворе рассматриваемой буферной системы протекают процессы: CH3COOH + H2O ↔ CH3COO– + Н3О+; CH3COONa → CH3COO– + Na+. Концентрацию ионов водорода данной буферной смеси можно определить из уравнения константы диссоциации слабого электролита:
Присутствие в растворе соли, которая является источником ацетат-анионов, подавляет диссоциацию слабой кислоты. В этом случае уксусная кислота присутствует в растворе в молекулярной форме и равновесная концентрация кислоты близка к ее исходной концентрации. Основным источником ацетат-анионов в растворе является соль. Принимая во внимание эти условия, можно записать:
[H+] = Ka рН = –lgKa – lg
–lgKa = рКа; рН = рКа – lg Из уравнения следует, что рН кислотного буферного раствора определяется значением Ка кислоты и концентрациями кислоты и соли. Концентрации компонентов буферной смеси могут быть выражены разными способами: молярной концентрацией, молярной концентрацией эквивалента, количеством вещества, количеством эквивалента вещества. Для основной буферной системы: [OH–] = Kв рОН = рКв –lg рН = 14 – рОН = 14 – рКв + lg рН основного буферного раствора определяется значением Кв основания и концентрациями основания и соли. Способность буферных растворов сохранять определенное значение рН при добавлении сильной кислоты или щелочи зависит от состава буферной смеси и концентрации ее компонентов. Для количественной характеристики этой сопротивляемости буферных растворов к добавлению сильных кислот и оснований введено понятие буферная емкость. Количество молей сильной кислоты или щелочи, которое нужно добавить к одному литру буферного раствора, чтобы значение рН его изменилось на единицу, называют буферной емкостью. Чем больше концентрация компонентов буферной смеси, тем устойчивее величина их соотношения и тем выше буферная емкость. Различают буферную емкость по слабой кислоте и основанию, которая рассчитывается по уравнению
Ва — буферная емкость по кислоте; Сэ — молярная концентрация эквивалента сильной кислоты [моль/л];
V кислоты — объем сильной кислоты; V б.р. — исходный объем буферного раствора; ∆рН — изменение рН, вызванное добавлением сильной кислоты. Аналогично записывается уравнение расчета буферной емкости по основанию: Вв = Защитные свойства буферной системы будут сохраняться до тех пор, пока концентрации компонентов буферной системы будут больше концентрации добавляемых ионов.
Решение типовых задач Пример 1. В 250 мл 0,10М раствора уксусной кислоты растворено 1,025 г ацетата натрия. Вычислите рН буферной системы. Ка = 1,74 · 10–5.
Решение: 1. рН буферной смеси рассчитаем по формуле: рН = рКа – lg 3. Рассчитаем молярную концентрацию соли: См = См = 4. рН = 4,76 – 0,30 = 4,46.
Пример 2. Вычислите рН раствора, полученного путем смешивания 20,0 мл 0,05М раствора азотистой кислоты и 30,0 мл 1,5М раствора нитрита натрия. Кα = 6,9 · 10–4. Как изменится рН при разбавлении буферного раствора в 10 раз? Решение: 1. Рассчитаем молярные концентрации компонентов буферной смеси при сливании разных объемов азотистой кислоты и нитрита натрия. Объем буферной смеси станет равным: V1 + V2 = 50,0 мл, соответственно, концентрации кислоты и соли будут:
Отсюда видно, что отношение концентраций, стоящее под знаком логарифма 2. Рассчитаем рН: рН = рКα – lg 3. Рассмотрим, как изменится рН буферного раствора при разбавлении его в 10 раз. При разбавлении буферного раствора количество веществ не меняется и, следовательно, рН не изменяется.
Пример 3. К 10,0 мл 0,10М раствора уксусной кислоты добавили 5,0 мл 0,05М раствора гидроксида натрия. Чему равен рН полученного раствора? Решение: 1. При смешивании двух растворов протекает реакция: СН3СООН + NaОH → СН3СООNa + Н2О; СН3СООН + ОH– → СН3СОО– + Н2О и образуется ацетатный буферный раствор. 2. Рассчитаем количество кислоты и щелочи до смешивания растворов: n NaOH =
Количество соли (СН3СООNa), образовавшейся в результате реакции, равно количеству добавленной щелочи: nNaOH = Слабый протолит уксусная кислота находится в избытке, ее количество определяется вычитанием количества кислоты, вступившей в реакцию, от количества кислоты до реакции:
n (CH3COOH) = 0,001 – 0,00025 — 0,00075 моль. 3. рН данного буферного раствора рассчитаем согласно уравнению: рН = рКа – lg Пример 4. Сколько граммов ацетата натрия необходимо добавить к 100 мл 0,10М раствора уксусной кислоты, чтобы рН стал равен 4,00? Решение: 1. Запишем протолитическое равновесие данной системы CH3COOH + Н2О ↔ СН3СОО– + Н3О+. CH3COONa → CH3COO - + Na+ 2. рН буферного раствора рассчитываем по уравнению: рН = – lg Ка – lg 3. Выразим молярную концентрацию уксусной кислоты через количества вещества: n = CV следовательно рН = – lg Ка – lg рН = – lg Ка – lg 4,00 = 4,76 – lg nС = 10–2,76 = 0,0017 моль, mС = nM = 0,0017 · 82 = 0,142 г.
Пример 5. Как изменится рН аммонийной буферной системы, содержащей по 0,10 моль аммиака и хлорида аммония в литре раствора, если прибавлено: а) 0,02 моль HCl; б) 0,02 моль NaOH? Решение: 1. Для расчета рН исходного раствора аммиачного буфера воспользуемся формулой рН = 14 – рКв + lg pH = 14 – 4,76 + lg рН исходного раствора аммиачного буфера равен 9,24. а) К исходной буферной смеси добавили 0,02 моль соляной кислоты. Согласно механизму действия буферной системы количество аммиака уменьшится (NH3 + HCl = NH4Cl): n (NH3)= 0,10 – 0,02 = 0,08 моль, а количество соли увеличится: n (NH4Cl)= 0,10 + 0,02 = 0,12 моль. Изменится соотношение компонентов буферной системы и рН изменится: рН = 14 – 4,76 + lg б) К исходной буферной смеси добавили 0,02 моль гидроксида натрия. В системе увеличивается концентрация слабого протолита (аммиака): NH4+ + OH– ↔ NH3 + H2O, n (NH3) = 0,10 + 0,02 = 0,12 моль, а концентрация соли уменьшится: n (NH4Cl) = 0,10 – 0,02 = 0,08 моль, рН = 14 – 4,76 + lg Пример 6. Вычислите объемы растворов гидрофосфата и дигидрофосфата натрия с концентрацией солей 0,15 моль/л для приготовления буферного раствора объемом 1 л с рН = 7,00. Решение: В растворе фосфатной буферной смеси (NaH2PO4 + Na2HPO4) диссоциация ее компонентов протекает по уравнениям: NaH2PO4 → Na+ + H2PO4–; Na 2HPO4 → 2Na+ + HPO42–. Ион H2PO4– диссоциирует как слабая кислота H2PO4– ↔ Н+ + HPO42–. Диссоциация иона HPO42– крайне незначительна (KII > KIII), следовательно, NaH2PO4 играет роль кислоты, а Na2HPO4 — ее соли. 1. Запишем протолитическое равновесие H2PO4– + H2O ↔ Н3О+ + НРО42–. 2. Найдем соотношение концентраций компонентов в буферном растворе, который надо приготовить: рН = рКII – lg Обозначим объем раствора гидрофосфата натрия через х л, тогда объем раствора дигидрофосфата натрия (1 – х) л. Так как количества этих веществ находятся в одном и том же объеме, отношение концентраций можно заменить отношением количеств веществ: 7,00 = 7,21 – lg х = 0,38 л, то есть V(Na2HPO4) = 0,38 л; V(NaH2PO4) = 0,62 л.
Пример 7. Имеется раствор, содержащий уксусную кислоту, и ацетат натрия в соотношении 3:1. Чему будет равно соотношение кислоты и соли при изменении рН на единицу? Ka (CH3COOH) = 1,74 · 10–5. Решение: 1. Рассчитаем рН исходного раствора по уравнению: рН = рКа – lg 2. При значении рН = 3,28 соотношение кислоты и соли рассчитываем: 3,28 = 4,76 – lg следовательно 3. Если значение рН увеличилось до 5,28, то соотношение кислоты и соли становится: 5,28 = 4,76 – lg Таким образом, при изменении рН на ± 1 соотношение компонентом изменится с 3:1 до 30:1 и 1:3 соответственно.
Пример 8. Буферная емкость раствора по кислоте равна 0,04 моль/л. Вычислите, какой объем раствора серной кислоты с молярной концентрацией 0,20 моль/л можно добавить к 150 мл этого раствора, чтобы сместить рН не более чем на 0,50 единицы? Решение: Буферную емкость по кислоте рассчитывают по формуле:
Необходимо перевести молярную концентрацию в молярную концентрацию эквивалента Рассчитаем молярную концентрацию эквивалента серной кислоты. Фактор эквивалента (fэ) H2SO4 равен ½.
Сэ(H2SO4) = 2 · 0,20 = 0,40 моль/л.
Тогда 0,04 = V(H2SO4) = Контрольные вопросы 1. Дайте определение буферной системе. 2. Какие существуют способы приготовления буферных растворов? 3. Какие из перечисленных веществ и в каких сочетаниях можно взять для приготовления буферных растворов: аммиак, уксусная кислота, соляная кислота, гидроксид калия, дигидрофосфат натрия, хлорид натрия, сульфат калия, гидрофосфат калия? 4. Приведите примеры буферных систем, имеющих рН > 7 и рН < 7. Укажите сопряженные протолитические пары в этих растворах. 5. Перечислите факторы, от которых зависит рН буферного раствора. 6. рН раствора необходимо поддерживать приблизительно 6,5. Какую буферную систему следует для этого выбрать: а) ацетатную; б) фосфатную; в) аммиачную? 7. Что называется буферной емкостью раствора? От каких факторов зависит буферная емкость? 8. Почему прибавление небольшого количества HNО3 к аммиачной буферной смеси не вызовет значительного изменения рН раствора? 9. Почему прибавление небольшого количества щелочи не вызовет изменения рН фосфатной буферной смеси?
Задачи для самостоятельного решения 1. Вычислите рН буферных смесей, полученных при сливании равных объемов 0,01М растворов НАс и NaAc; 0,01М раствора НАс и 0,02М раствора NaAc; 0,02М раствора НАс и 0,01М раствора NaAc. 2. Вычислите рН формиатной буферной смеси, в литре которой содержится 0,50 моль НСООН и 0,40 моль НСООК. Как изменится рН, если к 1 литру этого раствора прибавить 0,10 моль НС1? 3. Вычислите рН аммиачной буферной смеси, содержащей равное число молей NH3 и NH4CI. Как изменится рН при разбавлении раствора в 2 раза? 4. Вычислите массу хлорида аммония, которую следует добавить к раствору аммиака с концентрацией 0,137 моль/л и объемом 2,0 л, чтобы получить буферный раствор с рН = 10,34. 5. Имеется 100,0 мл раствора уксусной кислоты, в котором степень ее диссоциации равна 1,90 %. Вычислите массу ацетата калия, которую следует добавить в этот раствор для получения буферного раствора с рН = 4,00.
6. Вычислите, какие объемы растворов формиата натрия с концентрацией 0,20 моль/л и муравьиной кислоты с концентрацией 0,30 моль/л необходимо взять для приготовления буферного раствора объемом 250,0 мл с рН = 4,25. 7. Вычислите, какой объем раствора хлорида аммония с концентрацией 0,20 моль/л и объем раствора аммиака с концентрацией 0,30 моль/л необходимы для приготовления буферного раствора объемом 300,0 мл с рН = 9,50. 8. Вычислите массу ацетата натрия, которую следует добавить к 2 л раствора с концентрацией уксусной кислоты 0,316 моль, чтобы получить буферный раствор с рН = 4,87 (изменением объема пренебречь). 9. Ацетат натрия массой 16,40 г растворили в дистиллированной воде, объем полученного раствора при этом составил 0,20 л. Уксусную кислоту массой 12,00 г растворили в дистиллированной воде, и объем полученного раствора довели до 0,50 л. В каком объемном соотношении смешали два эти раствора, если образовавшийся буферный раствор имеет рН = 4,75? 10. Как изменится рН фосфатного буферного раствора, содержащего 100,0 мл раствора дигидрофосфата натрия и 300,0 мл раствора гидрофосфата натрия (концентрации исходных растворов равны по 0,10 моль/л), при добавлении к нему 20,0 мл раствора NaOH с концентрацией 0,10 моль/л? 11. Буферные растворы приготовлены смешением растворов:
Расположите буферные растфоры в порядке убывания их буферной емкости. Ответ подтвердите расчетом. 12. Вычислите рН раствора, полученного смешением 5,00 мл раствора дигидрофосфата натрия с концентрацией 0,20 моль/л и 10,00 мл раствора гидроксида натрия с концентрацией 0,20 моль/л. 13. Вычислите рН раствора, полученного смешением 5,00 мл раствора гидрофосфата натрия с концентрацией 0,20 моль/л и 10,00 мл раствора соляной кислоты с концентрацией 0,02 моль/л. 14. К раствору, содержащему ацетат натрия массой 16,40 г, добавили 50,0 мл соляной кислоты с концентрацией хлороводорода 1,00 моль/л. Объем полученного раствора довели дистиллированной водой до 1 л. Вычислите рН конечного раствора. 15. Какие из перечисленных растворов обладают буферным действием? Ответ подтвердите расчетом и рассчитайте рН полученного буферного раствора.
16. Какие из перечисленных растворов обладают буферным действием? Ответ подтвердите расчетом и рассчитайте рН полученного буферного раствора.
Гидролиз солей
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 824; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.152.98 (0.052 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
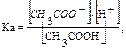 откуда [H+] = Ka
откуда [H+] = Ka 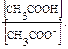 ?
?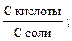
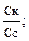
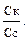
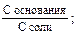
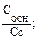
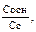
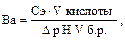 где
где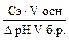
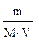 [моль/л];
[моль/л];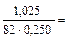 0,05 моль/л.
0,05 моль/л.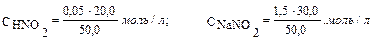
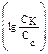 , можно заменить на отношение количеств веществ
, можно заменить на отношение количеств веществ 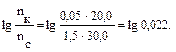
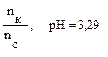 – lg 0,022 = 4,94.
– lg 0,022 = 4,94.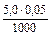 = 0,00025 моль/л;
= 0,00025 моль/л;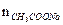 =
= 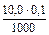 = 0,001 моль.
= 0,001 моль.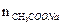 = 0,00025 моль.
= 0,00025 моль.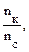 pH = 4,76 – lg
pH = 4,76 – lg 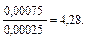
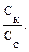
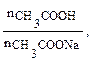
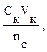
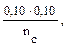 –0,76 = – lg
–0,76 = – lg 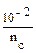 отсюда
отсюда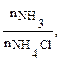
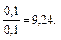
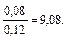
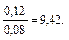
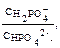 где рКII = 7,21.
где рКII = 7,21. 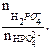 lg
lg 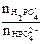 = lg
= lg 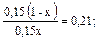
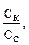 pH = 4,76 – lg
pH = 4,76 – lg 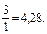
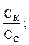 отсюда lg
отсюда lg 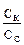 = 1,48,
= 1,48,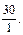
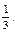
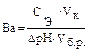
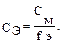
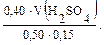
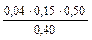 = 0,0074 л = 7,50 мл.
= 0,0074 л = 7,50 мл.


