
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Раздел №2 молекулярная физика и термодинамика
Основные формулы (справочный материал) Количество вещества где N – число молекул; N A – число Авогадро; т – масса вещества; М – молярная масса. Уравнение Клапейрона-Менделеева где р – давление газа; V – его объём; R – универсальная газовая постоянная; Т – термодинамическая температура. Основное уравнение молекулярно-кинетической теории где Средняя энергия молекулы где i – число степеней свободы; k – постоянная Больцмана. Внутренняя энергия идеального газа Скорости молекул: средняя квадратичная средняя арифметическая наиболее вероятная Средняя длина свободного пробега молекулы где d – эффективный диаметр молекулы. Среднее число столкновений молекулы за единицу времени
Распределение молекул в потенциальном силовом поле где Барометрическая формула Уравнение диффузии где D – коэффициент диффузии; r – плотность; dS – элементарная площадка, перпендикулярная оси ОХ.
Уравнение теплопроводности где k – коэффициент теплопроводности. Сила внутреннего трения где h – динамическая вязкость. Коэффициент диффузии Вязкость (динамическая) Теплопроводность где с V – удельная изохорная теплоемкость.
Молярная теплоемкость идеального газа: изохорная
изобарная Первый закон термодинамики Работа расширения газа при процессе: изобарном изотермическом адиабатическом где
Уравнения Пуассона
Коэффициент полезного действия цикла Карно где Q 1 и Т 1 – количество теплоты, полученное от нагревателя и его температура; Q 2 и Т 2 – количество теплоты, переданное холодильнику и его температура.
Изменение энтропии при переходе из состояния 1 в состояние 2
Примеры решения контрольных задач
1. В сосуде объемом 2 м3 находится смесь из 4 кг гелия и 2 кг водорода при температуре 27 °С. Определить давление и молярную массу смеси газов. Дано: V = 2 м3, m 1 = 4 кг, M 1 = 4 · 10-3 кг/моль, m 2 = 2 кг, М 2 = 2 · 10‑3 кг/моль, T = 300 К. Найти: Р; М. Решение. Воспользуемся уравнением Клапейрона - Менделеева, применив его к гелию и водороду: p1V = m1RT/M1; (1) p1V = m2RT/M2, (2) где p 1 – парциальное давление гелия; m 1 – масса гелия; M 1 –его молярная масса; V – объем сосуда; Т – температура газа; R = 8,31 Дж/(моль·К) – молярная газовая постоянная; р 2 – парциальное давление водорода; m 2 – масса водорода; M 2 – его молярная масса. Под парциальным давлением р 1 и р 2понимается то давление, которое производил бы газ, если бы он только один находился в сосуде. По закону Дальтона давление смеси равно сумме парциальных давлений газов, входящих в состав смеси:
Из уравнения (1) и (2) выразим р 1 и р 2 и подставим в уравнение (3). Тогда Молярную массу смеси газов найдем по формуле
где v 1 и v 2 – число молей гелия и водорода соответственно. Число молей газов определим по формулам: v 1 = m 1/ M 1; v 2 = m 2/ M 2. Подставив это в (5), найдем
Подставив числовые значения в формулы (4) и (6), получим
Ответ: р = 2,49×106 Па = 2,49 МПа; М = 3 · 10 – 3 кг/моль. 2. Чему равны средние кинетические энергии поступательного и вращательного движения молекул, содержащихся в 2 кг водорода при температуре 400 К? Дано: m = 2 кг, T = 400 К, М = 2·10-3 кг/моль. Найти: < ε пост>; < ε вр>. Решение. Считаем водород идеальным газом. Молекула водорода – двухатомная, связь между атомами считаем жесткой. Тогда число степеней свободы молекулы водорода i = 5. В среднем на одну степень свободы приходится энергия < ε i> = kT /2, где k – постоянная Больцмана; Т - термодинамическая температура. Поступательному движению приписывается три (i = 3), а вращательному две (i = 2) степени свободы. Тогда энергия соответствующего движения одной молекулы
Число молекул, содержащихся в массе газа,
где v – число молей; NA – постоянная Авогадро. Тогда средняя кинетическая энергия поступательного движения молекул водорода
где R = kNA – газовая постоянная. Средняя кинетическая энергия вращательного движения молекул водорода
Подставив числовые значения в формулы (1) и (2), получим
Ответ: < ε пост> = 4,98 МДж, < ε вр> = 3,32 МДж.
3. Вычислить удельные теплоемкости водорода при постоянном объеме cV и при постоянном давлении cP, считая газ идеальным. Решение. Удельные теплоемкости идеальных газов выражаются формулами
где i – число степеней свободы молекулы газа, водород – двухатомный газ, поэтому для него i =5, М =0,002 кг/моль – молярная масса водорода. Произведем вычисления:
Ответ: с V =10,4 кДж/(кг·К), с P =14,6 кДж/(кг·К).
4. Определить коэффициенты диффузии и внутреннего тренияазота, находящегося при температуре 300 К и давлении 105Па. Дано: r 0 = 1,25 кг/м3, М = 28·10-3 кг/моль, Т = 300 К, р = 105 Па, d = 3,l·10‑10 м. Найти: D; h. Решение. Коэффициент диффузии определяется по формуле
где
С учетом того, что давление p = nkT, получим
Подставив (2) и (3) в выражение (1), получим
Коэффициент внутреннего трения
где r - плотность газа. Для нахождения r воспользуемся уравнением состояния идеального газа. Запишем его при нормальных условиях: Т 0 = 273 К, р = 1,01 · 10s Па, и для состояния в условии задачи:
Учитывая, что r 0 = m/Vo, r = m/V, получим
Коэффициент внутреннего трения газа может быть выражен через коэффициент диффузии (см. формулы (1) и (5)):
Подставив числовые значения в (4) и (8), получим
Ответ: D = 4,7 · 10-5 м2/с, h = 5,23 · 10-5 кг/(м · с). 5. Кислород массой 160 г нагревают при постоянном давлении от 320 до 340 К. Определить количество теплоты, поглощенное газом, изменение внутренней энергии и работу расширения газа. Дано: m = 160 г = 16 · 10-2 кг, T 1 = 320 К, T 2 = 340К. Найти: Q, D U; A. Решение. Количество теплоты, необходимое для нагревания газа при постоянном давлении, Q = mcp(T2-T1) = (m/M)Cp(T2-T1). (1) Здесь ср и Cp = Mcp – удельная и молярная теплоемкости газа при постоянном давлении; М = 32 · 10-3 кг/моль – молярная масса кислорода. Для всех двухатомных газов С p = 7/2 · R; С p = 3,5 · 8,31 Дж/(моль · К) = 29 Дж/(моль · К). Изменение внутренней энергии газа находим по формуле
где С v – молярная теплоемкость газа при постоянном объеме. Для двухатомных газов C v = 5/2 R; C v = 2,5·8,31 Дж/(моль · К) = 20,8 Дж/(моль · К). Работа расширения газа при изобарном процессе А = p· D V, гдеизменение объема газа D V = V2 –V1 можно найти из уравнения Клапейрона-Менделеева. При изобарном процессе pV1 = (m/M)RT1; (3) pV 2 = (m / M) RT 2. (4) Почленным вычитанием выражения (4) из (3) находим p (V 2 - V 1) = (m / M) R (T 2 – T 1), следовательно, A=(m/M)R(T2 –T1). (5) Подставив числовые значения в формулы (1), (2) и (5), получим
Ответ: Q = 2900 Дж; D U = 2080 Дж; А = 840 Дж.
6. Температура нагревателя тепловой машины 500 К. Температура холодильника 400 К. Определить КПД тепловой машины, работающей по циклу Карно, и полную мощность машины, если нагреватель ежесекундно передает ей 1675 Дж теплоты. Дано: Т 1 = 500 К, Т 2 = 400 К, Q 1 = 1675Дж. Найти: h, N. Решение. Коэффициент полезного действия машины определяется по формуле h = (Т1 – Т 2)/ Т 1 (1) или h = А / Q. (2) Из выражений (2) и (1) находим
Произведем вычисления:
Эта работа совершается за 1 с, следовательно, полная мощность машины 335 Вт. Ответ: h = 0,2; N = 335 Вт. Задачи для контроля самостоятельной работы по Разделу № 2
2.1. В баллоне объемом V = 15 л находится аргон под давлением p1 = 600 кПа и температуре Т1 = 300 К. Когда из баллона было взято некоторое количество аргона, давление в баллоне понизилось до p2 = 400 кПа, а температура установилась Т2 = 260 К. Определить массу m аргона, взятого из баллона.
2.2. Вычислить плотность r азота, находящегося в баллоне под давлением p = 2 МПа при температуре Т = 400 К. 2.3. Определить относительную молекулярную массу М газа, если при температуре Т = 221 К и давлении Р = 2,8 МПа он имеет плотность r = 6,1 кг/м3. 2.4. В баллоне емкостью V = 50 л находится сжатый водород при температуре t = 27 °С. После того как часть воздуха выпустили, давление понизилось на D p = 105 Па. Определить массу выпущенного водорода. Процесс считать изотермическим. 2.5. В сосуде, имеющем форму шара, радиус которого R = 0,1 м, находится азот массой т = 56 г. До какой температуры можно нагреть сосуд, если его стенки выдерживают давление р = 5×105 Па? 2.6. При температуре Т = 300 К и давлении р = 1,2×105 Па плотность смеси водорода и азота r = 1 кг/м3. Определить молярную массу смеси. 2.7. В баллоне емкостью V = 0,8 м3 находится m1 = 2 кг водорода и m2 = 2,9 кг азота. Определить давление смеси, если температура окружающей среды t = 27 °С. 2.8. До какой температуры можно нагреть запаянный сосуд, содержащий m = 36 г воды, чтобы он не разорвался, если известно, что стенки сосуда выдерживают давление p = 5×106 Па? Объем сосуда V = 0,5 л. 2.9. При температуре t = 27 °С и давлении p = 106 Па плотность смеси кислорода и азота r = 15 г/дм3. Определить молярную массу смеси. 2.10. В баллоне емкостью V = 24 л находится водород при температуре t = 17°С. После того, как часть водорода израсходовали, давление в баллоне уменьшилось на D р = 4,05×105 Па. Какое количество водорода было израсходовано, если процесс изотермический? 2.11. Определить суммарную кинетическую энергию Ек поступательного движения всех молекул газа, находящегося в сосуде объемом V = 3 л под давлением Р = 540 кПа. 2.12. Количество вещества гелия n = 1,5 моля, температура Т = 120 К. Определить суммарную кинетическую энергию поступательного движения всех молекул этого газа. 2.13. Молярная внутренняя энергия U некоторого двухатомного газа равна 6,02 кДж. Определить среднюю кинетическую энергию вращательного движения одной молекулы этого газа. Газ считать идеальным. 2.14. Определить среднюю кинетическую энергию одной молекулы водяного пара при температуре Т = 500 К. 2.15. Определить среднюю квадратичную скорость молекулы газа, заключенного в сосуде объемом V = 2 л под давлением Р = 200 кПа. Масса газа m = 0,3 г. 2.16. Водород находится при температуре Т = 300 К. Найти среднюю кинетическую энергию вращательного движения одной молекулы, а также суммарную кинетическую энергию всех молекул этого газа. Количество вещества водорода n = 0,5 моль. 2.17. При какой температуре средняя кинетическая энергия поступательного движения молекулы газа равна 4,14х10-21 Дж? 2.18. Найти среднюю кинетическую энергию вращательного движения молекул, содержащихся в т = 0,20 г водорода при температуре t = 27 °С. 2.19. Давление идеального газа p = 10 мПа, концентрация молекул n = 8×1010 см-3. Определить среднюю кинетическую энергию поступательного движения одной молекулы и температуру газа. 2.20. Определить среднее значение полной кинетической энергии одной молекулы аргона и водяного пара при температуре T = 500 К.
2.21. Определить показатель адиабаты g идеального газа, который при температуре Т = 350 К и давлении Р = 0,4 МПа занимает объем V = 300 л и имеет теплоемкость при постоянном объеме CV= 857 Дж/К. 2.22. Определить относительную молекулярную массу Мr и молярную массу M газа, если разность его удельных теплоемкостей СP-СV = 2,08кДж/(кг×К). 2.23. В сосуде объемом V = 6 л находится при нормальных условиях двухатомный газ. Определить теплоемкость CV этого газа при постоянном объеме. 2.24. Определить молярные теплоемкости газа, если его удельные теплоемкость СV = 10,4 кДж/(кг×К), СP = 14,6 кДж/ (кг×К). 2.25. Найти удельные cV и cP и молярные СV и СP теплоемкости азота и гелия. 2.26. Вычислить удельные теплоемкости газа при постоянном объеме и постоянном давлении, зная, что его молярная масса М = 4×10-3 кг/моль и отношение теплоемкостей СP/CV=1,67. 2.27. Трехатомный газ под давлением Р = 240 кПа и температуре t = 20°С занимает объем V =10 л. Определить теплоемкость Ср этого газа при постоянном давлении. 2.28. Относительная молекулярная масса газа Мr = 30, показатель адиабаты g = 1,40. Вычислить удельные теплоемкости СV и СP и этого газа. 2.29. Определить, какое количество теплоты необходимо сообщить аргону массой т = 400 г, чтобы нагреть его на D Т = 100 К: а) при постоянном объеме; б) при постоянном давлении. 2.30. Определить, какое количество теплоты необходимо сообщить кислороду массой т = 500 г, чтобы нагреть его на D Т = 10 К: а) при постоянном объеме; б) при постоянном давлении. 2.31. В сосуде емкостью V = 1 л содержится кислород массой m = 32 г. Определить среднее число соударений молекул в секунду при температуре T = 100 К. 2.32. Определить среднюю длину и среднюю продолжительность свободного пробега молекул углекислого газа при температуре T = 400 К и давлении p = 1,38 Па. 2.33. В сосуде емкостью V = 1 л находится m = 4,4 г углекислого газа. Определить среднюю длину свободного пробега молекул. 2.34. Определить коэффициент диффузии гелия при давлении p = 106 Па и температуре t = 27 °С. 2.35. Определить коэффициент внутреннего трения кислорода при температуре T = 400 К. 2.36. В сосуде емкостью V = 5 л содержится m = 40 г аргона. Определить среднее число соударений молекул в секунду при температуре T = 400 К. 2.37. Определить коэффициент внутреннего трения воздуха при температуре T = 100 К. 2.38. Определить коэффициент диффузии азота при давлении p = 0,5×105 Па и температуре t = 127 °С. 2.39. Для кислорода при нормальных условиях динамическая вязкость h = 1,9×10 – 4 Па×с. Определить коэффициент теплопроводности кислорода. 2.40. Для водорода при нормальных условиях коэффициент диффузии D = 9,1×10 – 5 м2/с. Определить коэффициент теплопроводности водорода. 2.41.Во сколько раз увеличится объем n = 2 молей кислорода при изотермическом расширении при температуре Т = 300 К, если при этом газу сообщили теплоту Q = 4 кДж. 2.42. Какое количество теплоты нужно сообщить n = 2 молям воздуха, чтобы он совершил работу А = 1000 Дж: а) при изотермическом процессе; б) при изобарическом процессе. 2.43. Найти работу и изменение внутренней энергии при адиабатном расширении т = 28 г азота, если его объем увеличился в два раза. Начальная температура азота t = 27 °С. 2.44. Кислород, занимающий объем V 1 = 10 л и находящийся под давлением р = 2×105 Па, адиабатно сжат до объема V 2 = 2 л. Найти работу сжатия и изменение внутренней энергии кислорода. 2.45. Определить количество теплоты, сообщенное т = 88 г углекислого газа, если он был изобарически нагрет от Т1 = 300 К до Т2 = 350 К. Какую работу при этом совершил газ и как изменилась его внутренняя энергия? 2.46. Объем водорода при изотермическом расширении увеличился в n = 3 раза. Определить работу А, совершенную газом, и теплоту Q, полученную им при этом. Масса m водорода равна 200 г, температура t = 27oC. 2.47. Водород массой m = 40 г, имевший температуру Т1 = 300 К, адиабатически расширился, увеличив объем в n1 = 3 раза. Затем при изотермическом сжатии объем газа уменьшился в n2 = 2 раза. Определить полную работу А, совершенную газом, и конечную температуру Т2 газа. 2.48. При изобарном нагревании азоту массой т = 20 г сообщили теплоту Q = 3116 Дж. На сколько изменились температура и внутренняя энергия газа? 2.49. При изотермическом расширении одного моля водорода была затрачена теплота Q = 4 кДж, при этом объем водорода увеличился в пять раз. При какой температуре протекал процесс? Чему равно изменение внутренней энергии газа, какую работу совершил газ? 2.50. Во сколько раз увеличится объем водорода, содержащий количество вещества n = 0,4 моль при изотермическом расширении, если при этом газ получит теплоту Q = 300 Дж? Температура водорода Т = 300 К. 2.51. Определить изменение энтропии азота массой т = 14 г при изобарном нагревании от t 1 = 27 °С до t 2 = 127 °С. 2.52. Как изменится энтропия n = 2 молей углекислого газа при изотермическом расширении, если объем газа увеличится в четыре раза? 2.53. Газ, совершающий цикл Карно, отдал охладителю теплоту Q2 = 4 кДж. Определить температуру Т1 нагревателя, если при температуре охладителя Т2 = 280 К работа цикла А = 6 кДж. 2.54. Газ, являясь рабочим веществом в цикле Карно, получил от нагревателя теплоту Q1 = 4,38 кДж и совершил работу А = 2,4 кДж. Определить температуру нагревателя, если температура охладителя Т2 = 273 К. 2.55. Газ, совершающий цикл Карно, отдал охладителю 67% теплоты, полученной от нагревателя. Определить температуру Т2 охладителя, если температура нагревателя Т1 = 430 К. 2.56. Во сколько раз увеличится коэффициент полезного действия h цикла Карно при повышении температуры нагревателя от T1 = 380 К до T1’ = 560 К? Температура охладителя Т2 = 280 К. 2.57. Идеальная тепловая машина работает по циклу Карно. Температура Т1 нагревателя равна 500 К, температура охладителя Т2 = 250 К. Определить термический КПД цикла, а также работу А1, совершенную рабочим веществом при изотермическом расширении, если при изотермическом сжатии совершена работа А2 = 70Дж. 2.58. Газ, совершающий цикл Карно, получает теплоту Q1 = 84 кДж. Какую работу А совершает газ, если температура нагревателя в три раза выше температуры Т2 охладителя? 2.59. Совершая цикл Карно, газ получил от нагревателя теплоту Q1 = 500 Дж и совершил работу А = 100 Дж. Температура нагревателя T1 = 400 К. Определить температуру Т2 охладителя. 2.60. Определить изменение энтропии кислорода массой т = 32 г при изобарном нагревании от t 1 = 57 °С до t 2 = 157 °С.
|
|||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 379; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.5.239 (0.125 с.) |
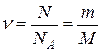 ,
,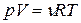 ,
,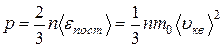 ,
,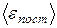 – средняя кинетическая энергия поступательного движения молекулы;
– средняя кинетическая энергия поступательного движения молекулы;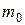 – масса молекулы;
– масса молекулы;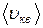 – средняя квадратичная скорость молекулы.
– средняя квадратичная скорость молекулы.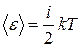 ,
,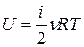 .
.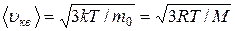 ;
;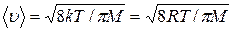 ;
;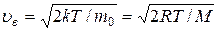 .
.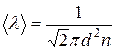 ,
,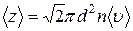 .
.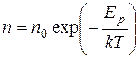 ,
,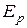 – потенциальная энергия молекулы.
– потенциальная энергия молекулы.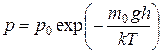 .
.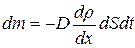 ,
,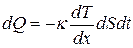 ,
,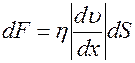 ,
,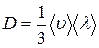 .
.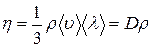 .
.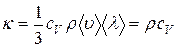 ,
,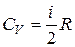 ;
;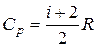 .
.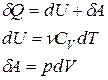
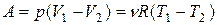 ;
;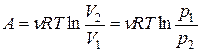 ;
;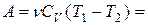
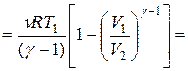
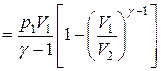 ,
,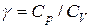 .
.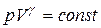 ,
,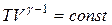 ,
,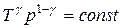 .
.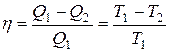 ,
,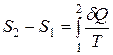 .
.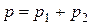 . (3)
. (3)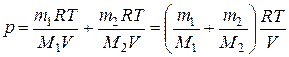 . (4)
. (4)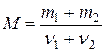 , (5)
, (5)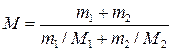 . (6)
. (6)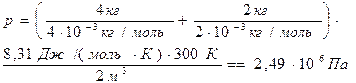
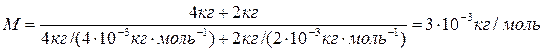 .
.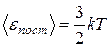 ;
; 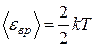 .
.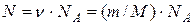 ,
,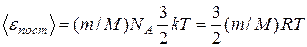 , (1)
, (1)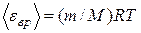 . (2)
. (2)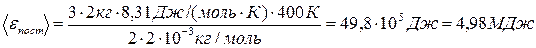 ,
,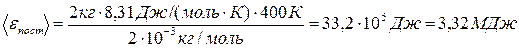
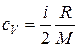 ,
, 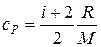 ,
,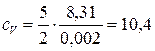 кДж/(кг·К);
кДж/(кг·К);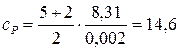 кДж/(кг·К).
кДж/(кг·К).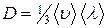 , (1)
, (1)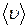 - средняя арифметическая скорость молекул, равная
- средняя арифметическая скорость молекул, равная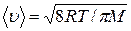 ; (2)
; (2)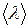 – средняя длина свободного пробега молекул, которая вычисляется по формуле
– средняя длина свободного пробега молекул, которая вычисляется по формуле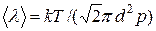 . (3)
. (3)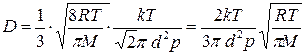 . (4)
. (4)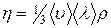 , (5)
, (5)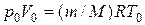 ;
; 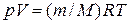 . (6)
. (6)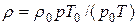 . (7)
. (7)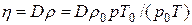 . (8)
. (8)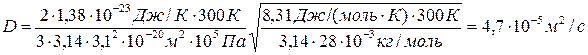
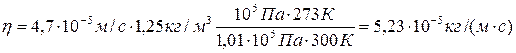 .
.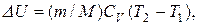 (2)
(2)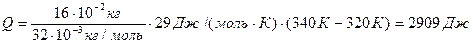 ;
;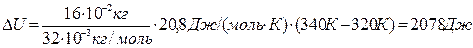 ;
;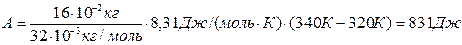
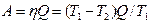 .
.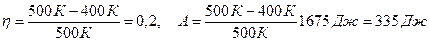 .
.


