Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Группа лентивирусов овец и козСодержание книги
Поиск на нашем сайте
Caprine arthritis encephalitis virus | Вирус артрита-энцефалита коз | M33677 | CAEV Visna/Maedi virus (strain 1514) | Вирус Висна-Мэди (штамм 1514) | M60609 | VISNA Группа лентивирусов приматов Human immunodeficiency virus 1 Genomic clades of HIV-l, примеры: | ВИЧ-1 Генетические группы или clades HIV-1, примеры вирусов каждой группы | — | HIV-1 Clade A:U455 | — | М62320 | HIV–IHIV-1.U455 Clade B: ARV-2/SF-2 | — | К02007 | HIV-1.ARV-2/SF-2 BRU (LAI) | — | K02013 | HIV-l.BRU (LAI) HXB2 | — | К03455 | HIV-1.HXB2 RF | — | М17451 | HIV-1.RF MN | — | М17449 | HIV-1.MN Clade С: ETH2220 | — | U460I6 | HIV-1.ETH2220 Clade D: NDK | — | М27323 | HIV–I.NDK ELI | — | Х04414 | HIV-1.ELI Clade F: 93BR020 | — | AF005494 | HIV-1.93BR020 Clade H: 9 °CR056 | — | AF005496 | HIV-1.9 °CR056 Clade 0: ANT70 | — | L20587 | HIV-1.ANT70 Human immunodeficiency virus 2 Genomic clades of HIV-2, примеры: | ВИЧ-2 Генетические группы или clades HIV-2, примеры вирусов каждой группы | — | HIV-2 Clade A: BEN | — | М30502 | HIV-2.BEN ISY | — | J04498 | HIV-2.ISY ROD | — | М15390 | HIV-2.ROD ST | — | М31113 | HIV-2.ST Clade B: D205 | — | Х61240 | HIV-2.D205 EHOA | — | U27200 | HTV-2.EHOA UC1 | — | L07625 | HIV-2.UCI Simian immunodeficiency virus | Вирус иммунодефицита обезьян (ВИО) | — | HIV-2 African green monkey (agm) SIVs | ВИО африканской зеленой мартышки | — | - African green monkey TYO | ВИО африканской зеленой мартышки TYO | Х07805 | SIV-agm.TYO African green monkey 155 | ВИО африканской зеленой мартышки 155 | М29975 | SIV-agm.155 African green monkey 3 | ВИО африканской зеленой мартышки 3 | М30931 | SIV-agm.3 African green monkey gr-1 | ВИО африканской зеленой мартышки gr-1 | М58410 | SIV-agm.gr African green monkey Sab-1 | ВИО африканской зеленой мартышки Sab-1 | U04005 | SIV-agm.sab African green monkey Tan-1 | ВИО африканской зеленой мартышки Tan-1 | U5899I | SIV-agm.tan chimpanzee SIV | ВИО шимпанзе | Х52154 | SIV-cpz mandrill SIV | ВИО мандрилл | М27470 | SIV-mnd red-capped mangabey SIV | ВИО красношапочного мангабея | AF028607 | SlV-rcm sooty mangabey SfV-H4 | ВИО-Н4 темно-коричневого мангобея | Х14307 | SIV-sm *[9]pig-tailed macaque | ВИО свинохвостых макак | М32741 | SIV-mne *Rhesus (Maccaca mulatta) | ВИО макак резус | М195499 | SIV-mac *stamp-tailed macaque (stm) | ВИО медвежьих макак | М83293 | SIV-stm sykes monkey SIV | ВИО белогорлых обезьян | L06042 | SIV-syk
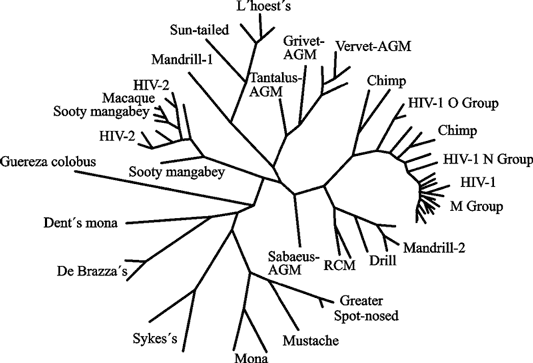
Геномы лентивирусов содержат множество дополнительных генов, необходимых для способности к инфицированию и репликации. Лентивирусы отличает их способность реплицироваться в неделящихся клетках, например в покоящихся CD+4 T-клетках и макрофагах (см. подглаву 3.3). Большинство лентивирусов ассоциируются с различными болезнями, включая иммунодефициты, нейрологические нарушения, артриты и др. Патология пока не описана у крупнорогатого скота, инфицированного BIV. Онкоген-вирусов среди представителей подсемейства нет. Нейротропность лентивирусов касается в основном клеток, происходящих из костного мозга, таких, как микроглия и макрофаги, в то время как астроциты и эндотелиальные клетки, очевидно, инфицируются в гораздо меньшей степени. Эволюционная взаимосвязь лентивирусов приматов показана на рис. 19.
Рис. 19. Эволюционная взаимосвязь между лентивирусами приматов, основанная на филогенетическом анализе полной последовательности белка Pol
Последовательности этих белков лентивирусов, инфицирующих африканских приматов, показаны черным цветом. Недавняя перекрестно-специфическая множественная передача в оригинальном тексте выделена красным цветом; в данной книге — это ветви, идущие по направлениям к ВИЧ-2 от темно-коричневого мангобея (sooty mangabeys); и к ВИЧ-1 (O, N и М групп) от шимпанзе. AGM — африканские зеленые обезьяны; RCM — красношапочные мангобеи (по Muller V. и De Boer R. J., 2006).
С помощью филогенетического анализа нуклеотидных последовательностей генома ВИЧ-1 были выделены несколько подтипов вируса — A, B, C, D, E, F, G, H, J и K, и три группы — M (main — главная), которая включает большинство подтипов, O (outlier — обособленная) и N (ни M, ни O). Разные подтипы преобладают в определенных географических районах. Например, подтип B составляет подавляющее большинство штаммов вируса в Северной Америке и преобладает в Европе и Австралии. Подтип A, наиболее гетерогенный, преобладает в Западной Африке, подтип D — в Центральной Африке, подтип С обнаруживается в основном в Южной Африке и полуострове Индостан, подтип E преобладает в Таиланде и соседних с ним странах. Существуют рекомбинантные вирусы, примером которых служит подтип E. Из вирусов, циркулирующих у животных, к ВИЧ-1 ближе всего вирус иммунодефицита обезьян, обнаруженный у шимпанзе (SIVcpz) (Захнер С., 2004). «Пенящиеся вирусы» (Spumavirinae) — особенностью вирусов этого подсемейства является их способность вызывать своеобразный цитопатический эффект, проявляющийся слиянием клеток. Культура клеток выглядит как бы вспененной, отсюда их название — «пенящиеся». Вирусы распространены повсеместно, экзогенные, найдены у многих млекопитающих. В 1960-1970-х гг. вирусы этого подсемейства выделены от обезьян, человека, кошки, хомяка, быка и др. Есть данные о существовании родственных (но не близких) эндогенных вирусов. Хотя в природных условиях вирус spuma редко вызывает болезнь у своих хозяев, но он способен вызывать нейродегенерацию, будучи экспрессированным как трансген у мышей, и может инфицировать разные виды млекопитающих, в том числе людей. Естественного инфицирования людей не зарегистрировано, отмечались редкие случаи заражения людей от нечеловекообразных обезьян. Замечена их способность контаминировать вакцины, изготовляемые на основе культур клеток почки обезьяны и других видов животных. Отношения спумавирусов к какой-то известной патологии пока не установлено, в тоже время надо понимать и то, что они существуют благодаря ресурсам клетки. Инфицированность лентивирусами диких животных. В рамках медицинской науки мы воспринимаем пандемию ВИЧ/СПИДа антропоцентрически, вне контекста распространения лентивирусов среди животных, обитающих в естественных условиях. Вроде как это должно интересовать только ветеринарных специалистов и то в аспекте заноса возбудителей лентивирусных инфекций из их резервуаров среди диких животных в популяции домашних. Однако если мы посмотрим на оба процесса с точки зрения времени и места их возникновения, то обнаружим любопытные совпадения, свидетельствующие в пользу существования еще неоткрытых и непростых природных явлений. Во-первых, азиатские виды диких приматов Старого Света (Colobines и макаки), так же как и отдельные африканские виды (бабуины), не являются носителями специфических SIV. Это позволило Sharp P. M. et al. (2000) утверждать, что появление данного лентивируса среди приматов произошло из источника, не имеющего отношения к приматам и уже после их дивергенции на современные виды. Хотя шимпанзе и была показана как резервуар SIV, нет данных, демонстрирующих то, что SIVcpz коэволюционировал с этим хозяином (Prince A. M. et al., 2002; Santiago M. L. et al., 2002). Шимпанзе инфицированы SIVcpz уже после его дивергенции в самостоятельный вид (Sharp P. M. et al., 2005).
Во-вторых, лентивирусные инфекции среди животных (кошачьи, приматы) в Центральной Африке распространились в те же сроки, что и ВИЧ среди людей. Исследования сывороток сотен африканских зеленых обезьян (african green monkeys, AGMs), выполненные в 1990-х гг. показали, что от 40 до 50 % их популяций, обитающих в различных регионах Центральной Африки, инфицировано SIVagm. Интересно, что сероэпидемические исследования африканских зеленых обезьян, завезенных на Карибские острова в XVII и XVIII столетиях, не выявили ни одного случая их инфицированости SIV, т. е. этот лентивирус не циркулировал среди приматов Центральной Африки, по крайней мере, еще два столетия назад (Woude S. V., Apetrei C., 2006). В третьих, лентивирусные инфекции могут быть эндемичны для отдельных территорий и проживающих на них видов млекопитающих. Например, львы, обитающие в национальном парке Серенгети (Serengeti, Танзания), почти на 100 % FIV-серопозитивны, и среди них уже выявляются особи с иммунодефицитом и энцефалопатиями. Но львы в котловине Этош (Etosha Pan, Намибия) почти все серонегативны (Spencer J. A. et al., 1992; Brown E. W. et al., 1994). Исследование инфицированности SIV антроморфных приматов (anthromorhic primate или great apes) показало носительство SIVcpz только у двух видов шимпанзе (Pan troglodytes troglodytes и P. t. schweinfurthic), обитающих в Восточной Центральной Африке. Не завершились успехом интенсивные поиски серопозитивных особей среди шимпанзе Восточной Африки (P. t. verus или P. t. vellorosus) (Switzer W. M. et al., 2005). В четвертых, лентивирусная инфекция у живущих в природных условиях приматов и львов потенциально способна перейти в стадию СПИДа, но клинические проявления болезни встречаются редко и только тогда, когда животное инфицировано период времени, превышающий среднюю продолжительность его жизни в естественных условиях. У приматов развитие СПИДа обычно стимулируется возбудителем другой инфекционной болезни, например проказы или Т-клеточного лейкоза (Woude S.V., Apetrei C., 2006). Таким образом, лентивирусные инфекции являются сравнительно новым явлением не только для человека, но и для приматов и кошачьих. Первоначально они были локализованы в строго определенных географических регионах. И, видимо, существуют какие-то природные факторы, воздействие которых на еще неизвестные первичные природные очаги этих вирусов приводит к их одновременной активизации (см. ниже «Реинтеграция и реинфекция ретровирусов»). Непатогенная инфекция у темно-коричневых мангобеев. Термин (nonpathogenic infection) предложен V. Muller, R. De Boer (2006) для описания необычного инфекционного процесса, вызываемого SIV у темно-коричневых мангобеев (sooty mangabeys). Развитие SIV-инфекции у этих приматов не приводит к поражению клеток иммунной системы, хотя сопровождается почти такой же вирусной нагрузкой, что и ВИЧ-инфекция у людей. Отсюда можно сделать два важных вывода.
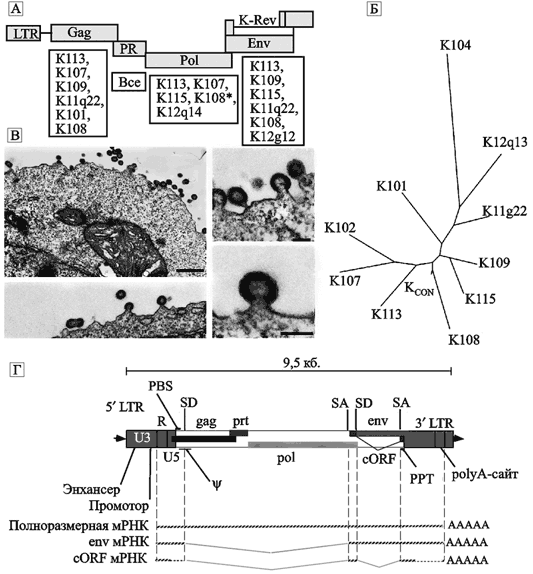
Первый — вирулентность ВИЧ не является результатом его массивной репликации в инфицированном хозяине, а прямые метаболические затраты хозяина на репликацию ВИЧ не достаточны для провоцирования болезни. Второй — темно-коричневые мангобеи избегают развития болезни не путем контроля над репликацией ретровируса, а отсутствием выраженной реакции на вирус со стороны их иммунной системы (Silvestri G. et al., 2003). Однако феномен взаимодействия SIV и темно-коричневых мангобеев не является закономерностью в коэволюции ретровирусов и приматов, скорее всего описанное явление — «исключение из правил», за которое было заплачено неизвестным нам количеством вымерших «по правилам» видов приматов. SIV вызывает инфекцию у шимпанзе, очень схожую с ВИЧ-инфекцией у людей, и приводит их к гибели. Поэтому попытки объяснить этот феномен применительно к темно-коричневым мангобеям предпринимались неоднократно. Несколько лет тому назад S. Norley et al. (1999) предположили, что относительная иммунологическая толерантность к SIV у темно-коричневых мангобеев вызвана экспрессией гена гликопротеина Gag эндогенного ретровирусного элемента. V. Muller и R. De Boer (2006) не нашли в геноме темно-коричневых мангобеев «следов» лентивирусного происхождения, которые бы ясно свидетельствовали об их происхождении из SIV. Такой результат был ими ожидаем, так как геном этого вида приматов изучен значительно хуже, чем геном человека или шимпанзе. Но ни человек, ни шимпанзе не являются природными хозяевами SIV, поэтому сведения об их нуклеотидных последовательностях мало применимы для интерпретации результатов полученных у темно-коричневых мангобеев. V. Muller и De Boer (2006) считают, что SIV в виде провируса интегрирует в зародышевую линию темно-коричневых мангобеев, которая способна к экспрессии во время негативной селекции Т-клеток в тимусе и В-клеток в костном мозге. Оба процесса приводят к элиминации клеток, способных узнавать собственные антигены (более подробно о механизмах «созревания» Т- и В-клеток см. в монографии Галактионова В. Г., 2005), в результате иммунная система перестает реагировать на репликацию SIV. В качестве подтверждения своей гипотезы они ссылаются на работу I. Ferrero et al. (1997), показавших развитие Т-толерантности иммунной системы к эндогенному вирусу рака молочных желез мышей (endogenous mouse mammary tumour virus) из-за его экспрессии в тимусе; и работу J. L. Bracy и J. Iacomini (2000), продемонстрировавших возможность индукции В-клеточной толерантности у мышей посредством экспрессии в клетках их костного мозга трансдуцированных ретровирусных генов. Феномена «непатогенной инфекции», подобного наблюдаемому у темно-коричневых мангобеев, у людей пока не установлено. Реинтеграция и реинфекция ретровирусов. Эти взаимодополняющие друг друга процессы лежат в основе распространения экзогенных и эндогенных ретровирусов по геному любого эукариотического вида. Высокая скорость эволюции экзогенных ретровирусов и относительно медленная скорость эволюции геномной провирусной ДНК (примерно в 104 раз медленнее; Shih A., et al., 1991), должны проявляться серьезными различиями в нуклеотидном составе экзогенных и эндогенных ретровирусов. Однако для некоторых их семейств такие различия показать не удалось, что свидетельствует в пользу двух гипотез: 1) относительно «недавнего» появления инфекционных (экзогенных) ретровирусов из их эндогенных двойников и о существовании определенной цикличности в поддержании отдельных ретровирусных семейств; 2) возможности многократного проникновения экзогенных ретровирусов в популяции приматов (и, разумеется, других позвоночных) из каких-то неизвестных природных резервуаров, способных поддерживать экзогенные ретровирусы миллионы лет. Первая гипотеза имеет много сторонников, опирающихся на сравнительные данные по возрастным отличиям отдельных белков экзогенных и эндогенных ретровирусов, она приводится ниже. Вторая выдвинута мной из-за того, что не все данные по эволюционной истории ретровирусов можно объяснить в рамках первой гипотезы. Более подробно она приведена в подглаве 2.2 «Ретровирусы». Существует высокая вероятность того, что ретротранспозоны периодически формируют инфекционные ретровирусы. Для этого у них имеются две возможности: 1) приобретение посредством неправильной рекомбинации (illegitimate recombination) генов, кодирующих вирусную оболочку; 2) рекомбинация с другими эндогенными вирусами. В истории основных линий эндогенных ретровирусов обычно удается проследить внешнюю, «транзиторную фазу» (transitory external phase). Данная гипотеза основана на анализе филогенетических деревьев оболочечных белков различных эндогенных и экзогенных ретровирусов (Doolittle R. F. et al., 1989). Наличие «внешней фазы» у жизненного цикла эндогенных ретровирусов приматов подтверждено наблюдением над эволюцией многих семейств ERV. Недавно описано семейство ERV-F(c), представляющее собой «расширение» семейства ERV-F/H. Геном человека включает только 6 вставок HERV-Fc, среди которых две имеют полноразмерные гены вирусной оболочки. Дальнейшее сравнение выявленного эндогенного вируса с аналогичными вирусами у других приматов показало, что провирус ERV-F(с) является эндогенным «следом» ретровирусных элементов, активных как экзогенные ретровирусы с низкой способностью к эндогенизации (endogeneization potency). Были получены доказательства его реинтеграции с геномом приматов в два различных периода их эволюции (Benit L. et al., 2003). Эндогенный ретровирус семейства ERV9 также неоднократно вовлекался в процесс эволюции приматов, затем его транспозиционная активность обрывалась. Первые представители семейства ERV9 (линия А) «проникли» в геном предков нынешних приматов Старого Света уже после разделения континента Гондваны (Gondwanaland), т. е. около 38 млн лет назад. Наиболее активно экспансия ERV9 по геному приматов осуществлялась в период их дивергенции от гиббонов на высшие виды обезьян (16—6 млн лет назад). В период 8–6 млн млн лет назад семейство ERV9 наиболее интенсивно пролиферировало по геному вида, предкового для человека и шимпанзе (см. рис. 4 Б). Затем пролиферация ERV9 остановилась. Как фактор эволюции генома приматов это семейство транспозируемых элементов перестало существовать. В геноме человека сохранились более сотни дефектных ERV9 и, по крайней мере, 4 тыс. одиночных длинных терминальных повтора (solitary LTRs), возникших благодаря гомологичной рекомбинации между 5’- и 3’-LTR полноразмерных ERV9, рассеянных по геному приматов в эволюционном прошлом (Lopez-Sanchez P. et al., 2005). Как противоположность ретровирусам, имеющим экзогенные и эндогенные аналоги, было описано семейство без гена env — ERV–L (Benit et al., 1999), а следовательно, и без экзогенный фазы в своей эволюционной истории. По примеру других ретроэлементов семейство можно реклассифицировать в группу ретротранспозонов, если бы не следующее обстоятельство. Семейство имеет до 200 копий в геноме человека и мышей. Анализ его филогенетического древа, основанного на гене RT (reverse transcriptase, обратная транскриптаза), показал возможность утраты гена env в прошлом, и реинфекцию и вторичную интеграцию ERV–L в геном млекопитающих в виде полноценного провирусного элемента (Lopez-Sanchez P. et al., 2005). Эндогенные ретровирусы обнаружены почти у каждого позвоночного вида. Но что касается HERV, то только два их семейства были выявлены в геноме других позвоночных, помимо приматов. Это семейства HERV–L у мышей, кроликов, собак, кошек (общий предок около 100 млн лет); и HERV–I у птиц, рептилий и рыб (общий предок около 400 млн лет) (Martin et al., 1997; Benit et al., 1999). Большинство же из инфицированных HERV зародышевых линий приматов появились в период от 20 до 40 млн лет назад (после разделения приматов Нового и Старого Света). Последующие взрывы реинтеграции/амплификации HERV в эволюции приматов были менее протяженными. Следовательно, участие HERV в эволюции приматов более ограничено по времени, чем его занимали других ретроэлементы, представленные в геноме человека. Например, LINE и SINE обнаружены почти во всех эукариотических линиях и до сих пор показывают признаки активности (см. подглаву 1.2). Эндогенные ретровирусы имеют не только внешнюю, «транзиторную фазу», но и способны пролиферировать среди клеток зародышевой линии. Скорость такого процесса по восприятию времени человеком настолько мала, что сам факт пролиферирующей активности эндогенных ретровирусов можно установить по соотношению несинонимичных и синонимичных замен нуклеотидов отдельных генов (dN/dS). Дело тут в следующем. Количество копий эндогенных ретровирусов в пределах зародышевой линии может увеличиваться и без их репликации. Для этого существуют два альтернативных механизма: 1) ретротранспозицией в cis — когда вирусы используют собственные гены белков для мобилизации; они копируют сами себя и вставляются в новые участки хромосомы в пределах той же клетки, без обычной для ретровирусов экстрацеллюлярной фазы жизненного цикла (см. «Структура и цикл жизни ретровирусов»); 2) через комплементацию в trans, когда белки, необходимые для пролиферации вирусов, добавляются другими эндогенными и экзогенными вирусами. Ретротранспозиция в cis не требует интактного гена env (он необходим вирусу для перемещения за пределы клетки); комплементация в trans не нуждается в наличии у эндогенного ретровируса функционирующих генов. Достаточно чтобы он имел промотор и другие «мотивы» для экспрессии и упаковки РНК. Пролиферация эндогенных ретровирусов посредством таких механизмов приводит к накоплению в их геноме большого количества мутаций и стоп-кодонов (Belshaw R. et al., 2004). Эти изменения почти не затронули «вернувшийся» в геном приматов Старого Света 6 млн лет назад эндогенный ретровирус HERV-K(HML-2). Семейство HERV-K(HML-2) впервые интегрировалось с геномом приматов около 30 млн лет назад. Отдельные провирусы, сохранившиеся с первого «пришествия» семейства в геном приматов, у человека сегодня напоминают о себе вирусоподобными частицами, продуцируемыми клетками злокачественной опухоли — тератокарциномы (human teratocarcinoma cells). Семейство вновь инфицировало зародышевую линию человека 100 тыс. лет назад (HERV-K113) уже в качестве экзогенных ретровирусов (Turner et al., 2001). Однако оно еще не «охватило» весь вид Homo sapiens. В геноме многих людей находят пустые сайты интеграции этого ретровируса (Belshaw R. et al., 2005) (см. подглаву 1.2 «Эволюционная роль HERV-K»). HERV-K(HML-2) содержат неповрежденные открытые рамки считывания почти во всех генах, включая env. У них низкое соотношение несинонимичных и синонимичных замен (dN/dS). Эти находки указывают на постоянную селекцию интактных генов белков HERV-K(HML-2) и на то, что HERV-K(HML-2) увеличивали количество своих копий преимущественно через реинфекцию, а не через ретротранспозицию в cis или комплементацию в trans. Y. N. Lee et al. (2007) попытались воспроизвести инфекционный провирус HERV-K(HML-2). Для определения способности структурных белков и ферментов, закодированных в геноме HERV-K, «собирать» ретровирусоподобные частицы, ими были сконструированы плазмиды, экспрессирующие Gag, Gag-PR и Gag-PR-Pol. Геном HERV-K имеет необычный нуклеотидный состав, в котором много кодонов, кодирующих аденин (A-rich). Такая особенность генома лентивирусов характерна для ВИЧ-1 и приводит к тому, что не полностью спласингсированные транскрипты мРНК ВИЧ-1 удерживаются в ядре клетке. Их экспорт в цитоплазму достигается благодаря экспрессии гена Rev. HERV-K кодирует функционально ортологичный Rev-протеин, названный Krev (или Rec), медиирующий экспорт РНК HERV-K из ядра в цитоплазму клетки (Magin C. et al., 2000). Поэтому клонирование и экспрессия генов HERV-K в культуре клеток 293Т были осуществлены с помощью ранее разработанного V. Zennou et al. (2004) вектора pCRV1. Первоначально Y. N. Lee et al. (2007) для получения инфекционного ретровируса был использован HERV-K-К113, имеющий интактные открытые рамки считывания для вирусных белков (за исключением одного гена) и считающийся сегодня самым «молодым» среди эндогенных ретровирусов HML-2 (см. подглаву 1.2 «Эволюционная роль HERV-K»). Однако плазмиды, сконструированные на основе генов этого провируса, плохо их экспрессировали в культурах клеток и вирусные частицы не образовывались. Тогда исследователи пришли к выводу, что относительная «молодость» эндогенного ретровируса еще не гарантирует экспрессии всех его генов. Они отобрали группу из 10 вирусов, имевших дефекты, по крайней мере, в одном структурном гене, и установили консенсусные последовательности каждого гена. Синтезированный вирус с такой последовательностью нуклеотидов они назвали HERV-KCON. На построенном филогенетическом древе HERV-KCON занимает место, соответствующее предковой последовательности HERV-K, интегрировавшегося с геномом гоминид 6 млн лет назад (рис. 20).
Рис. 20. Синтезированный вирус HERV-KCON
А — схематическое изображение провируса HERV-K. Открытые рамки считывания изображены прямоугольниками. Под ними приведен список ретровирусов, чьи нуклеотидные последовательности были использованы для установления консенсусных последовательностей структурных генов HERV-KCON; Б — филогенетическое древо этого семейства; В — электронные микрофотографии ретровирусных частиц HERV-KCON, образовавшихся в культуре клеток 293Т. Сборка вирусных частиц происходит на плазматической мембране клетки (Lee Y. N. et al., 2007); Г — более детальное схематическое изображение структуры генома интегрировавшегося с ДНК хромосомы человека эндогенного ретровируса K108, принадлежащего к семейству HERV-K(HML-2). LTR включает три домена: U3, R и U5. Провирус содержит 5 генов: классический gag (кодирующий протеина кора вируса), prt (кодирует протеазу), pol (кодирует обратную транскриптазу, RNAseH, интеграза), env (кодирует белок оболочки вируса) и вспомогательный ген cORF/Rec, функционально эквивалентный адаптерным белкам ядерного экспорта — Rev у ВИЧ и Rex у вируса Т-клеточной лейкемии, но отличающийся от них сайтом связывания. Гены env и cORF белков транслируются со сплайсированных транскриптов, которые соответствуют участку: сайт донора сплайсинга (splice donor, SD) — сайт акцептора сплайсинга (splice acceptor, SA); PBS (primer binding site) — праймерсвязывающий сайт;? — пакующий сигнал; PPT (polypurine tract) — полипуриновый тракт РНК (используется обратной транскриптазой для инициации плюс-цепи ДНК). По N. de Parseval и T. Heidmann (2005).
Попарное сравнение нуклеотидных последовательностей десяти провирусов позволило установить основные различия по нуклеотидам между каждым из провирусов и HERV-KCON. Они заключались либо в замене G-на-A, либо C-на-T, или vice versa. Эта находка указывает на возможную роль цитидиндеаминазы (cytidine deaminases) в эволюции HERV-K у людей и на ее возможное участие в инактивации провирусов. Эксперименты Y. N. Lee et al. (2007) показали, что геном HERV-KCON содержит все функциональные компоненты, необходимые для осуществления им полного цикла ретровирусной репликации. В дальнейших экспериментах ими установлено, что HERV-KCON оказался способен образовать псевдотипные частицы с ВИЧ-1 и вызывать их проникновение в линии клеток человека. На основе анализа генома эндогенных ретровирусов HERV-K (HML-2) и собственных экспериментальных данных, Y. N. Lee et al. (2007) сделали вывод о существовании пока неизвестных механизмов активации эндогенных ретровирусов, позволяющих им реинфицировать людей и сегодня. Они предположили возможность существования штаммов HERV-K в еще не идентифицированных репликационно-активных формах у отдельных людей и/или в их изолированных популяциях. Независимо от Y. N. Lee et al. (2007), Contreras-Galindo R. et al. (2006) обнаружили, что dN/dS гена белка env HERV-K(HML-2) меньше единицы, что предполагает распространение этого эндогенного ретровируса через реинфицирование и способность этого семейства кодировать инфекционные вирусные частицы. Они также пришли к выводу о том, что РНК-рекомбинация эффективно удаляет мутировавшие аллели HERV-K через рекомбинацию с интактными участками различных геномов. Коинфекция. Экзогенные и эндогенные ретровирусы взаимодействуют между собой в инфицированных клетках, но этот процесс еще плохо изучен. Например, по данным Contreras-Galindo R. et al. (2007), у ВИЧ-инфицированных больных раком появляются антитела к антигенам HERV-K, а экспрессия белков HERV-K приводит к цитотоксическим ответам Т-клеток. Эти же авторы в экспериментах в условиях in vitro показали, что ВИЧ-1 увеличивает экспрессию РНК HERV-K дозозависимым образом, и что экспрессия HERV-K в CD4(+) в Т-клетках ВИЧ-инфицированных пациентов выше, чем в контроле (см. также подглаву 3.3).
%%%
Эукариотические виды существуют, эволюционируют и исчезают в тесном ретровирусном «объятии». Для Природы является нормой постоянная или периодически возникающая инфицированность какой-то части любого многоклеточного вида репликационно-активными ретровирусами. Границы между эндогенными и экзогенными ретровирусами (например, HERV-K-К113 и ВИЧ) можно провести только на момент времени, воспринимаемый человеком. По мере масштабирования времени в пределы, вмещающие геологические эпохи, границы между эдогенными и экзогенными ретровирусами становятся менее ясными. Пандемии ретровирусных инфекций представляют собой «слоеный пирог». Его самый «верхний слой» составляют ретровирусы, активно размножающиеся в цитоплазме клеток хозяина (например, ВИЧ). Самый «нижний» представлен репликационно-активными формами эндогенных ретровирусов (семейство HERV-K-К113). «Слои» «переложены» экзонами и интронами генов, ретротранспозируемыми и регуляторными элементами, псевдогенами и другими последовательностями генома хозяина. Раскрытие взаимоотношений между ними составит основное содержание генетики на ближайшие десятилетия. Наше собственное место в Природе, особенно в сравнении с тем, которое занимают там ретровирусы, невелико. Пока мы не знаем с какой частотой происходила эндогенизация ретровирусов HERV-K (HML-2) в геноме древних гоминоидов и человека, и не можем предполагать такую возможность для ВИЧ. Но уже очевидно то, что ВИЧ/СПИД-пандемия не является обычной пандемией, вызванной проникновением в человеческие популяции нового вируса. Она «верхушка» более сложного природного явления — эволюционного процесса, который из-за нашего ощущения времени представляется нам в маске инфекционного. В эволюции гоминоидов неспособные к эндогенизаци экзогенные ретровирусы играют роль фактора терминации исходных и промежуточных видов. Тем самым они снижают заполнение экологических ниш для новых доминирующих видов, появившихся в результате активности HERV-K (HML-2) и других транспозируемых элементов генома (см. подглаву 1.2), например, по механизму симпатрического видообразования.
ГЛАВА 2
|
||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 125; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.017 с.) |