Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ретровирусное окружение вида Homo sapiensСодержание книги
Поиск на нашем сайте
Структура и цикл жизни ретровирусов. Онкогенные ретровирусы (Oncovirinae). Лентивирусы (Lentivirinae, «медленные вирусы»). «Пенящиеся вирусы» (Spumavirinae). Инфицированность лентивирусами диких животных. Непатогенная инфекция. Реинтеграция и реинфекция ретровирусов. Коинфекция.
Когда знакомишься с вирусологической литературой, изданной «накануне» обнаружения ВИЧ, то складывается впечатление, что ретровирусы на тот момент были изучены не хуже, чем кишечная палочка (см., например, работы Альштейна А. Д., 1982; Тимакова В. Д. и Зуева В. А., 1977). Первые ретровирусы открыты еще в начале ХХ столетия, когда была установлена вирусная природа эритробластоза и саркомы кур. Вскоре были обнаружены вирус рака молочных желез мышей и вирус лейкоза мышей. Название семейству дано в 1973 г. W. Parks — оно происходит от англ. «reverse transcriptase» (обратная транскриптаза). В латинском варианте «retro» означает обратный поток информации — не от ДНК к РНК, а, наоборот, от РНК к ДНК. В 1970-х гг. семейство было тщательно классифицировано и изучено. Установлена морфология, химический состав, жизненный цикл и патогенные свойства многих его представителей. Ретровирусы были обнаружены как у животных, составляющих ближайшее окружение человека, так и у его эволюционных предков. Их выявили у норок (эндогенный вирус типа С), мышей (экзогенные и эндогенные вирусы лейкоза, вирус саркомы, вирусы рака молочных желез), крыс (эндогенный вирус типа С), хомяков (эндогенный вирус типа С), кошек (эндогенный вирус типа С, экзогенные вирусы лейкоза и саркомы), крупнорогатого скота (вирус лейкоза), обезьян (эндогенные и экзогенные вирусы типа С, эндогенный вирус типа В, вирус лимфомы гиббонов и др.), свиней (вирус типа С), у пресмыкающихся (вирусы типа С), овец (вирусы висны) и др. «Рука ученого» дотянулась даже до ретровирусов гадюк. Тем более удивительным нам представляется существовавший на тот момент пробел в знаниях по ретровирусам у людей. На этом фоне и так запоздалое обнаружение ВИЧ выглядит до сих пор чуть ли не «как гром с ясного неба», даже роль этого вируса в развитии пандемии СПИДа подвергается сомнению.
Структура и цикл жизни ретровирусов. Ретровирусы — семейство сложных РНК-геномных вирусов, образующих с помощью обратной транскриптазы ДНК-копию генома, которая, интегрируя с геномом хозяина, вызывает интегральную инфекцию. Для включения вируса в семейство Retroviridae обязательны следующие признаки:
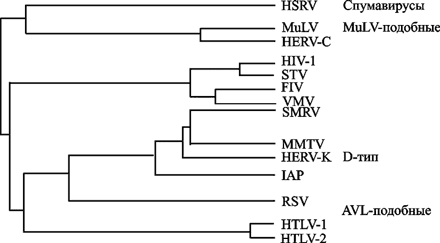
1) наличие липидной оболочки и сердцевины (core) и характерная морфология, на основании которой их делят на типы В, С и D; 2) наличие обратной транскриптазы внутри вириона; 3) геном в виде однонитевой линейной РНК, которая образует комплекс, состоящий из двух идентичных субъединиц (т. е. они представляют собой диплоидные организмы, каждый их вирион содержит две идентичные цепи РНК размером от 8 тыс. до 10 тыс. нуклеотидов, соединенных вблизи своих 5’-концов); 4) репликация через стадию образования двунитевого ДНК-провируса, соответствующего по длине одной из субъединиц геномной РНК; 5) интеграция ДНК-провируса с клеточным геномом и осуществление транскрипции клеточной РНК-полимеразой (после интеграции ретровирусная ДНК реплицируется как часть клеточной ДНК), созревание вириона путем почкования на клеточных мембранах (Альштейн А. Д., 1982). Вирион сферический (диаметр 80-100 нм) оболочечный, с гликопротеиновыми поверхностными выступами (8 нм в длину). Внутреннее ядро включает сферический нуклеокапсид (нуклеоид), расположенный эксцентрично у представителей рода Betaretrovirus, по центру — у Alpharetrovirus, Gammaretrovirus, Deltaretrovirus и Spumavirus, и в виде стержня или усеченного конуса у представителей рода Lentivirus. Традиционно семейство разделяют на подсемейства ленти-, онкорна- и спумавирусов (Dalton F. et al., 1974; Matthews R., 1979). Ретровирусное филогенетическое древо показано на рис. 17.
Рис. 17. Ретровирусное филогенетическое древо
На филогенетическом дереве показаны ретровирусы типа С [вирусы лейкозов грызунов (MuLV) и птиц (АLV), а также вирус, тропный к Т-лимфоцитам человека (НТLV)], лентивирусы [вирусы иммунодефицита человека (ВИЧ-1 и 2), обезьян (SIV), кошек (FIV) и вирус visna-maedi (VMV)], спумавирусы и эндогенные ретровирусы человека (HERV-K и HERV–C) (Пауэр К., 2001).
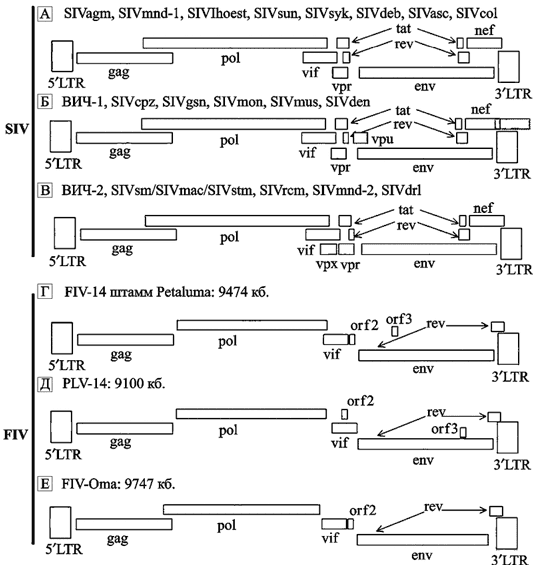
Схематическое изображение РНК-генома ретровирусов приведено на рис. 18.
Рис. 18. Схематическое изображение РНК-генома ретровируса на примере сравнения геномов лентивирусов кошачьих и приматов (по Woude S.V., Apetrei C., 2006)
Лентивирусы приматов обладают пятью регуляторными генами (vif, rev, tat, vpr и nef), которые обычно «выстроены в шеренгу» в одних и тех же регионах SIV/ВИЧ генома. Гены tat и rev содержат по два экзона. Присутствие в геноме лентивируса двух других регуляторных генов (vpx и vpu) варьирует в зависимости от происхождения вируса. Их сочетания обычно делят на три геномные групы: а) SIVsyk, SIVasc, SIVdeb, SIVblu, SIVtal, SIVagm, SIVmnd-1, SIVlhoest, SIVsun и SIVcol содержат пять добавочных генов (tat, rev, nef, vif и vpr); b) геномы ВИЧ-1, SIVcpz, SIVgsn, SIVmus, SIVmon и SIVden включают дополнительный ген vpu; c) ВИЧ-2, SIVsmm, SIVmac, SIVrcm, SIVmnd-2 и SIVdrl формируют третью геномную группу, характеризующуюся присутствием гена vpx.Гены far, vpx специфичны для SIV, инфицирующих обезьян Papionini (триба павиановые, включают следующие рода: павианы, макаки, мангобеи, мандрилы, джелады) и были приобретены в результате негомологичной рекомбинации (nonhomologous recombination), которая привела к дупликации гена vpr. SIVblu, SIVolc, SIVwrc, SIVasc, SIVbkm, SIVery и SIVagi не были полностью секвенированы, и поэтому пока нет возможности охарактеризовать организацию их генов. Структура геномов трех видов FIV сходна и не обнаруживает явных геномных групп, связанных с патогенностью для кошачьих. FIV несут два других добавочных гена: ген dUTPазы (dUTPase gene; на схеме не показан), расположенный в рамке в пределах гена pol. Он ответственен за предотвращение ошибочного включения урацила (uracil misincorporations) в молекулу РНК вируса во время его репликации и, соответственно, его аттенуации. Вторая открытая рамка считывания, обозначенная как orf-A (также ее называют orf-2), кодирует протеин, состоящий из 77 аминокислот, сходный с Tat ВИЧ. У этого протеина не обнаружена способность к трансактивации (transactivating properties), однако он является критическим на ранней стадии инфицирования клетки и при формировании вирусной частицы, локализован в ядре, что делает его более сходным по свойствам с Vpr. Нарушение функции белка Orf-A ведет к снижению способности вируса к репликации и уменьшению его патогенности. Оrf-3 содержит ATG-кодон в направлении «вниз» (downstream) от потенциального сплайсингакцепторного сайта. кб — килобазы.
Инфекционный ретровирус имеет три основных структурных гена, кодирующих вирусные протеины в следующем порядке: 5’-gag-pol-env-3’. Для ВИЧ их описание следующее: ген gag — кодирует белки, формирующие «сердцевину» вируса (необходимы для внутриклеточной сборки вируса и его высвобождения из клетки); ген pol — кодирует ферментную систему вируса (обратную транскриптазу — p66/51; интегразу — p31/33; рибонуклеазу — p31/33); ген env — определяет способность вируса выходить за пределы клетки и инфицировать другие. Кодирует белки предшественника оболочки вируса — gp160, расщепляющиеся на gp120 и gp41. Области 5’- и 3’-концов обеих цепей модифицированы, как и у всех эукариотических мРНК (5’-кэпы и 3’-полиадениловые хвосты). Имеются последовательности, необходимые для реализации механизма обратной транскрипции: 1) прямые повторы на 5’- и 3’-концах РНК (LTR — он действует как единица промоции, необходим для транскрипции всего вирусного генома и начала транскрипции отдельных вирусных генов); 2) последовательность из 80–120 нуклеотидов, соседствующая с 5'-концевым прямым повтором (U5); 3) последовательность из 170–1200 нуклеотидов, соседствующая с 3’-концевым прямым повтором (U3); 4) последовательность из 15–20 нуклеотидов (Р), в пределах которой клеточная тРНК спаривается с ретровирусной РНК, что создает праймер для синтеза первой цепи ДНК;
5) сегмент Рu, находящийся непосредственно перед повтором U3 и являющийся сайтом для праймирования второй цепи ДНК. У ретровирусов кроме структурных есть еще регуляторные гены. У ВИЧ их шесть: tat (transactivator of transcription) — кодируемый им белок является наиболее активным регулятором, обеспечивающим усиление в 1000 раз репликации вируса и регулирующий экспрессию клеточных генов; rev (regulator of expression of virus proteins) — кодируемый им белок избирательно активирует синтез структурных белков вируса, обеспечивает экспорт из ядра длинных молекул вирусной РНК. На поздних стадиях ВИЧ-инфекции он замедляет синтез регуляторных белков (см. «Реинфекция»); nef (negative regulatory factor) — при взаимодействии с LTR кодируемый им белок замедляет транскрипцию вирусных генов. Синхронная функция nef и tat регулируют репликацию вируса таким образом, чтобы она не приводила к гибели клетки-хозяина. Экстрацеллюлярный белок nef увеличивает миграцию моноцитов, тем самым, способствуя распространению по организму ВИЧ и прогрессированию болезни; vif (virion infectivity factor) — кодируемый им белок необходим для образования функционально полноценных вирусов в определенных типах клеток на поздней стадии инфекции. Белок Vif включается в состав новых вирусов; vpr — кодируемый им белок вызывает остановку клеточного цикла, способствует входу в ядро прединтеграционного комплекса. Vpr включается в новые вирусы в большом количестве, способен в некоторой степени усиливать экспрессию генов ВИЧ и нарушать экспрессию отдельных клеточных генов; vpu для ВИЧ-1 (vpx для ВИЧ-2) — кодируемый им белок разрушает комплекс gp120/CD4; снижает экспрессию CD4; способствует высвобождению вируса; усиливает продукцию вируса, связывая цитоплазматический хвост молекулы CD4, пока она находится в эндоплазматическом ретикулуме, и тем самым посттрансляционно сокращает число рецепторов CD4 на поверхности клетки. В результате предотвращается захват Env в эндоплазматическом ретикулуме в комплексе с CD4. В природе не существует других диплоидных семейств ДНК или РНК-вирусов. Схематично жизненный цикл ретровирусов включает связывание вириона с рецептором клетки хозяина, вход в клетку, затем следует обратное транскрибирование с последующей интеграцией с геномом хозяина. Проникновение в клетку определяется взаимодействием гликопротеина вириона и специфических рецепторов на клеточной поверхности, следствием чего является слияние вирусной оболочки и клеточной мембраны и эндоцитоз. Некоторые из клеточных рецепторов были идентифицированы (более подробно см. в подглаве 3.3). В проникновении ВИЧ в клетку принимают участие как минимум два рецептора: иммуноглобулин-подобный протеин с одним трансмембранным участком CD4 и хемокиновый рецептор, пронизывающий мембрану семь раз (CCR5 или CXCR4). Рецепторы для экотропных (Murine leukemia virus, MLV), амфотропных MLV и Gibbon are leukemia virus (GALV) связаны с участием в транспортировке небольших молекул и имеют сложную структуру с множественными трансмембранными доменами. Для вирусов лейкоза птиц (ALVs) идентифицировано два рецептора: для вирусов подгруппы А — небольшая молекула с одним трансмембранным доменом, отдаленно напоминающая клеточный рецептор для низкоплотностных липопротеинов, тогда как для вирусов подгруппы В — рецепторы семейства протеинов фактора некроза опухоли.
Репликация начинается с обратной транскрипции вирионной РНК в кДНК, с использованием 3’-конца тРНК в качестве праймера. Синтез кДНК сопровождается разрезанием вирусной РНК (за счет РНКазной активности обратной транскриптазы). Продукты гидролиза служат для первичного синтеза кДНК с негативной полярностью. Конечная форма двуспирального ДНК-транскрипта, образуемого из вирусного генома, содержит LTR, состоящие из последовательностей с 3’- и 5’-концов вирусной РНК, фланкирующих сиквенс (R), обнаруженный по обоим концам РНК. Процесс обратной транскрипции характеризуется высокой частотой рекомбинации. Ретровирусная ДНК интегрируется в хромосомную ДНК клетки, образуя провирус, при участии вирусного протеина интегразы (IN). Ретровирусы имеют собственные «предпочтения» при интеграции в геном "своих" хозяев. Интеграционные сайты для ВИЧ обнаружены в основном в активных транскрипционных участках. Для MLV приблизительно 25 % интеграционных актов происходят вблизи сайтов старта транскрипции и ассоциируются с CpG-островками, тогда как интеграция в пределах транскрипционных участков происходит редко. Этот же вирус удачно интегрируется с хромосомной ДНК у гиперчувствительных к ДНКазе I сайтов (DNase I — hypersensitive sites). Для ASLV характерна «беспорядочность» в выборе сайтов интеграции. Основная роль в выборе сайта интеграции для ретровируса закреплена естественным отбором за интегразой. Этот белок связывается со специфическим белком в близи сайта интеграции, инициируя интеграцию провируса в определенный участок хромосомной ДНК (Lewinski M. K et al., 2006). Карта интегрированного провируса колинеарна неинтегрированной вирусной ДНК. Интеграция предшествует вирусной репликации. Интегрированный провирус транскрибируется клеточной РНК полимеразой II в вирионную РНК и мРНК в ответ на транскрипционный сигнал в вирусных LTR. У вирусов некоторых родов транскрипция также регулируется вирусными трансактиваторами. В зависимости от вируса и генетической карты различают несколько классов мРНК. мРНК, включающая весь геном, служит для трансляции генов gag, pro, pol (расположенных в 5’-половине РНК), продуктом которых является полипротеин-предшественник, разрезаемый до структурных протеинов, полимеразы, обратной транскриптазы и интегразы, соответственно. Меньшие РНК, включающие 5’-конец генома, после сплайсинга с сиквенсом 3’-конца генома, и включающие ген env, участки U3 и R, транслируются в предшественники оболочечных протеинов. У вирусов, содержащих дополнительные гены, может происходить другой сплайсинг, но все такие РНК будут иметь общий 5’-концевой сиквенс. Спумавирусы уникальны в том, что могут использовать внутренний промотор, расположенный в гене env выше доступа к рамке считывания. Большинство первично транслированных продуктов представляют собой полипротеины, подвергающиеся протеолитическому разрезанию для приобретения функциональной активности. Продукты генов gag, pro и pol обычно являются вторичными после первичной трансляции продуктов. Для трансляции pro и pol используются обходные трансляционные терминирующие сигналы.
Сборка капсида происходит либо на плазматической мембране (вирусы большинства родов), либо вирусные частицы собираются в цитоплазме (Betaretrovirus и Spumavirus), и высвобождаются из клетки почкованием. Полипротеиновый процессинг внутренних протеинов происходит попутно или последовательно с созреванием вириона.
Онкогенные ретровирусы (Oncovirinae) — для онковирусов в отличие от ретровирусов других подсемейств, характерна способность размножаться в клетке, не повреждая ее жизнеспособности. Они легко становятся эндогенными и передаются вертикально, подобно обычным клеточным генам. К ним относятся вирусы лейкоза грызунов (MuLV); кошек (FeLV) и птиц (ALV); вирусы, тропные к лимфоцитам Т у человека (HTVL-1 и HTVL-2); вирус саркомы шерстистых обезьян (SSV-1) и ряд других. Большинство из них обладают выраженным онкогенным и нейротропным действием. Детально вирусы подсемейства Oncovirinae исследованы еще в 1960-1970-х гг. (см. работу Альштейна А. Д., 1982). Лентивирусы (Lentivirinae, «медленные вирусы») — в состав подсемейства входят экзогенные вирусы (с горизонтальной и вертикальной передачей) человека и многих других млекопитающих. О существовании родственных эндогенных вирусов сведений нет. Лентивирусы приматов отличаются по использованию хемокинового рецептора и протеина CD4. Некоторые группы проявляют перекрестную активность по антигенам Gag (лентивирусы овец, коз и кошек). Вирусы, родственные Feline immunodificiency virus (FIV), были выделены от других крупных кошачьих (например, Puma lentivirus), а наличие антител к антигену Gag у львов и других крупных кошачьих свидетельствует о существовании других вирусов, близких FIV и лентивирусам овец и коз. На основе различий по спектру восприимчивых хозяев лентивирусы были подразделены на 5 групп (лентивирусы приматов, овец и коз, лошадей, кошек и КРС). Внутри группы лентивирусов приматов HIV-1 отличается от HIV-2, прежде всего по дивергенции нуклеотидных сиквенсов, которая превышает 50 %, и по наличию у HIV-2 гена vpx (табл. 6).
Таблица 6. Семейство ретровирусов
Название вида вируса | Название на русском языке | № генома в | Аббревиатура Группа лентивирусов КРС Bovine immunodeficiency virus | Вирус иммунодефицита КРС | M32609 | BIV Группа лентивирусов лошадей Equine infectious anemia virus | Вирус инфекционной анемии лошадей | M16575 | EIAV Группа лентивирусов кошек Feline immunodeficiency virus (Petu) | Вирус иммунодефицита кошек (Петулума) | M25381 | FIV-P Feline immunodeficiency virus(Oma) | Вирус иммунодефицита кошек (Ома) | FIU56928 | FIVO Puma lentivirus (PLV-14) | Лентивирус пум (PLV-14) | PLU03982 | PLV
|
|||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 102; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.81.129 (0.015 с.) |