Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Система гуморального иммунитета
B-лимфоциты | Снижение числа плазматических клеток (CD23/CD62L; CD21^) — "- | Поликлональная активация B-лимфоцитов — "- | Нарастание спонтанной секреции иммуноглобулинов B-лимфоцитами — "- | Снижение секреции иммуноглобулинов B-лимфоцитами после стимуляции — "- | Нарастание уровней IgG, IgA, IgM — "- | Снижение синтеза специфических антител — "- | Снижение синтеза антител в ответ на вакцинацию против гепатита B, Haemophilus influenzae типа B, кори, гриппа — "- | Снижение титра уже имевшихся антител против дифтерии, столбняка, кори и Candida spp. Цитокины | Снижение продукции ИЛ-2, интерферона гамма — "- | Снижение продукции ИЛ-12 — "- | Снижение продукции интерферона альфа — "- | Нарастание продукции ИЛ- 1бета, ИЛ-6 и фактора некроза опухолей альфа — "- | Нарастание продукции ИЛ-10, трансформирующего фактора роста бета
Эта сводка отражает только сложность взаимодействия ВИЧ с клетками иммунной системы человека, и не более того. Перечисленные «нарушения» имеют разную природу и растянуты во времени на весь период болезни. Подробно о них можно прочитать в обстоятельных работах J. E. Bovis, K. James, 1992; Лысенко А. Я. с соавт., 1996; K. T. Copeland, Heeney, 1996; Е. Н. Шуваловой с соавт., 2001. Свою задачу я вижу в понимании их эволюционного смысла (см. ниже). Но сначала рассмотрим частный случай проявления ВИЧ-инфекции — образование «нейтрализующих антител». Их протективное действие — один из стереотипов восприятия учеными любых инфекционных процессов, сложившийся в начале прошлого века и дающий возможность бесконечно имитировать разработку ВИЧ-вакцин. Антигенные детерминанты ВИЧ. В-клеточные ответы на ВИЧ-инфекцию многообразны. У людей, инфицированных ВИЧ, обнаруживают антитела к его структурным (p17, p24, gp4l, gpl20) и регуляторным белкам (vif, nef, RT), а также аутоантитела. Основным изотипом синтезируемых антител является IgGI (более подробно см. у J. E. Bovis, K. James, 1992; и у Е. Н. Шуваловой с соавт., 2001). Основной антигенный раздражитель системы Т- и В-иммунитета, это, конечно, оболочечный шип (spike) ВИЧ. Он состоит из тримера гетеродимеров (trimer of heterodimers), сформированных двумя гликопротеинами, gp120 и gp41. Гликопротеин gp120 представляет собой высокогликозилированный белок, приблизительно половина массы которого составляют карбонгидраты, присоединенные к N-концу молекулы (Poignard P. et al., 2001). Анализ последовательностей различных изолятов ВИЧ позволил установить у gp120 вариабельные (V1-V5) и консервативные (С1-С5) регионы (рис. 48).
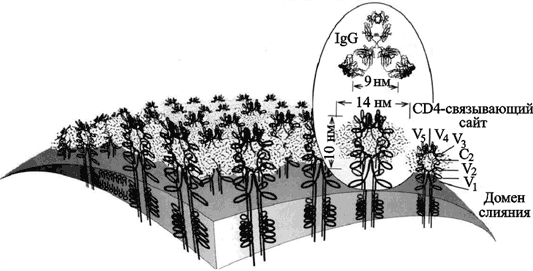
Рис. 48. Топография поверхности вириона ВИЧ-1
Оболочечные гликопротеины (gp120/gp41) изображены как тетрамерные олигомеры. Карбонгидратный комплекс, включающий преимущественно олигоманнозу, изображен в виде «облака» вокруг гликопротеина. Показано антитело (IgG), нейтрализующее ВИЧ. Оно не может взаимодействовать с gp120/gp41, потому что гликопротеин экранирован карбонгидратным комплексом. В то же время сайт связывания с рецептором CD4 Т-лимфоцитов остается открытым (Nara P. L. et al., 1991). Гликопротеины имеют рецепторный сайт для CD4-молекулы, определяющей тропизм ВИЧ к CD4 Т-клеткам; и второй сайт, связывающий вирус с хемокиновыми корецепторами, обычно с CCR5 и CXCR4. Поверхность кора gp120 закрыта карбонгидратами, а большая часть оставшейся неэкранированной молекулы вовлечена во взаимодействие с gp41 или с другими единицами gp120 в трехмерном шипообразном выступе оболочки. Относительно консервативный сайт связывания с CD4 «заглублен» и трудно доступен для антител. Консервативный корецепторный сайт является наиболее недоступным для антител на мономерном gp120. Роль gp120 в инфекционном процессе в основном заключается в связывании вируса с клетками-мишенями и обеспечении ему тесного соприкосновения с мембранами таких клеток. Трансмембранный белок gp41 играет ключевую роль на этой стадии взаимодействия вируса и клетки, так как он вызывает слияние вируса с мембраной клетки-мишени и доставляет генетический материал в ядро клетки. Этот белок относительно консервативен, но большая часть его поверхности скрыта от антител, распознающих шипообразные выступы оболочки (Zwick M. B. et al., 2004). Вариабельные последовательности оболочки ВИЧ концентрируются в оболочечных петлях (V1 — V4), которые и являются главными целями для нейтрализующих антительных ответов иммунной системы человека. В оболочку ВИЧ входят также несколько белков человека. Но их роль как антигенов, незначительна (более подробно об их участии в инфекционном процессе см. в подглаве 3.3).
Антитела с широким нейтрализующим действием. Здесь я сразу поясню, что в специальной литературе под ВИЧ-нейтрализующими антителами обычно понимаются те, которые нейтрализуют вирус в условиях in vitro. В условиях in vivo их действие очень сложно опосредовано, так как функция связывания с антигеном у антител не единственная. Более древней у них является эффекторная функция, т. е. способность передавать сигналы между клетками, взаимодействуя со специфическими рецепторами на их поверхности. Например, известны антитела-агонисты рецепторов DR4 или DR5, вызывающие апоптоз раковых клеток (см. Odoux C. et al., 2002). К эффекторным функциям относится и способность антител, связываясь с антигеном активировать каскад протеолитических реакций, осуществляемых системой комплемента (более подробно об эффекторных функциях антител см. в работе Ройта А. с соавт., 2000). К этим аспектам рассматриваемой проблемы я вернусь ниже, а пока нам надо условится о том, что в «чистом виде» феномен нейтрализации антителами ВИЧ или любого другого микроорганизма встречается только в эксперименте в условиях in vitro. Длительные исследования В-клеточных ответов на ВИЧ показали, что у людей появляются антитела, нейтрализующие доминирующий вариант вируса, но как только их уровень достигает определенного порога, селекционируется вариант вируса, способный избегать их нейтрализующее действие (Burton D. R. et al., 2005). Скорость появления как ВИЧ-нейтрализующих антител, так и избегающих их вирусов сильно варьируют у разных лиц, однако сам цикл многократно повторяется на протяжении жизни ВИЧ-инфицированного и больного СПИДом (Frost S. et al., 2005). Антитела, способные распознавать сразу несколько штаммов ВИЧ (антитела с широким нейтрализующим действием), появляются медленно и только у отдельных индивидуумов. Но так как их рассматривают уже в течение двух десятилетий в качестве средства для лечения и профилактики ВИЧ-инфекции, то локализация эпитопов на оболочке ВИЧ, вызывающих такие ответы, хорошо изучена (рис. 49).
Рис. 49. Локализация на оболочечных гликопротеинах ВИЧ/SIV эпитопов для антител с широким нейтрализующим действием
Модель шипа оболочки вируса основана на структуре gp120 с тремя мономерами гликопротеина; gp41 показан на схеме в виде ножки из трех трубочек (Burton D. R. et al., 2005).
Эпитоп для мАТ b12. Антитело распознает CD4-связывающий сайт на поверхности вируса. Хотя такие мАТ способны распознавать мономерный gp120, они его «не находят» на поверхности вируса, где он организован в тример. Эпитоп для мАТ CD4i. Антитело распознает корецепторный связывающий сайт на gp120. Этот рецептор предназначен для интеграции ВИЧ с корецепторами хемокинов CCR5 и CXCR4. Fab-фрагмент такого антитела, изолированный из фаговой библиотеки, показал нейтрализующую активность против нескольких первично выделенных штаммов ВИЧ-1. Однако интактные антитела (IgG) не оказывают такое действие на ВИЧ. Гликаны на «безмолвной» поверхности gp120. Исследования структуры кора gp120 показали локализацию N-гликанов на одной поверхности белка (Wyatt R. et al., 1998). Плотность карбонгидратного щита такова, что он защищает вирус от взаимодействия с антителами (см. рис. 47 и 48). Такая структура на поверхности gp120 была названа «безмолвной поверхностью» (silent face), что означает ее невосприятие системой Т- и В-иммунитета. Недавно было показано, что мАТ2G12 с высокой афинностью все же распознает этот пептидогликан (Scanlan C. N. et al., 2002). Был обнаружен ранее не охарактеризованный тип антитела, в котором два Fab-фрагмента IgG собраны в сцепленный VH-димерный домен. Экстраординарная конфигурация этого антитела обеспечивает обширное пространственное соответствие двух классических связывающих сайтов (VL–VH) и одного ранее не охактеризованного димерного межповерхностного региона (VH-VH) для мультивалентного взаимодействия с консервативным кластером олигоманнозы на gp120. Следовательно, хотя индивидуальные олигоманнозные цепи являются однородными, кластер олигоманнозы может рассматриваться как неоднородный. В настоящее время неизвестно, как часто возникают антитела такого типа у ВИЧ-инфицированных людей. По мнению D.R. Burton et al. (2005), это происходит весьма редко.
Мембрано-проксимальный внешний регион gp41 (membrane-proximal external region of gp41; MPER gp41). Большая часть поверхности gp41 скрыта от антител, за исключением региона, непосредственно прилежащего к вирусной мембране — MPER (Zwick M. B. et al., 2002). Уже описаны два типа человеческих мАТ — 2F5 и 4E10, распознающие эпитопы в этой области. Все попытки показать протективный эффект антител к пептидам, соответствующим этим эпитопам, оказались неудачными. Эти результаты предполагают, что антитела вовлекаются в распознание последовательностей пептидов gp41 в специальном контексте, таком как их близость к вирусной мембране. MPER богаты триптофаном, благодаря которому может возникать конформационное взаимодействие этого региона gp41 с вирусной мембраной. Эпитопы петли V3 gp120. V3-петля gp120 у разных изолятов ВИЧ варьирует по аминокислотным последовательностям. Но корона петли имеет относительно консервативный мотив GPGR или GPGQ, играющий важную роль при связывании вируса с корецептором (Hartley O. et al., 2005). До 90 % нейтрализующих антител к ВИЧ, циркулирующих в крови ВИЧ-инфицированного человека, специфичны к V3 (Profy A. T. et al., 1990). Этот эпитоп является единственным у ВИЧ, для которого показано доминирующее участие в развитии гуморального иммунного ответа как при естественной и при искусственной инфекции, так и после введения экспериментальному животному ВИЧ-вакцины на основе оболочечных белков вируса. Следовательно, его, как и белок L1 для ВНО, можно считать основной антигенной детерминантой для ВИЧ. Ниже мы остановимся на антигенных свойствах V3-домена gp120 более подробно.
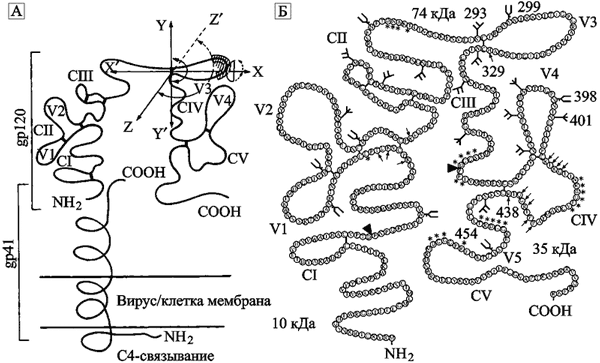
Антигенные свойства V3-домена gp120. Хотя он расположен в гипервариабельном регионе gp120 (т. е. с частыми аминокислотными заменами в первичной структуре этого участка молекулы), детальный аминокислотный анализ V3-домена сотен изолятов ВИЧ продемонстрировал его консервативность (LaRosa G. J. et al., 1990; Wolf T. F. et al., 1990). Домен играет важную роль в процессе проникновения ВИЧ в клетку. Корецепторы CCR5 и CXCR4 посредством V3-домена gp120 катализируют слияние вируса с мембраной клетки-мишени (Berger E.A. et al., 1999). Скорее всего, этим механизмом и поддерживается его «консервативность». Но с иммунологической точки зрения V3-домен оказался более сложным явлением, чем простой линейный эпитоп с такой же аминокислотной последовательностью. Изучение мутантов ВИЧ, избегающих нейтрализации антителами (neutralization escape mutants, NEN) в условиях in vitro, показало большое количество замен аминокислот молекулы gp120 как впереди, так и позади V3 (Wei X. et al., 2003). Исследование серийных изолятов ВИЧ-1 у людей и экспериментально инфицированных шимпанзе позволило выявить любопытную закономерность. Ранние NEN ВИЧ появлялись de novo у шимпанзе перед сероконверсией! Исследования возможности нейтрализации вируса сывороткой, полученной в это же время, обнаружили низкий титр нейтрализующих антител в отношении штамма ВИЧ, использованного для инфицирования шимпанзе. Полный сиквиенс-анализ gp120 у 8-, 16- и 32-недельных изолятов ВИЧ обнаружил множественные аминокислотные замены в доменах С IV и V4, и, что оказалось сюрпризом для исследователей, полную консервацию V3. NEN, выделенные от шимпанзе, в 8-32 раза более резистентны к V3-штаммоспецифическим мАТ и к V3-штаммоспецифической поликлональной сыворотке (Nara P. et al., 1991). Сходные результаты были получены при острой сероконверсии у людей (Albert J. et al., 1990). P. Nara et al. (1990, 1991) предложили шарнирно-сгибающую модель V3-домена, объясняющую данные по дистанционной конформационной нестабильности V3-домена применительно к NEN, полученным от шимпанзе. R. A. McCaffrey et al. (2004) представили в виде схемы расположение у молекулы gp120 консервативных регионов (CI–C5) и вариабельных петель (V1-V5) (рис. 50).
Рис. 50. V3-домен gp120 ВИЧ
Содержит эпитопы для штаммоспецифических нейтрализующих антител и определяет клеточный тропизм вируса. А. Трехосевая модель вращения и белкового фолдинга V3-домена, уменьшающих валентность его взаимодействия со специфическим антителом. V3-связывающий сайт показан штриховкой (Nara P. et al., 1991). Б. Схематическое расположение у молекулы gp120 консервативных регионов (CI–C5) и вариабельных петель (V1-V5) на примере последовательности штамма ВИЧ SF162. Показаны позиции и типы потенциальных N-связанных сайтов гликозилирования (символы снаружи цепи), треугольниками обозначены участки, по которым ледяная уксусная кислота (glacial acetic acid) расщепляет gp120 на три фрагмента (10, 35 и 74 kDa); стрелками снаружи V3-петли показаны аминокислоты, вовлеченные в корецепторное связывание, а звездочками обозначены аминокислоты, участвующие в связывании с CD4; кД — килодальтон (McCaffrey R.A. et al., 2004).
Подобный феномен нейтрализационной резистентности ранее был описан для близкородственных ВИЧ ретровирусов — вируса кошачьей лейкемии, вызывающего лейкемию у кошек (Nicolaisen-Strouss K. et al., 1987); и вируса висны, поражающего ЦНС овец (Stanley J. S., 1987). Позже было установлено, что конформационные эпитопы gp120 нарушаются и в результате изменений в первичной структуре gp41. Однако у таких мутантов ВИЧ оставались прежними способность связываться с рецепторами-мишенями и инфекционность (см. в работе V. Kalia et al., 2005). Специфичность V3-сайта может изменяться с помощью энзиматического гидролиза поверхностными клеточными эктопептидазами (рис. 51).
Рис. 51. Схема соответствия вирусных оболочечных детерминант и клеточных рецепторов, вовлеченных в связывание ВИЧ, его адсорбцию и слияние с клеткой.
V3-петля показана (слева) с известными на 1991 г. сайтами для нейтрализующих мАТ (9284; 05бета; 110,5) и сайтом, рассекаемым протеолитическими ферментами (Nara P. et al., 1991).
V3-домен рассекается клеточными эндопептидазами на два фрагмента — 70 и 50 kD и утрачивает способность связываться с V3-специфическими мАТ (Clements G. J. et al., 1991). Антигенные вариации функционально нейтрализуемых эпитопов могут изменять клеточный тропизм ВИЧ; его антигенные свойства и вирулентность. P. Nara et al. (1991) считают, что данный механизм лежит в основе способности ВИЧ приобретать тропность то к макрофагам, то к В- и Т-клеткам. Первичный антигенный грех при ВИЧ-инфекции (original antigenic sin, OAS). Этот очень интересный иммунологический феномен почему-то не нашел должного освещения в отечественной научной литературе. Возможно, отсутствие интереса к нему со стороны специалистов связано с тем, что применительно к ВИЧ он «ставит крест» на любых попытках создать ВИЧ-вакцину. Возможно, он просто неинтересен ученым, привыкшим к пониманию иммунных реакций по их схематическому изображению в учебниках. Суть феномена в следующем. В большинстве случаев антиген представляет собой несколько эпитопов, и поэтому он индуцирует синтез химически гетерогенных антител, различающихся своей специфичностью. Однако если клональность антигена ограничена, в его селекцию могут вмешиваться факторы хозяина. Отдельные карбонгидратные антигены, антигены со структурной и функциональной гомологией, индуцируют мало отличающиеся иммунные ответы (Briles D. E., Davie J. M., 1980). Но иммунная система позвоночного организма, иммунизированного одной такой антигенной детерминантой (первой) и позже экспонированная к другому антигену (второму), имеющему структурное сходство с первой детерминантой, отвечает не на вторую, а на первую. Этот феномен и называется «первичным антигенным грехом» (OAS). Феномен OAS впервые описан на примере иммунных ответов у людей на вирусы гриппа (Francis T., 1953) и различных представителей тога-, парамикс- и энтеровирусов (Fenner F. et al., 1974). При ВИЧ-инфекции он обнаружен P. Nara et al. (1991). Перечень иммунологических и физико-химических характеристик патогенов и их антигенных детерминант, способных вызывать OAS-подобный феномен, обнаруженных и предполагаемых для gp120 ВИЧ, приведен в табл. 14.
Таблица 14. Иммунологические и физико-химические характеристики патогенов и иммуногенных детерминант, способных вызывать OAS-подобный феномен, обнаруженные для gp120 ВИЧ [19]
Характеристики | gp 120 ВИЧ Ограниченность антигенных эпитопов | Да Большое количество карбонгидратов, экранирующих эпитопы; и/или ограниченные иммунодоминантные эпитопы | Да Перекрестно-реактивные детерминанты у семейств малосвязанных патогенов | Да Излишняя и олигомерная презентация эпитопов иммунной системе | Да Незначительные различия в аминокислотных последовательностях или в форме антигена и гомологичных белков хозяина (генетическая рестрикция) | Да Анамнестический ответ, наступающий вслед за введением гетерологичного антигена | Да Рекуррентная инфекция или бустинг вирусами или антигенами, увеличивающие гуморальный иммунный ответ к первоначальному инфекционному агенту или антигену | Да Пул длительно живущих клеток В-памяти | Да Олигоклональный сывороточный профиль | Да Преобладание клонально-производных В-клеток и популяций антител, специфичных для эпитопа |?
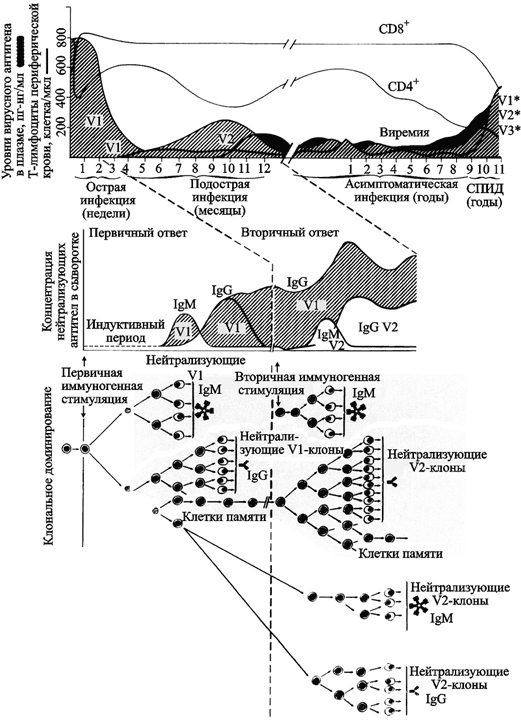
P. Nara et al. (1991) вышли на феномен OAS при ВИЧ-инфекции случайно. Первоначальной целью их экспериментов было расширение иммунного ответа на ВИЧ-вакцину на основе gp120 таким образом, чтобы нейтрализации антителами подвергались вирусы различного географического происхождения. Введя экспериментальным животным gp120, полученный из штамма ВИЧ-1 IIIB, они исследовали кинетику, напряженность и продолжительность штаммо-специфического иммунного ответа. Через 175 суток они начали вторую серию опытов по иммунизации животных gp120 штамма ВИЧ-1 RF, имеющего другое географическое происхождение. После примирующей иммунизации (7–14 суток) исследователи неожиданно для себя, так как они основывались «на представлениях о штаммоспецифическом гуморальном ответе на ВИЧ», обнаружили рост титров антител к gp120 штамма IIIB. Проведенный ими ретроспективный анализ научной литературы показал, что феномен OAS уже был описан для других ретровирусных инфекций, в частности, вызываемых вирусом висны у овец (Narayan O. et al., 1978) и вирусом инфекционной анемии у лошадей (Kono Y. et al., 1971). На основе собственных данных и данных, накопленных в научной литературе, они предложили следующую модель OAS-феномена при ВИЧ-инфекции у людей (рис. 52).
Рис. 52. Модель феномена «первичного антигенного греха» при ВИЧ-инфекции у людей, вызванного презентацией иммунной системе V3-домена gp120
Заштрихованная область, обозначенная как V1 (не путать с названием антигенного домена), соответствует вирусной нагрузке, образовавшейся в результате первичной клональной экспансии инфицирующего вирусного генома. Тесно связанные с ним варианты, способные избегать нейтрализующие антитела, обозначены как V2. Индукция последующих антительных нейтрализующих ответов показана на нижних двух панелях. Нейтрализующие антитела появляются вследствие индукции V3-специфических клонов В-клеток, которые продолжают экспансию из-за перекрестной реактивации близкими вариантами вируса, т. е. V2 (Nara P. et al., 1991).
Эта модель объясняет крайнюю неэффективность гуморального ответа на ВИЧ, если, конечно, понимать термин «иммунный» буквально, как «защищенный от всех антигенно чужеродных веществ» (см., например, учебник В. Г. Галактионова, 2005). P. Nara et al. (1991) получили любопытные данные по развитию ВИЧ-инфекции и гуморальных иммунных ответов у шимпанзе, уже иммунизированных вакциной на основе gp120 IIIB (рис. 53).
Рис. 53. Влияние gp120 IIIB-иммунизации на последующие ответы системы В-клеточного иммунитета на ВИЧ
Верхняя панель (А) показывает динамику титров нейтрализующих антител на ВИЧ IIIB (круги, закрашенные черным цветом), RF (черные квадраты) и 6- и 16-недельные вирусные изоляты из лимфоцитов этих животных (круги с точкой в центре и круги без точек, соответственно). На нижней панели (Б) показаны иммунные ответы животных, предварительно иммунизированных gp120 IIIB. Символы те же, что и на А (Nara P. et al., 1991).
Они показывают следующее: во-первых, у иммунизированных животных ВИЧ-инфекция все же развивается, но иммунная реакция на ВИЧ у них наступает быстрее и развивается более интенсивно; во-вторых, иммунная реакция на введение 6- и 16-недельных штаммов ВИЧ, имитирующих изменчивость вируса во время инфекционного процесса, развивается менее интенсивно, чем в контроле. При этом проявляется феномен OAS по отношению к штамму ВИЧ, gp120 которого был использован для иммунизации. Следовательно, сходство иммунных ответов на введение ВИЧ-вакцины и противооспенной вакцины (вирус вакцины) только внешнее — и на ту, и на другую образуются антитела. В деталях эти процессы различаются до такой степени, что становятся антиподами. Комплемент. Антитела к ВИЧ синтезируются клонами В-клеток почти до самой смерти больного СПИДом. В-клетки, в отличие от Т-клеток, менее подвержены инфицированию ВИЧ. На первый взгляд их роль в инфекционном процессе пассивная: они всего лишь связывают вирусные частицы на своей поверхности посредством рецептора комплемента CD21 и тем самым играют роль внеклеточного резервуара ВИЧ. Да еще В-клетки синтезируют бесполезные антитела, которые вроде бы должны нейтрализовать ВИЧ, но из-за «коварства» последнего ("ВИЧ постоянно меняется") не могут выполнить это свое предназначение. Попробуем понять роль комплемента и антител к ВИЧ в вызванном им инфекционном процессе. В соответствии с представлениями о роли иммунной системы в защите макроорганизма от патогенных микроорганизмов, сложившимися в начале ХХ столетия и до сегодняшнего дня кочующими из учебника в учебник, комплемент должен контролировать ВИЧ-инфекцию. Тем более что процесс развивается медленно, не сопровождается симптомами шока (как, например, это происходит при натуральной оспе или чуме). Но, как оказалось, плазма крови человека усиливает инфекционность ВИЧ. По данным S. Wu et al. (1995), в условиях in vitro все четыре выделенных ими штамма ВИЧ, инкубированные с плазмой крови неинфицированного ВИЧ человека, увеличивали свою инфекционность от 3 до 30 раз в отношении мононуклеарных клеток и моноцит-производных макрофагов. В более детальных исследованиях C. Pinter et al. (1995) установлено непосредственое связывание СI-домена gp120 ВИЧ (см. рис. 50) с фактором Н комплемента (негативный регулятор активности комплемента, синтезируется макрофагом) и увеличение формирования синтиция CD4-зависимым образом. Далее исследователями показано участие фактора Н и еще какого-то неизвестного фактора крови в защите ВИЧ и инфицированных им клеток от лизиса. Такая функция комплемента при ВИЧ инфекции противоречит тому, что пишут о ней в классических руководствах по иммунологии. Например, А. Ройт с соавт. (2000) относят комплемент к системе врожденного иммунитета, способного распознавать «своих» и «чужих» и вызывать опсонизацию микроорганизмов, активацию фагоцитирующих клеток и лизис клеток мишеней. Это действительно так и происходит, когда система комплемента реагирует на ортопоксвирусы. Оба, классический и альтернативный, пути активации комплемента усиливают нейтрализацию вируса вакцины антителами в условиях in vitro и ускоряют процесс освобождения организма от вируса в условиях in vivo (см. обзорную работу R. M. L. Buller, G. J. Palumbo, 1991). Получается, что для системы комплемента человека ВИЧ является «своим», а ВНО «чужим». Феномен антителозависимого усиления инфекции (antibody-dependent enhancement, ADE; immune enhancement of disease) при ВИЧ-инфекции. Антитела — связующее звено приобретенного иммунитета с комплементом (классический путь активации комплемента). Для ВИЧ-инфекции их «связь» проявляется феноменом антителозависимого усиления инфекции (ADE). Суть феномена заключается в следующем — вирусспецифические антитела усиливают проникновение вируса в фагоцитирующие клетки и в отдельных случаях его репликацию в этих клетках посредством взаимодействия с рецептором Fc и/или рецепторами комплемента фагоцитирующих клеток. Fc-рецептор (FcR) экспрессируется фагоцитирующими клетками для взаимодействия с иммуноглобулином G (Tirado S. M., Yoon K. S., 2003). Поэтому феномен наблюдается в двух вариантах: а) комплемент-опосредованное антителозависимое усиление инфекции (complement-mediated ADE; C-ADE); и б) независящее от комплемента и связанное с Fc-рецептором усиление инфекции (Fc-receptor-mediated ADE; FcR-ADE). Как правило, специалисты с медицинским образованием плохо знакомы с данным феноменом. Его описание не включается в учебники для медицинских ВУЗов. Поэтому здесь мы его рассмотрим более широко, чем это необходимо для понимания течения ВИЧ-инфекции. Любой вирусный антиген содержит несколько эпитопов, и на каждый из них иммунная система может вырабатывать антитела. Поэтому сыворотка пациента с развившимся инфекционным процессом содержит смесь антител: а) нейтрализующих возбудитель инфекционной болезни в присутствии комплемента; б) нейтрализующих возбудитель инфекционной болезни без комплемента; в) усиливающих инфекционный процесс посредством увеличения адгезии возбудителя инфекционной болезни к фагоцитирующим клеткам через FcR (для клеток, содержащих FcR; феномен FcR-ADE); г) усиливающих инфекционный процесс FcR-независимым образом, однако зависимым от комплемента (и его рецептора; феномен C-ADE) — для клеток, содержащих рецепторы комплемента; д) усиливающих активацию вирусных белков путем изменения их конформации; е) супрессирующих антивирусные ответы клетки на транскрипционном уровне; ж) оказывающих токсическое воздействие на клетку. Репертуар этих антител варьирует в зависимости от вируса, состояния иммунной системы и стадии инфекционного процесса (Takada A., Kawaoka Y., 2003). Для того чтобы антитело могло нейтрализовать вирус, оно должно блокировать ключевую функцию белка вирусной оболочки, например, связывание вируса с рецептором-мишенью, его способность к слиянию с клеткой и т. п. (рис. 54, А); либо вызвать его лизис или опсонизацию путем активации классического пути комплемента. Но когда конформация комплекса антитело-вирусный белок позволяет Fc-фрагментам антител взаимодействовать с Fc-рецептором, то антитела образуют мост между вирусом и Fc-рецептором на поверхности фагоцитирующей клетки, облегчая оболочечному вирусу взаимодействие со специфическим рецептором на ее поверхности (рис. 55, А и рис. 54, В). Безоболочечным вирусам (non-enveloped viruses), образовавшим комплекс с антителом, способным взаимодействовать с Fc-рецептором, специфические рецепторы на поверхности клетки-мишени не требуются (Takada A., Kawaoka Y., 2003).
Рис. 54. Зависимость феноменов нейтрализации вирусов и усиления инфекции от концентрации специфических антител
А. Нейтрализация вируса специфическими антителами. Если большинство функциональных сайтов вирусных белков блокировано антителами (левая панель), то при высоких концентрациях антител проникновение вируса в клетку ингибируется независимо от типа антител (нижняя правая панель). Б. Повышение инфекционности вируса специфическими антителами. Когда Fc-фрагмент нейтрализующего антитела оказывается способным связываться с FcR или C1q (левая панель), антитела могут усиливать инфективность вируса (virus infectivity) в субнейтрализующих концентрациях, при которых свободные вирусные белки могут вызывать проникновение вируса в клетку (нижняя правая панель). При высоких концентрациях нейтрализующих антител, связывание вируса с клетками происходит посредством Fc-фрагмента нейтрализующего антитела. C1q — субъединица белка комплемента С1. В составе молекулы C1q имеется рецептор для связывания с Fc-фрагментом молекулы антитела (за основу взята схема Takada A., Kawaoka Y., 2003).
Подобным же образом С1 (компонент комплемента; его субъединица C1q имеет рецептор для связывания с Fc-фрагментом молекулы антитела) может связывать Fc-фрагмент антитела, инициируя классический путь активации комплемента, в результате чего активируется компонент комплемента С3, ковалентно (!) связывающийся или с антителом или с поверхностью вирусной частицы (рис. 55, В).
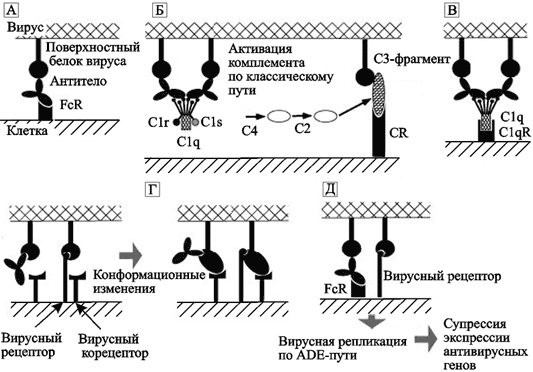
Рис. 55. Возможные механизмы развития феномена ADE для вирусных инфекций
А. Взаимодействие между антителом и FcR.В. Фрагмент С3 комплемента (компонент комплемента, после присоединения которого весь этот комплекс приобретает способность прилипать к различным частицам и клеткам) и рецептор комплемента (complement receptor; CR) промотируют присоединение вируса к клетке. С. Белки комплемента С1q и С1qR промотируют присоединение вируса к клетке (в составе молекулы C1q имеется рецептор для связывания с Fc-фрагментом молекулы антитела).D. Антитела взаимодействуют с рецептор-связывающим сайтом вирусного белка и индуцируют его конформационные изменения, облегчающие слияние вируса с мембраной. Е. Вирусы, получившие возможность реплицироваться в данной клетке посредством ADE, супрессируют антивирусные ответы со стороны антивирусных генов клетки (по Takada A., Kawaoka Y., 2003).
Образовавшийся комплекс способен взаимодействовать с рецепторами комплемента на поверхности клетки посредством С3, усиливая взаимодействие вируса с клеткой. Альтернативно C1q-субъединица непосредственно может перекрестно связывать вирусный белок и C1q-рецепторы (C1qR) на поверхности фагоцитирующих клеток (см. рис. 55, С). Все перечисленные эффекты находятся в зависимости от концентрации антител (см. рис. 54). Феномен ADE впервые описан R. A. Hawkes в 1964 г., обнаружившим повышение продукции различных флавивирусов (японского энцефалита, энцефалита долины Мюррей и др.) в клетках куриного эмбриона, впервые экспонированных к вирусам, находящимся в среде с низким содержанием специфических антител. Несколько лет эти данные считались исследователями артефактом, но потом они были многократно подтверждены в различных лабораториях (Porterfield J. S., 1986; Tirado S. M., Yoon K. S., 2003). Систематически феномен ADE изучается с 1980-х гг. Для ВИЧ он показан W. E. Robinson et al. (1988) и J. Homsy et al. (1989). На рис. 55 показаны возможные механизмы развития феномена ADE для вирусных инфекций. Общие особенности вирусов, вызывающих феномен ADE, следующие: а) обычно такие вирусы реплицируются в макрофагах; б) они индуцируют продукцию большого количества антител с плохой способностью к нейтрализации гомологичных вирусов; в) способны к персистентной инфекции, характеризующейся продолжительной виремией (Tirado S. M., Yoon K. S., 2003). В основном этот феномен проявляется в ответ на образование антител изотипа IgG1 (Henchal E. A. et al., 1985). У людей имеются три типа рецепторов Fc, которые связывают человеческие IgG: F cy RI, F cy RII и F cy RIII (CD16). F cy RI наиболее представлен на моноцитах/макрофагах человека, и он связывает IgG с наибольшей авидностью. Поэтому ему принадлежит «лидерство» среди других рецепторов макрофагов в реализации феномена ADE (Cancel S. M., Kyoung-Jin Y., 2002). Наиболее важным эпитопом оболочечного белка ВИЧ для развития C-ADE у ВИЧ-инфицированных людей является иммунодоминантный регион gp41. Развитие FcR-ADE происходит благодаря антителам к V3-петле gp120 (Fust G., 1997). У ВИЧ-инфицированных людей соблюдается определенная очередность проявления вариантов развития ADE. На ранней стадии инфекции феномен реализуется через V3-петлю gp120 (по типу FcR-ADE), по типу C-ADE феномен начинает проявляться перед клиническим прогрессированием ВИЧ-инфекции (Thomas H. I. et al., 1996). G. Fust (1997) кратко суммировал клиническое значение феномена ADE для ВИЧ — это прогрессирование инфекции; и облегчение переноса вируса от матери к плоду (см. подглаву 2.3 «Сборка» многоклеточных организмов»). Любопытны исследования результатов вакцинации против вирусов, персистирование которых в организме человека или животного сопровождается феноменом ADE. В подробной сводке S. M. Tirado и K. S. Yoon (2003), обобщивших результаты вакцинации животных против вирусов Денге, респираторного синтициального вируса, вируса лейкоза кошачьих, вируса Алеутской болезни норок, отдельных лентивирусов, приводятся экспериментальные доказательства увеличения восприимчивости животных к инфицированию тем вирусом, против которого их иммунизировали. Инфекционная анемия лошадей. Это лентивирусная инфекция лошадей, проявляющаяся синдромами лихорадки, анорексии, анемии и имеющая возвратное циклическое течение в первый год после инфицирования. В последующем болезнь приобретает асимптоматическое течение, или у животного развивается сидром хронической слабости. С целью моделирования стратегий вакцинации против ВИЧ были проведены исследования по оценке эффективности вакцин против вируса инфекционной анемии лошадей (equine infectious anemia virus, EIAV) (Issel C. J. et al., 1992; Wang S. Z. et al., 1994). Они показали серьезное обострение болезни у вакцинированных лошадей и пони, как следствие присутствия антител, индуцированных введением вакцины. C. Isel at al. (1992) использовали виремию как критерий тяжести болезни и продемонстрировали, что инактивированная цельновирионная вакцина не может предотвратить развитие виремии у животного, которому введен вирулентный штамм вируса. Такая вакцина не смогла предотвратить развитие клинических симптомов болезни у пони, инфицированных EIAV. В экспериментах по заражению гетерологичным штаммом вируса животных, вакцинированных высокоочищенным оболочечным гликопротеином вируса, не удавалось ни предотвратить виремию, ни развитие клинических симптомов болезни. В последующем S. Wang et al. (1994) провели масштабные эксперименты на пони и лошадях по оценке защитной эффективности рекомбинантной вакцины, полученной на основе поверхностного гликопротеина EIAV. Результаты экспериментов показали усиление инфекции у всех предварительно вакцинированных животных. Иммунодефицит кошек. Ретровирус (feline immunodeficiency virus, FIV), возбудитель этой болезни, так же как и вирус инфекционной анемии лошадей, рассматривался в 1990-х гг. учеными в качестве модели для моделирования исследований эффективности вакцинации против ВИЧ (Bendinelli M. et al., 1995; Jarrett O. et al., 1990). После инфицирования FIV, у кошек, вакцинированных оболочечным рекомбинантным белком вируса, виремия обнаруживалась даже раньше, чем у невакцинированных животных (Radkowski M.T. et al., 1993). В сходных исследованиях с различными рекомбинантными FIV-вакцинами было установлено, что в крови животных в ответ на вакцинацию обнаруживаются антитела к оболочечному белку (env) вируса, плохо нейтрализующие вирус в условиях in vitro. У вакцинированных животных вирусная нагрузка была значительно большей, чем у невакцинированных (Baldinotti F.D. et al., 1994; Huisman W. et al., 1998). M.J. Hosie et al. (1992) продемонстрировали усиление клинических признаков болезни у кошек при росте титров антител к коровому белку (core protein) FIV.
|
|||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 75; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.129.100 (0.073 с.) |