Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Болезни эндогенной ретровирусной активности»
Инфицирование ретроэлементами генома таксона. Эпидемиология не-LTR-ретроэлементов. Эпидемиология LTR-ретроэлементов. Суперантигенные свойства HERV и многокомпонентные нециклические инфекционные процессы.
Патологические последствия взаимодействия эндогенных ретровирусов и ретроэлементов с экзогенными ретровирусами, имеющие место в масштабе жизни отдельного человека, кратко охарактеризованы в разд. 3.3. Ниже я изменю масштаб времени рассматриваемой проблемы с жизни отдельного человека, до жизни его как вида, т. е. до временных интервалов, в которые дают о себе знать эволюционные процессы. Инфицирование ретроэлементами генома таксона. Также как у микроорганизмов-паразитов, у паразитических ретроэлементов есть свои излюбленные территории (в геноме хозяина, разумеется), где они существуют миллионы лет, притом что виды их хозяев меняются. LTR-ретроэлементы равномерно распределены между AT- и GC-богатыми участками ДНК (AT- and GC-rich DNA). Но Alu-элементы (относятся к «не-LTR-ретроэлементам», классификацию ретроэлементов см. в разд. 1.2) «предпочитают» регионы, богатые по GC (GC-rich regions). Установлена строгая корреляция между плотностью активно транскрибируемых генов (что и отражает повышенное содержание GC) и плотностью Alu-элементов. Отдельные хромосомы, такие как 19-я, содержат большое количество Alu-элементов. Хромосома Y, наоборот, показывает нехарактерно низкую плотность Alu-элементов относительно содержания GC, что связывают с накоплением в этой хромосоме псевдогенов. В противоположность Alu, LINE аккумулируются в регионах, богатых AT (AT rich regions). Последние содержат меньшее количество транскрибируемых генов, чем богатые по GC участки ДНК. SINE, так же как и Alu, зависят от транспозиции в составе LINE. Однако их повышенное содержание в участках ДНК, богатых GC, пока непонятно (Nelson P. N. et al., 2004). Закономерности распределения по хромосомной ДНК интегрировавшихся с ней последовательностей ДНК, производных от HERV, еще на стадии изучения. Фиксация в пределах генома человека эндогенных ретровирусов коррелирует с генной плотностью (gene density, т. е. количеством генов на м. п. о.). Чем выше генная плотность в каком-то участке хромосомы, тем менее вероятно обнаружение в этом участке HERV или их «следов» виде solo-LTR. Достоверной корреляции фиксации эндогенных ретровирусов со скоростью рекомбинации в конкретном участке хромосомы не обнаружено (Katzourakis A. et al., 2007).
«Новые» ретроэлементы в геномах эукариотов проходят через этапы «взрывов амплификации» («bursts of amplification»), когда они активно амплифицируются в их геноме в течение нескольких десятков миллионов лет. Такой процесс, если его представить в виде графика вне масштаба времени, похож на показанный на рис. 68 для распространения эпидемий (эпизоотий) циклического типа и даже имеет фазу инфекции, которую по аналогии можно назвать носительством (когда ретроэлементы утрачивают способность к транспозиции, но сохраняются в геноме клетки). На рис. 88 показана приблизительная шкала времени формирования мобильных элементов в геноме современного вида человека.
Рис. 88. Временная очередность интеграции мобильных элементов, обнаруженных в геноме современного вида человека.
Общая шкала соответствует периоду эволюционной истории приблизительно в 120 млн лет, т. е. захватывает период господства рептилий. По оси Х показан процент замен различных вставочных последовательностей относительно их консенсусных последовательностей для генома современного вида человека. По оси Y — процент, который эти ретроэлементы составляют в геноме современного вида человека. Процент замен относительно консенсуса коррелирует с возрастом вставок. Чем он больше, тем древнее вставки. Ретроэлементы L2 и MIR утратили активность более 120 млн лет назад. Большинство из «недавно» проявивших активность ретроэлементов составляют L1 и Alu. «Пик» их размножения в эволюционно предшествующих человеку видах имел место 60 млн лет назад. В последние несколько десятков миллионов лет наблюдается снижение их активности. По Р. Deininger, М. Batzer (2002)
MIR и L2-элементы имеют более раннее происхождение, чем L1 и Alu. Весь период эволюционной истории ретроэлементов, отраженный на рисунке, MIR и L2 не были активны. Вероятно и то, что MIR относились к SINE-элементам, зависящим от активности L2. Иначе говоря, они имеют эволюционные параллели друг с другом. Взрыв активности ретроэлементов соответствует интродукции в геном нового ретроэлемента. Обратная транскрипция и клеточные механизмы рекомбинации ДНК создают условия для эволюции ретроэлементов в уже существующих видах (рис. 89).
Рис. 89. Возможная модель эволюции ретроэлементов в геноме эукариотического вида. По R. Lower et al. (1996)
Стрелкой с точками показана генерация генетических элементов через обратную транскрипцию. Сплошными стрелками показано приобретение ретроэлементами новых элементов через рекомбинацию. P — промотор; AAAA — поли(А) — хвост; ► — прямой повтор (клеточная ДНК); J — сайт связывания праймера; Ψ — пакующий сигнал; * — полипуриновый участок (polypurine tract)
Чем более быстро амплифицируется ретроэлемент, тем большее количество копий он образует в геноме хозяина, которые, в свою очередь, вовлекаются в репликацию и транспозицию. Эта тенденция оказывает негативное влияние на жизнеспособность организма вследствие вставочного мутагенеза, неправильных рекомбинационных актов между «рассеянными» по геному ретроэлементами, делеций ДНК и других процессов, вызванных транспозиционной активностью ретроэлементов.
Эпидемиология не-LTR-ретроэлементов. В геноме современного человека активны два представителя данного семейства ретроэлементов: короткие вставочные элементы (short interspersed elements, SINE) с преобладанием Alu-повторов; и длинные терминальные вставочные повторы (long-terminal interspersed elements, LINE), представленные автономными L1-последовательностями. Их описание приведено в разд. 1.2. LINE-1 (L1) продолжают распространяться по геному современного вида человека — примерно одна новая вставка на каждые 10–250 индивидуумов. L1-транспозоны вызывают у людей болезни по разным механизмам, включающим неправильную гомологичную рекомбинацию участков ДНК хромосом; прямые вставки L1 в гены; обеспечение вставок других ретротранспозонов в гены и др. (см. рис. 9). LINE-1 участвуют в ретротранспозиции Alu-элементов. В табл. 27 обобщены сведения по патологическим процессам, вызываемым перемещениями по геному человека L1.
Таблица 27. Патологические процессы, вызываемые перемещением по геному человека L1 [34]
Вставочный элемент[35] | Разрушенный ген/болезнь | Размер вставки | 3’-трансдукция (есть или нет)[36] | Сайт вставки | Ориентация вставки JH-27 | Фактор VIII/гемофилия | 3,8 кб. | Нет | Экзон | Смысловая JH-28 | Фактор VIII/гемофилия | 2,2 кб. | Нет | Экзон | Смысловая и переставленная JH-25 | Фактор VIII/гемофилия | 681 нт. | Нет | Интрон | Смысловая APC | APC/аденоматозный полипоз кишечника | 538 нт. | Есть | Экзон | - Dystrophin | Dystrophin/мышечная дистрофия | 608 нт. | Нет | Экзон | Смысловая Dystrophin | Dystrophin/мышечная дистрофия | 878 нт. | Нет | Экзон | Смысловая JH-1001 | Dystrophin/мышечная дистрофия | 2,0 кб. | Есть | Экзон | Смысловая и переставленная L1бета-thal | бета-глобин/бета-талассемия | 6,0 кб. | Нет | Интрон | Антисмысловая L1XLCDM | Дистрофин/ | 524 нт. | Нет | Экзон | Антисмысловая L1RP | RP2/пигментированный ретинит | 6,0 кб. | Нет | Интрон | Антисмысловая L1CYB | CYBB/хронический гранулематоз | 1,7 кб. | Есть | Экзон | Смысловая и переставленная L1CYB | CYBB/ хронический гранулематоз | 940 нт. | Нет | Интрон | Смысловая L1FCMD | Fukutin/Fukuyama-type мышечная дистрофия | 1,1 кб. | Нет | Интрон | Сайта-мишени для дупликации нет, делеция в 7 нуклеотидов L1FIX | FIX/Гемофилия В | 520 п. о. (460 п. о. от L1) | Нет | Экзон | Смысловая
Из четырнадцати вставок, систематизированных в табл. 27, двенадцать представляют собой «усеченные» L1-элементы длинной от 50 п. о. до 3,8 кб. Три из четырнадцати вставок ассоциированы с трансдукцией 3’-фланкирующих последовательностей. Из тринадцати, вызвавших болезнь вставок L1, девять приходится на экзоны и, вероятно, они представляют собой вставки несмысловых кодонов в кодирующие последовательности или вызывают «перестановку» разрушенных экзонов. В четырех случаях вставки L1 в интроны вызвали «пропуск экзонов» (exon skipping), подавление транскрипции или снижение стабильности ервичного транскрипта. Например, вставки L1 в интрон гена фукутина (fukutin gene), обнаруженные у пациента с мышечной дистрофией Fukuyama-типа, и в интрон CYBB-гена у пациентов с хроническим гранулематозом, привели к альтернативному сплайсингу мРНК этих генов. Вставки полноразмерного L1 в интрон гена бета-глобина у пациентов с бета-талассемией и в ген RP2 у пациента с ретиноидным пигментозом (retinitis pigmentosa) привели к блокированию у них синтеза мРНК соответствующих генов. В тринадцати из четырнадцати описанных в табл. 27 патологических процессов, L1-вставки имели место уже в зародышевой линии, однако такая хронология появления вставок не является правилом. Они могут происходить и в соматических клетках. Например, это установлено для случаев, когда вставка L1 в экзон адематозного полипоза кишечника (adenomatous polyposis coli, APC) привела к раку толстого кишечника (Ostertag E. M., Kazazian H., 2001). Alu-элементы. Распространение Alu-элементов в популяциях современного вида человека продолжается. Их число продолжает расти, и они встраиваются во все новые сайты с частотой примерно одно новое встраивание на 100–200 новорожденных (Аст Г., 2005), увеличивая риск развития патологических процессов, наследуемых по законам Менделя. Сведения по патологическим процессам, вызываемым перемещениями по геному человека Alu-элементов, обобщены в табл. 28.
Таблица 28. Патологические процессы, вызываемые перемещением по геному человека Alu-элементов [37]
Ген | Болезнь | Субсемейство Alu | Инсерционный сайт | Ориентация | De novo (да или нет) NF1 | Нейрофиброматоз | Ya5 | Интрон | Антисмысловая | Да BCHE | Ахолинэстеразомия | Экзон | Смысловая | Нет F9 | Гемофилия В | Ya5 | Экзон | Смысловая | Да CASR | Семейная гипокальйурическая гиперкальцемия | Ya4 | Экзон | Антисмысловая | Нет BRCA2 | Рак груди | Y | Экзон | Смысловая | Нет
APC | Наследственная десмоидная болезнь[38] | Yb8 | Экзон | Смысловая | Нет BTK | Х-связанная агаммаглобулинемия | Y | Экзон | Антисмысловая | Да IL2RG | Х-связанный тяжелый комбинированный иммунодефицит | Ya5 | Интрон | Антисмысловая | Нет EYA1 | Бранхио-ото-ренальный синдром | Ya5 | Экзон | Антисмысловая | Да FGFR2 | Синдром Аперта | Ya5 | Интрон | Антисмысловая | Да FGFR2 | Синдром Аперта | Yb5 | Антисмысловая | Да ADD1 | Болезнь Хангтингтона | - | Интрон | Смысловая | Нет GK | Дефицит глицеролкиназы | Ya5 | Интрон | Антисмысловая | Нет C1NH | Дефицит ингибитора С1 | Y | Интрон | Смысловая | Нет PBGD | Острая интермиттентная порфирия | Ya5 | Экзон | Антисмысловая | Нет MIVI-2 | Ассоциируют с лейкемией | Ya5 |? |? | Да FIX | Гемофилия В | Ya3al | Экзон | Антисмысловая | Нет FIX | Гемофилия В | - | Экзон | Смысловая | Нет RVIII | Гемофилия А | Yb8 | Экзон | Антисмысловая | Нет KIND1 | Синдром Киндлера | YaSx | Экзоны | Делеция | Нет MEN1 | Множественная эндокринная неоплазия I типа[39]| Alu-повтор | Экзоны и интроны | Делеция | Да
Механизм развития патологического процесса, вызванного перемещением по геному человека Alu-элементов, рассмотрим на примере развития синдрома Киндлера (KS) — редко встречающейся аутосомно-рецессивной болезни, характеризующейся кожными поражениями в виде волдырей (skin blistering), фотосенсибилизацей и прогрессирующей пойкилодермией. Большинство случаев KS — результат мутации в гене KIND1, кодирующем белок киндлин-1 (kindlin-1), компонент фокальной адгезии в кератиноцитах (focal adhesions in keratinocytes). Ген KIND1 картирован на хромосоме 20p12.3, его протяженность 48,5 кб., состоит из 15 экзонов. Физиологические функции кодируемого им белка известны не полностью. Делеция, вызвавшая развитие синдрома у 4 пациентов, имеет протяженность 3,9 кб. Она захватывает экзоны 10 и 11 KIND1, что приводит к синтезу клеткой усеченной молекулы мРНК киндлина-1 и вызывает развитие характерных для KS кожных поражений (рис. 90).
Рис. 90. Делеция экзонов 10 и 11 KIND1 и кожные поражения, характерные для синдрома Киндлера
А. Обилие повторяющихся элементов в пределах интронов 9 и 11 KIND1. Ориентация и тип повторяющихся последовательностей показаны кончиком стрелки, размер которой пропорционален длине соответствующего повтора. Две AluSx-последовательности вовлечены в делецию протяженностью 3,9 кб.(показаны кончиками стрелок серого цвета). Делеция вложена в повторы AluSx, что свидетельствует о рекомбинации между гомологичными участками Alu.Б. Клинические признаки и результаты биопсии кожи у больных с KS: 1) признаки пойкилодермии на коже шеи и ниже уха; 2) атрофия кожи, проявляющаяся тем, что кожа на дорсальной поверхности руки пациента напоминает сигаретную бумагу (сigarette paper-like atrophy); 3) ультраструктурный анализ кожи пациента с KS, показывающий редупликацию lamina densa (стрелки). Черная линия соответствует 0,85 мк. По С. Has et al. (2006)
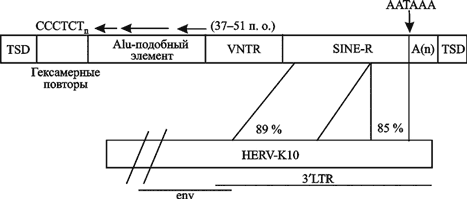
SVA-элементы впервые описаны как новые ретротранспозоны, производные от эндогенного ретровируса человека HERV-K10 (Ono M. et al., 1987). Авторы заметили, что такой элемент заканчивается в А-богатой последовательности и фланкирован сайтами целевой дупликации (targetsite duplications, TSDs). Вторая группа исследователей описала SINE-Rпоследовательность среди последовательностей, образующих ген комплемента человека C2, ассоциированный с локусом вариабельных по количеству тандемных повторов (variable-number-of-tandem-repeats, VNTR) (Zhu Z. et al., 1992). Эта последовательность и другая сходная последовательность в пределах гена HLA-RP1 (STK19) были в последующем анализированы третьей группой исследователей, которые описали их как SINE-R и VNTR-последовательности, ассоциированные с Alu-подобной последовательностью и периодически обнаруживаемые среди гексамерных повторов (Shen L. et al., 1994). Для обозначения полной структуры такого композитного ретротранспозона, фланкированного TSD, L. Shen et al. (1994) предложили использовать термин «SVA» (SINE-R, VNTR и Alu). Структура полноразмерного SVA-элемента и последовательность транспозиционных актов, приведших к разрушению гена альфа-спектрина de novo, показаны на рис. 91 и 92 соответственно.
Рис. 91. Структура полноразмерного SVA-элемента
Большинство таких ретроэлементов в геноме человека фланкировано через L1-подобные TSD. 5ґ-конец SVA-элемента полной длины состоит из вариабельного количества (CCCTCT) — гексамерных повторов, следующих за последовательностью, гомологичной антисмысловой последовательности Alu-подобного элемента (стрелка соответствует приблизительно области гомологии), VNTR-регионом, SINE-R-регионом и AATAAA poly A-сигналом, следующим сразу за poly A-хвостом, обозначенным на схеме как A(n). SINE-R-последовательность связана с 3ґLTR-последовательностью HERV-K10 (регионы идентифицированы и процент тождественности указан). По Е. Ostertag et al. (2003)
Рис. 92. Последовательность SVA-ретротранспозиционных актов при поражении гена a -спектрина (SPTA1)
Полноразмерный SVA-элемент неизвестного происхождения ретротранспозировал в пустой сайт на хромосоме 4 (первый транспозиционный акт). После нескольких ретротранспозиционных актов он вставился в экзон 5 гена a-спектрина на хромосоме 1. Однако интеграционный процесс привел к «усечению» 5ґ-конца SVA-элемента и его инверсии в сравнении с положением предшественника в хромосомах 3 и 4. РНК соответствует прерывистая линия, ДНК — сплошная. Ген SPTA1 «пропускается» при транскрипции. В результате такой мутации у человека развивается наследственный эллиптоцитоз. По Е. Ostertag et al. (2003)
Из четырех SVA-вставок, вызывающих болезни у людей, две обнаружены в экзонах и приводят к их «пропуску» при транскрипции мРНК. Так происходит «выключение» генов BTK и SPTA1 (см. рис. 92). В первом случае у человека развивается Х-связанная агаммаглобулинемия (X-linked agammaglobulinemia); во втором — наследственный эллиптоцитоз (hereditary elliptocytosis). Две других мутации ассоциированы с резким снижением уровня экспрессии мРНК соответствующих генов: ARH и FCMD. В обоих случаях SVA-вставки имеют значительный размер (2600 и 3062 п. о. соответственно) (Chen Jian-Min et al., 2006). Количество копий SVA в геноме человека относительно невелико, особенно если сравнивать с почти 500 тыс. копий L1 (L1 ~ в 170 раз больше) и более чем с миллионом копий Alu (Alu ~ в 1300 раз больше). Однако эта статистика может отражать эволюционную молодость SVA-элементов. То, что для современного вида человека SVA-элементы могут представлять большую опасность, говорит количество недавно возникших через механизм ретротранспозиции патологических мутаций (Ostertag E. et al., 2003). Исследования вставок ретротранспозонов, выполненные в последние годы, позволили выявить до 14 генетических болезней (см. табл. 27), возникших недавно или de novo в результате вставок L1; и, как минимум, 21 болезнь, вызванную вставками Alu (см. табл. 28). На этом фоне четыре генетических дефекта, вызванные ретротранспозицией SVA (см. выше), резко контрастируют с относительным количеством таких элементов в геноме человека. Ретротранспозиционная активность малочисленных SVA, сопровождающаяся развитием наследственной патологии у человека, только в 3,5 раза меньше, чем у L1; и в 5,3 раза, чем у Alu. Они, как и L1, способны ретротранспозироваться в клетки зародышевой линии и имеют промотор, экспрессирующийся в таких клетках (germline-specific promoter).
В эволюционном аспекте интересно также и то, что вставки SVA в ген fukutin, вызывающие врожденную мышечную дистрофию Фукаяма-типа, не возникли de novo, но и появились они не более чем 102 генерации назад, т. е. за несколько веков до того, как протояпонские племена начали мигрировать на Японский архипелаг с Корейского полуострова. Сегодня в Японии такая форма мышечной дистрофии является наиболее распространенной (Colombo R. et al., 2000). Эпидемиология LTR-ретроэлементов. Описание LTR-ретроэлементов приведено в разд. 1.2. Ниже будет рассмотрена роль в развитии патологических процессов тех из них, которые подпадают под определение «эндогенные ретровирусы». HERV. В большинстве своем в геном современного человека HERV попали от его эволюционных предков. Те, в свою очередь, «получили» их через эндогенизацию экзогенных ретровирусов, распространяющихся среди вида половым путем (получается, что не только дети платят за грехи родителей, но и биологические виды за «грехи» своих эволюционных предков). Только одна группа эндогенных ретровирусов, HERV-K, включает вирусы, прошедшие через процесс эндогенизации уже после сформирования вида Homo sapiens (т. е. приблизительно 170 тыс. лет назад). Возраст провируса HERV-K113 не превышает 100 тыс. лет. Он локализован в хромосоме 19 (19p13.11) и не полностью зафиксирован в человеческих популяциях (более подробно о HERV-K см. в разд. 1.2, «Эволюционная роль HERV-K» и в разд. 1.3, «Реинтеграция и реинфекция ретровирусов»). Большинство же полноразмерных HERV, обнаруженных в геноме человека, унаследованы им от своих эволюционных предков, появившихся уже после дивергенции гоминоидов и предков современных обезьян. Свойства отдельных HERV, сохранивших способность к экспрессии белков и мРНК, приведены в табл. 29.
Таблица 29. Свойства отдельных HERV, сохранивших способность к экспрессии белков и мРНК по P. N. Nelson et al. (2004)
Семейство | Члены семейства | Количество копий в геноме/предыдущая классификация | Экспрессия мРНК | Экспрессия генов белков | Структура генома | Праймер-связывающий сайт | Хромосомная локализация | Комментарий HERV-H/RTVL-H Класс I | RTVL-H2; RGH2 | Мультикопийный типа С, 800-1000 копий, плюс около 1000 отдельных LTR | LTR-gag-pol-env — LTR мРНК экспрессируется в клетках карциномы плоского эпителия легких; тератокарциномных клеточных линий; В-лимфобластоидных клеточных линиях, полученных от больных с множественным склерозом | 62 кДа белок, соответствующий гену env | Сильно «усеченный» провирус | tRNAHis | Копии во всех хромосомах с концентрацией в хромосомах 1p и 7q | В определенных условиях может иметь место комплементация и полная экспрессия HERV-E Класс I | HERV-E клон 4–1 | Мультикопийный типа С; 50-100 копий | Отдельные LTR и env-содержащие мРНК, экспрессирующиеся в нормальной плаценте, ткани молочной железы и клетках колонокарциномы | 38 кДа белок env; без формирования частиц | Полноразмерный геном — 8,8 кб.; | Усеченный геном — 6 кб. (утрата последовательности env) | tRNAGlu | — | Изменение тканеспецифической экспрессии в слюнных железах для гена амилазного комплекса вследствие вставки LTR HERV-E в промоторный регион ERV-9 Класс I | — | Ретровирус типа С | В недифференцирующихся NT2/D1-клетках и в клетках тератокарциномы можно обнаружить РНК-транскрипты ERV-9 размером от 8, 2 и 1,5 кб. | Сильно «усеченный» провирус | tRNAArg | — | Избирательная экспрессия белка с участком, называемым «цинковый палец» (см. «Словарь терминов») HERV-R Класс I | ERV3 | Отдельные копии ретровируса типа С | Высокая экспрессия в плаценте и клеточной линии U937, низкая экспрессия в тканях тимуса, легких, молочной и поджелудочной желез | 65 кДа белок env | Полноразмерный — 9,9 кб. | tRNAArg | Хромосома 7 | Экспрессия мРНК вызывается стероидными гормонами HRES-1 Класс I | — | Отдельные копии элемента на гаплоидный геном | Обнаруживали мРНК, соответствующую LTR и gag-регионам HRES-1 | Кодирует 28 кДа gag-белок в Т-клетках человека Н9 | — | — | Картированы в общем ломком сайте (common fragile site); хромосома 1 в 1q42 | Антитела к HRES-1 специфическим синтетическим пептидам обнаружены у пациентов с MS, SLE и синдромом Шегрена | HERV-W (MSRV) Класс I | — | Мультикопийный тип С | LTR-gag-pol-env — LTR, rev мРНК-эксперессия в плаценте и яичках | Ген env кодирует 65 кДа белок слияния (синтицин) | — | — | — | Обнаружен у больных с MS человека. Содержит, по крайней мере, 70, 100 и 30 связанных с HERV-W | участков gag, pro и env, соответственно HERV-K Класс II | HERV-K10 | Мультикопийный мозаичного типа эндогенный проретровирус; 50 копий на гаплоидный геном | LTR-gag-pol-env — LTR, rev мРНК-эксперессия; высокий уровень в тератокарциномных клеточных линиях, рака яичек; экспрессия env-гена HERV-K клетках рака молочной железы; низкий уровень — в плаценте и нормальных тканях; экспрессируется в периферических лимфоцитах крови | gag, кORF, протеаза, интеграза, полимераза, env, rev; формируются ретровирусные частицы | Полная нуклеотидная последовательность HERV-K10; 8,8 кб. | tRNALys | — | Индукция мРНК HERV-К возможна в клетках рака молочной железы человека путем добавления прогестерона и эстрадиола HERV–L Класс II | — | Мульткопийный тип | pol, LTR-gag-polмРНК обнаруживается в тканях при ревматоидном артрите, клетках синовиальной жидкости, плаценте, раковых клетках молочной железы | Неизвестно | — | tRNALeu | — | —
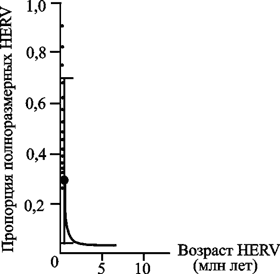
Скорость образования делеций в геноме HERV зависит от его возраста. У «недавно вставившихся» в геном человека ретровирусов (т. е. уже после дивергенции гоминоидов и предков современных обезьян) скорость образования делеций почти в 200 раз выше, чем у тех, кто интегрировался с геномом «давно», т. е. до дивергенции (рис. 93).
Рис. 93. Сравнение наблюдаемых и расчетных пропорций полноразмерных HERV, содержащихся в геноме человека
Большими точками и сплошной линией (в пределах доверительного интервала) показаны экспериментальные данные; маленькие точки соответствуют расчетным величинам (на каждые 1000 генераций). По R. Belshaw et al. (2007)
«Полноразмерность» генома HERV весьма относительна. HERV представляют собой полиморфизмы, т. е. различные производные от своего экзогенного предка, к тому же присутствующие в разных пропорциях в различных популяциях людей. Именно полиморфизм HERV является причиной того, что только у части индивидуумов они вызывают патологические состояния. D. Moyes et al. (2005) делят все полиморфизмы на два подтипа. Полиморфизмы последовательностей — полиморфизмы последовательностей генов HERV, влияющих на функциональную способность их конечных продуктов. Они трудно поддаются идентификации, так как мешает «фон» экспрессирующихся генов сходных эндогенных вирусов. Вставочный полиморфизм — разное пропорциональное присутствие HERV в различных популяциях людей. Вставочнополиморфные HERV с большей вероятностью вовлечены в патологические процессы, чем HERV, присутствующие у всех представителей вида. Во-первых, они недавно вставились в геном человека и поэтому могут вызывать разрушение его генов, с которыми интегрировались. Энхансерные элементы ретровирусных LTR могут влиять на экспрессию генов, прилегающих к HERV, даже при наличии некоторой дистанции между ними. Во-вторых, HERV, недавно интегрировавшиеся с геномом, с большей вероятностью содержат функционально активные гены, продукты которых способны модулировать клеточную пролиферацию и иммунные реакции. В-третьих, их присутствие только у отдельных индивидуумов повышает возможность того, что они усилят свою патогенность таким же образом, как это делают экзогенные ретровирусы (Moyes D. et al., 2005). До настоящего времени опубликовано очень немного работ, касающихся ассоциации вставочного полиморфизма HERV и отдельных нозологических форм болезней у людей. Все эти работы касаются полноразмерных HERV-К113 и HERV-К115. Их обычно находят у лиц, страдающих аутоиммунными болезнями. Но и здесь можно обнаружить любопытную закономерность, описанную в разд. 1.3, «Инфицированность лентивирусами диких животных», правда, наблюдаемую уже в другом масштабе времени — эндогенные ретровирусные инфекции также как и экзогенные, локализованы территориально. У 96 (n = 96) жителей Соединенного Королевства HERV-К113 и HERV-К115 были обнаружены у 4,16 и 1,0 % соответственно. У 174 (n = 174) жителей Центральной Африки эти величины возросли до 21,8 и 34,1 % соответственно (p < 0,001). В Иемене (n = 56) они составили 8 и 7,14 %; в Папуа Новой Гвинее (n = 54) 0 % для обоих ретровирусов (Moyes D. L. et al., 2005). Эти географические вариации показывают, что оба ретровируса недавно интегрировались с геномом человека в результате какой-то ретровирусной эпидемии (напомню, что «недавно» в контексте процессов, в которых участвуют HERV, означает «после дивергенции гоминоидов и предков современных обезьян»; см. рис. 4, 6, 76, 88 и 93). Инфицирование ими людей произошло на одной территории. А вот при каких обстоятельствах, не очень понятно. Возможно, что до исхода предков современных людей из Африки. Тогда разница в инфицированности отдельных популяций обусловлена действием каких-то селективных факторов. Но возможно и то, что инфицирование людей экзогенными предками HERV-К113 и HERV-К115 произошло позже «исхода», и осуществлялось на отдельных территориях (например, в Центральной Африке) многократно. В пользу этой версии говорит отсутствие HERV-К113 и HERV-К115 у аборигенов Папуа Новой Гвинеи, заселивших эти острова несколько десятков тысяч лет назад. Процесс распространения HERV-K113 сопровождается распространением патологии, которую обычно не считают инфекционной. В Соединенном Королевстве HERV-K113 был обнаружен у 15,6 % (n = 96) лиц, страдающих синдромом Шегрена (SS) (p < 0,01) и 11,9 % (n = 109) с множественным склерозом (p < 0,05). Однако для HERV-К115 такая связь не показана. (Moyes D. L. et al., 2005). Но это лишь предварительные результаты. Последовательности ДНК HERV и LINE наиболее эффективно экспрессируются в эмбриональных тканях, таких как зародышевая линия (germ line) или в раковых клетках. Например, экспрессия оболочечных белков HERV-K установлена в большинстве случаев рака молочной железы, но их невозможно обнаружить в здоровых тканях этого органа (Wang-Johanning F. et al., 2003). Разнообразная патология возникает в результате повышенной экспрессии генов, вызванной их переходом под «контроль» промоторов HERV (Kidwell M. G., Lisch D., 1997). J. R. Landry et al. (2002) обнаружили слитый транскрипт, содержащий LTR HERV-E, связанный с геном Mid1 (Синдром Опица, Opitz syndrome). Ими установлено, что изоформа мРНК Mid1 была транскрибирована с ретровирусной LTR. Хотя такие транскрипты выявлены во всех исследованных тканях, в количественном отношении они преобладали в тканях плаценты и эмбриональных тканях почки (Nelson P. N. et al., 2004). HERV вносят свой вклад в нестабильность генома человека посредством различных перестановок участков хромосомной ДНК и ретротранспозиционных актов (Jae-Won H. et al., 2006). Кроме того, они вызывают патологические процессы у людей по следующим механизмам: 1) разрушают гены в участках собственной интеграции; 2) подавляют или стимулируют иммунные ответы; 3) модулируют синтез белков, оказывающих патологическое действие на клетки, в которых происходит их синтез. Упрощенно такие механизмы показаны на рис. 94.
Рис. 94. HERV и патологические процессы у человека
Многие из «недавних» HERV, представленные в геноме человека, содержат функционирующие промоторы, энхансерные последовательности и сигналы полиаденилации (polyadenylation signals). Они могут нарушать или, наоборот, усиливать экспрессию генов хозяина вблизи сайта интеграции благодаря промоторной активности LTR. Вирусные белки, такие как Gag или Env, могут подавлять или стимулировать иммунные реакции либо оказывать прямое действие на клетки, в которых они экспрессируются. По D. Moyes et al. (2005)
Суперантигенные свойства HERV и многокомпонентные нециклические инфекционные процессы. Суперантигены стимулируют экспансию большого количества T-клеток (5–20 %, отсюда термин «суперантиген»; см. «Словарь терминов»). Накоплено много доказательств того, что отдельные вирусы, вызывающие болезни у людей, могут проявлять суперантигенные свойства, например, вирус Эпштейна — Барра (EBV). Однако тщательный анализ генома EBV не позволил выявить гены, кодирующие белки, которые могли бы обладать такими свойствами. N. Sutkowski et al. (2001) обнаружили возможную связь между EBV-инфекцией и суперантигенной активностью HERV-K, проявляющуюся аутоиммунными болезнями. Ими было показано, что HERV-K18 имеет три аллели, найденные в первом интроне CD48 (СD — от cluster designation; CD48 — Ig-структура на поверхности лейкоцитов, вызывающая костимуляцию Т-клеток) в обратной ориентации. Каждая аллель оболочечного гена HERV-K кодирует суперантигены. N. Sutkowski et al. (2001) предположили, что EBV трансактивируют гены CD48, ассоциированные с HERV-K18-суперантигенкодирующими генами, что объясняет ассоциацию между EBV-инфекцией и Vb-специфической Т-клеточной активацией. Аналогичный эффект получается в результате транскрипции генов HERV-K, индуцированных ICP0 — ранним белком вируса герпеса первого типа (Kwun H. J. et al., 2002). В организме человека EBV использует стратегию паразитизма первого типа (см. разд. 3.1). У большинства людей он вызывает типичную циклическую инфекцию, называемую инфекционным мононуклеозом. Болезнь начинается остро, проявляется ремитирующей лихорадкой, воспалением лимфатических узлов, поражением зева, гепато- и спленомегалией. У переболевших людей развивается стойкий иммунитет к EBV. Суперантигенный ответ HERV-K18 изменяет жизненный цикл EBV и ведет к патологии, ранее не считавшейся инфекционной. Так как T-клетки хелперы необходимы для длительно живущих EBV-инфицированных B-клеток памяти, то именно экспрессия генов суперантигенов HERV-K18 предопределяет необратимое персистирование EBV в организме иммунокомпетентного человека. Кроме того, вызванная HERV-K18 стимуляция Т-клеток является причиной B-лимфомагенеза (злокачественные лимфомы — болезнь Ходжкина, лимфосаркомы и др.) (Nelson P. N. et al., 2004). Результаты этих исследований предполагают прямую связь между циклически развивающейся вирусной инфекцией и иммунными ответами у лиц с HERV-K, сохранивших способность к экспрессии генов белков с суперантигенными свойствами. У таких лиц инфекционный процесс, вызванный паразитом, использующим стратегию первого типа (см. гл. 3), развивается как нециклический. Чем более инфицированы человеческие популяции полноразмерными HERV, тем чаще у отдельных лиц будут фиксироваться случаи нециклического течения инфекционных болезней, вызываемых микроорганизмами, использующими стратегию паразитизма первого типа. По сути, тут речь идет о разновидности многокомпонентного инфекционного процесса (см. разд. 3.3), в котором участвуют полноразмерные HERV.
%%%
Эндогенные ретроэлементы и ретровирусы появляются в геноме человека в результате вызванных экзогенными ретровирусами эпидемических (эпизоотических — если иметь ввиду наших отдаленных предков) процессов, однако патология, возникающая в результате их активности, не относится учеными к инфекционной, а их распространение по виду H. sapiens не считается эпидемией. Причина тут в том, что понимание инфекционных и эпидемических процессов у нас ограничено представлениями о циклических инфекциях (эпидемиях), развивающихся в масштабах времени, воспринимаемых человеком на бытовом уровне. Процессы, растягивающиеся во времени на периоды, выходящие за эти рамки, а тем более начавшиеся в эволюционно предшествующих видах, уже кажутся несуществующими и распадаются на отдельные явления без понимания причинно-следственных связей между ними. Тем не менее, если судить по приведенным в разделе данным, такие процессы происходят в объективной реальности как инфекционные. Во-первых, они представляют собой размножение и экспансию по геному таксона чуждых для него ретроэлементов, попавших «извне»; во-вторых, предполагают паразитизм в существовании таких элементов — их размножение и распространение по геному человека осуществляется благодаря использованию биохимических ресурсов клетки; в-третьих, они приводят к поражению функции органа или ткани, т. е. к болезни. Поэтому стратегию генетических паразитов — возбудителей таких инфекционных процессов, целесообразно терминологически отделить от стратегий паразитических микроорганизмов, вызывающих циклические (см. разд. 3.1) и нециклические инфекционные процессы (см. разд. 3.2), например, выделить ее в отдельную группу как третью стратегию паразитизма. Распространение генетических паразитов на видовом уровне можно рассматривать как циклические эпидемии, правда, в рамках сверхмедленных в нашем ощущении времени циклов (см. рис. 88 и 93). Для них, также как и для эпидемических процессов, вызываемых паразитами, использующими стратегию первого типа, можно выделить следующие стадии. Межэпидемическая стадия — в результате эпидемии (эпизоотии) нециклического типа у части выживших представителей данного вида произошла эндогенизация экзогенного ретровируса. Предэпидемическая стадия — в изолированных, практикующих инбридинг популяциях, по мере размножения особей, носителей нового эндогенного ретровируса, происходит увеличение его копий. Через обратную транскрипцию генерируются новые генетических элементы (см. рис. 89). В географически обособленных популяциях появляются первые особи с наследуемыми генетическими дефектами. Стадия развития эпидемии — в распространение новых генетических элементов вовлекаются панмиксные популяции вида; рост пластичности генома. В результате пролиферации транспозируемых элементов с каждым новым поколением происходит увеличение количества особей вида, страдающих наследственными болезнями. Стадия разгара эпидемии — скорость пролиферации транспозируемых элементов и распространение генетических дефектов в панмиксных популяциях достигают максимума, рост числа гомозиготных носителей мутаций. Из-за чрезмерной пластичности генома возможна гибель панмиксного вида и/или появление его подвидов среди географически обособленных популяций. Стадия угасания пандемии — скорость пролиферации по виду (подвиду) транспозируемых элементов снижается ниже того порогового уровня, когда темпы мутационных замен нуклеотидов делают невозможным существование активно транспозирующихся ретроэлементов. Рост числа гетерозиготных носителей мутантных аллелей.
|
|||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 86; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.134.81.206 (0.075 с.) |