Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глобальные пандемические циклы
Морфологическая структура эпидемических очагов нециклического типа. «Молчащие педиатрические инфекции». CCR5-рецептор. «Змеиный клубок». Эволюционные процессы в ВИЧ-инфицированных популяциях людей. Возвращение оспы. Глобальный многовековой цикл циклических и нециклическихинфекций (пандемический цикл).
Результаты популяционных исследований тонкой структуры генома человека показывают наличие большого количества лиц, имеющих мутации гена рецептора лимфокинов CCR5, обычно используемого ВИЧ для проникновения в макрофаги и Т-лимфоциты. Данный феномен свидетельствует о том, что наши предки (а возможно и эволюционно предшествующие виды) уже сталкивались с ВИЧ. Однако каков мог быть механизм, «обрывавший» такие пандемии в прошлом, если сегодня мы их не контролируем? Морфологическая структура эпидемических очагов нециклического типа. Структуризацию очага предопределяет гетерогенность популяции людей, проживающих на вовлеченной в эпидемический процесс территории. Мутационные процессы у индивидуумов, благодаря которым отдельные гены иммунной системы в течение многих поколений людей накапливают точечные мутации, вне инфекционного процесса не проявляют себя фенотипически, т. е. такие мутации являются нейтральными. Но у инфицированных индивидуумов они определяют клинику болезни, а на популяционном уровне — динамику и основные клинические особенности эпидемического процесса (табл. 25).
Таблица 25. Варианты генов человека, изменяющие динамику и клинические проявления ВИЧ/СПИД-пандемии [32]
Продукт гена | Вариант гена | Хромосома | Эффект Проникновение ВИЧ в клетку, корецепторы CCR5 | Δ32 | 3p21 | Резистентность к ВИЧ-инфекции, замедление развития СПИДа CCR5 | C20S | 3p21 | Предотвращает развитие ВИЧ-инфекции в присутствии D32 CCR5 | А295 | 3p21 | Спорное CCR5 | R60S | 3p21 | Спорное CCR5 | C101X | 3p21 | Предотвращает развитие ВИЧ-инфекции в присутствии Δ32 CCR5 | G106R, C178R, C269F | 3p21 | Резистентность к ВИЧ, торможение развития СПИДа CCR5 | P1 (promoter haplotypes) | 3p21 | Ускорение развития СПИДа CCR5 | 59029AA | 3p21 | То же CCR5 | HHC (promoter haplogroup) | 3p21 | Ускорение развития СПИДа у японцев CCR5 | HHЕ (promoter haplogroup) | 3p21 | Ускорение развития СПИДа у людей белой расы (сaucasians) CCR2 | 64I | 3p21 | Замедление развития СПИДа у отдельных лиц
DC-SIGN | Вариант промотора | 19p13 | Парэнтеральная инфекция CX3CR1 | I249/M280 | 3p21 | Ускорение развития СПИДа Лиганды корецепторов MIP-1альфаP (CCL3L1) | Количество копий гена 17q12 | Увеличение восприимчивости к инфицированию MIP-1бета (CCL4L1) | L2 | 17q12 | То же RANTES (CCL5) | −403A, −28G (промотор) | 17q12 | Торможение развития СПИДа RANTES (CCL5) | В 1.1C (intronic) | 17q12 | Ускорение развития СПИДа SDF-1 (CXCL12) | 3'A | 10q11 | Торможение развития СПИДа? MCP1/MCP3/Eotaxin | Н7 (гаплотип) | 17q11 | Снижение чувствительности к инфицированию После проникновения ВИЧ в клетку TRIM 5альфа | Гаплотип 9 | 11p15 | Увеличение трансмиссии ВИЧ TRIM 5альфа | 136Q, 43Y | 11p15 | Защита от ВИЧ-инфекции APOBEC3G | 186R, C40693T | 22q13 | Ускорение развития СПИДа, увеличение трансмиссии ВИЧ TSG101 | −183C | 11p15 | Ускорение элиминации CD4 T-клеток Приобретенный/врожденный иммунитет HLA | B*27 | 6p21 | Торможение развития СПИДа —"— | B*18 | 6p21 | Быстрое развитие болезни —"— | B*57 | 6p21 | Торможение развития СПИДа —"— | B*35Px | 6p21 | Ускорение развития СПИДа —"— | E*0103 | 6p21 | Резистентность к ВИЧ-инфекции —"— | G*0105N | 6p21 | То же —"— | G*010108 | 6p21 Увеличение восприимчивости к ВИЧ KIR3DS1 | 3DS1 + HLA-Bw4-80Ile | 19q13; 6p21 | Торможение развития СПИДа —"— | 3DL1 + HLA-B*57s | 19q13; 6p21 | То же Гены цитокинов Th1 (гамма-IFN) | +874T аллель | 12q14 | Замедление начала развития болезни Th2 (IL10) | IL10-5'-592A | 1q31 | Ускорение прогрессирования болезни Th2 (IL4) | −590T | 5q31 | То же
Морфологическая структура такого очага следующая: быстрые прогрессоры («fast progressors») — лица, у которых СПИД развивается в течение 1–3 лет; умеренные прогрессоры («moderate progressors») — лица, у которых течение ВИЧ-инфекции приводит к СПИДу в промежуток времени 3–10 лет; длительные непрогрессоры («long-term non-progressors», LTNPs) — лица, не имеющие симптомов болезни, у которых поддерживается нормальное количество Т-хелперов и отсутствуют другие признаки иммунной дисфункции более 10 лет (примерно 5 % всего количества ВИЧ-серопозитивных пациентов); индивидуумы с высоким риском инфицирования, но остающиеся серонегативными (individuals that are highly exposed persistently seronegative, HEPS) или незащищенные неинфицированные (exposed uninfected, EUs) — лица, которые не инфицируются даже после многократной экспозиции к ВИЧ. Их периодически обнаруживают среди пациентов, страдающих гемофилией и которым неоднократно переливали инфицированные ВИЧ-продукты крови, проституток, наркоманов и детей, родившихся от ВИЧ-инфицированных матерей.
По мере формирования очага усложняется его морфология, очаг становится более резистентным к внешним воздействиям. Существование LTNP- и HEPS-индивидуумов обусловлено наличием в их геноме мутаций, препятствующих проникновению ВИЧ в клетки иммунной системы и его последующему жизненному циклу (см. табл. 25). Как правило, LTNPи HEPS-индивидуумы гомозиготны по мутациям данного типа. Например, гомозиготы по CCR5-D32 (см. ниже) в европейских популяциях составляют не более 1 %, в африканских их вообще нет (Gonzalez E. et al., 2001). Более подробно о вариантах таких генов и их роли в инфекционном и эпидемических процессах можно прочитать в обзоре P. Singh et al. (2008). Но вернемся к морфологии очага нециклической инфекции. Если смотреть на его структуру с точки зрения поддержания эпидемического процесса, то нельзя не отметить иерархичность в построении тех его элементов, которые поддерживают постоянную инфицированность популяции: быстрые прогрессоры поддерживают инфицированность популяции на начальном этапе эпидемического процесса (предэпидемическая стадия), когда паразит (например, ВИЧ) размножается только за счет ресурсов реликтовой иммунной системы человека и вне контроля со стороны Т- и В-клеток (см. разд. 3.2). Благодаря вовлечению в эпидемический процесс быстрых прогрессоров, у паразита появляется возможность за несколько лет «укорениться» среди людей, живущих на данной территории или в определенной СКС; умеренные прогрессоры обладают наибольшим трансмиссионным потенциалом, так как имеют длительный период асимптоматического течения инфекции (см. работу Fraser C. et al., 2007). Они формируют основное разнообразие штаммов ВИЧ, вовлекающихся в эпидемический процесс (см. рис. 47). Умеренные прогрессоры образуют устойчивые совокупности пространственно-временных связей между эпидемическим очагом и точками вторичного распространения эпидемии ВИЧ/СПИД (эпидемические сети по определению Д. В. Николаенко; см. разд. 4.2.1). Само наличие в популяциях людей LTNP- и HEPS-индивидуумов создает иллюзию возможности прекращения пандемии ВИЧ/СПИДа. Индивидуумы, имеющие повышенную резистентность к возбудителю циклической инфекции, действительно могут тормозить эпидемический процесс, так как такие процессы редко длятся более года. Однако продолжительность нециклических эпидемий (пандемий) значительно превосходит временные рамки циклических. Например, пандемия ВИЧ/СПИДа, по самым приблизительным оценкам, длится уже более 50 лет (см. рис. 74). За это время сменилось два поколения людей. И пока нет никаких признаков завершения пандемии. Носители гомозиготных мутаций среди весьма редко встречающихся LTNP- и HEPS-индивидуумов в следующих поколениях будут представлены уже гетерозиготными носителями и перейдут в категорию умеренных прогрессоров. Следовательно, наличие LTNP- и HEPSиндивидуумов в очаге усложняет его морфологическую структуру и увеличивает градиент иммунодефицитности в эпидемических цепочках (см. ниже «Эволюционные процессы в ВИЧ-инфицированных популяциях людей») — очаг становится еще более устойчивым к внешним воздействиям.
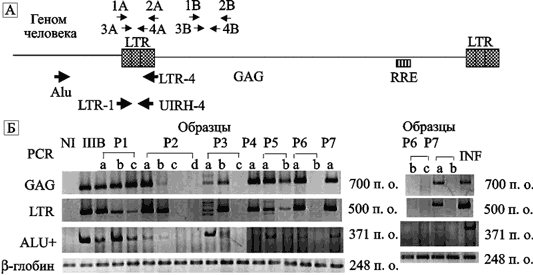
«Молчащие педиатрические инфекции» («silent pediatric infections»). Суть феномена заключается в обнаружении провирусной ДНК ВИЧ в мононуклеарных клетках крови серонегативных детей, родившихся от ВИЧинфицированных родителей несколько лет назад (рис. 78).
Рис. 78. Интеграция провирусной ДНК ВИЧ в ДНК мононуклеарных клеток серонегативных детей, родившихся от серопозитивных матерей два года назад
A. Схема соответствия ПЦР-амплификации провирусному геному ВИЧ. Праймеры, использованные для детекции LTR (1A–4A) и GAG (1B–4B) участков ДНК, показаны небольшими тонкими стрелками. PCR-амплификаты (Alu/LTR-4) участка ДНК Alu-HIV LTR были подвергнуты второму циклу ПЦР с помощью специфического праймера LTR-1-UIRH-4 (большие стрелки). Б. ПЦР-амплификаты ДНК мононуклеарных клеток серопозитивных детей: пациент 1 (P1) (a — c), P2 (a — d), P3 (a — c), P4 (a), P5 (a — b), P6 (a — b), P7 (a — c) и P8 (a, b). Дорожка, обозначенная как IIIB — результат исследования ДНК мононуклеарных клеток детей с серологически подтвержденной ВИЧ-инфекцией (серопозитивных). NI — результат исследования ДНК мононуклеарных клеток заведомо неинфицированных ВИЧ детей. По Р. Vаґzquez et al. (2006)
Эпидемическая опасность и масштабы такого феномена неясны. Его нельзя отождествлять с торможением ВИЧ-инфекции у LTNP- и HEPSиндивидуумов (см. выше). У последних репликация вируса все же происходит, о чем свидетельствует сероконверсия и обнаружение вирусной РНК в сыворотке пациентов. Является ли такой тип течения ВИЧ-инфекции абортивным, или это проявление эндогенизации вируса, станет окончательно ясно только через несколько десятилетий. CCR5-рецептор. Это древний хемокиновый рецептор, сформировавшийся еще до появления позвоночных животных. Экспрессируется на поверхности моноцитов/макрофагов, дендритных и микроглиальных клеток и активированных Т-клеток. Одновременно он является основным корецептором, посредством которого ВИЧ проникает в клетку. Физиологическое предназначение CCR5-рецептора еще только устанавливается. Видимо, у многоклеточных организмов оно зависит от иерархического уровня иммунной реакции, в которой участвуют клетки — носители данного рецептора. На самом нижнем уровне, моделируемом только в условиях эксперимента (in vitro), клетки, экспрессирующие CCR5-рецептор, после взаимодействия с лигандом мигрируют в направлении его большей концентрации. Утратив данный рецептор, клетка утрачивает способность к миграции (см. Yurchenko E. et al., 2006).
Ген рецептора расположен на хромосоме 3p21.3. Сам рецептор представляет собой белковую молекулу, формирующую семь трансмембранных доменов, образующих три петли на поверхности клетки (см. разд. 2.3, «Реликтовая иммунная система человека»). Полиморфизм гена CCR5 может проявляться как замедлением ВИЧ-инфекции, так и, наоборот, ускорением ее течения (см. табл. 25). Ниже речь идет только о наиболее распространенной и изученной мутации гена — делеции CCR5-Δ32. Обычно такая мутация проявляется преждевременным стоп-кодоном (stop codon). Ген рецептора полностью инактивируется (knockout deletion variant), CCR5-корецептор не экспрессируется на поверхности клетки, что ведет к эффективной рестрикции проникновения макрофаготропных ВИЧ в макрофаги людей (Liu R. et al., 1996) и к торможению перехода болезни на стадию СПИДа (Buseyne F. et al., 1998). Лица, гомозиготные по аллели CCR5-Δ32, не имеют рецепторсвязывающих сайтов для макрофаготропных ВИЧ. У гетерозигот этот рецептор составляет менее половины от уровня зрелого CCR5, находящегося на поверхности фагоцитирующих клеток гомозигот с неизмененным рецептором (рис. 79).
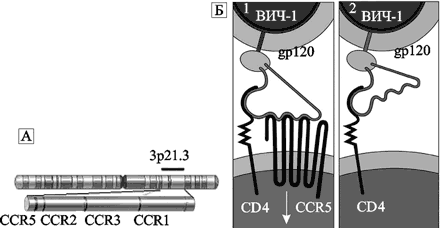
Рис. 79. CCR5-рецептор.
А. Локализация генов CCR2, CCR5 и других хемокиновых рецепторов на хромосоме 3p21.3. По Р. Singh et al. (2008). Б. Роль рецептора CCR5 в развитии ВИЧ-инфекции: (1) оболочечный гликопротеин gp120 на поверхности ВИЧ связывается с CD4 и корецептором CCR5 на поверхности макрофага; (2) гомозиготы по CCR5-Δ32-делеции не имеют корецептора CCR5 на поверхности макрофагов. Поэтому они устойчивы к инфицированию макрофаготропными вариантами ВИЧ. По P. W. Hedrick, B. C. Verrelli (2006)
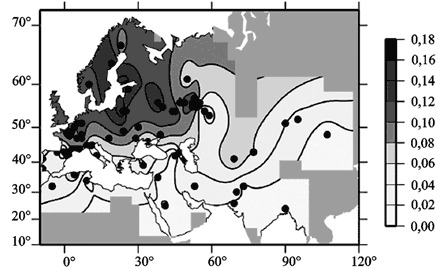
Макрофаги и циркулирующие в периферической крови Т-клетки экспрессируют оба рецептора, хотя количество CXCR4 (см. разд. 3.2, «Генерализация ВИЧ») у Т-клеток меньше, чем на макрофагах. М-тропность у ВИЧ вызвана способностью белковых структур его оболочки связываться с CCR5 и проникать в оба типа макрофагов, а также в циркулирующие в крови Т-клетки. Т-тропный ВИЧ преимущественно связывается с CXCR4 и проникает в Т-клетки или Т-клеточные линии макрофагов. Поэтому устойчивость к ВИЧ относительна даже у гомозигот по делеции CCR5-Δ32. Из генов других хемокиновых рецепторов, мутации в которых снижают восприимчивость человека к ВИЧ, исследователи отмечают производные CCR2. Замена в 64-й позиции гена хемокинового рецептора CCR2 валина изолейцином приводит к тому же эффекту, что и делеция 32 п. о. в гене рецептора CCR5. Эффект обеих мутаций на прогрессирование ВИЧ-инфекции является аддитивным (McNicholl J. еt al., 1997). Распределение аллели Δ32 ограничено Европой, где у гетерозигот ее можно выявить с частотой 4–16 %. Частота встречаемости аллели снижается в направлении с севера на юго-восток — с 16 % в Северной Европе до 6 % в Италии, и 4 % в Греции (рис. 80).
Рис. 80. Контурная карта частоты встречаемости аллели CCR5- D 32.
Черными точками отмечены географические координаты забора проб. По J. Novembre et al. (2005).
Наиболее распространены носители аллели Δ32 в Балтийском регионе (Швеция, Финляндия, Эстония и Латвия), Беларуси. Их количество увеличивается в отдельных местностях Франции, в таких российских городах как Москва и Рязань, Волго-Уральском регионе России, у евреев-ашкенази (Ashkenazi Jews). Носители аллели Δ32 практически не встречаются среди африканских и азиатских народов (Novembre J. et al., 2005). Р. Singh et al. (2008) обнаружили только одного гомозиготного носителя CCR5-Δ32 среди 460 здоровых людей на севере Индии. Среди ВИЧ-инфицированных индийцев носителей таких мутаций им обнаружить не удалось. Предложены разные объяснения неравномерного распределения мутаций CCR5-Δ32 в популяциях людей. Наиболее популярными среди ученых в начале текущего десятилетия оказались две гипотезы: 1) связывающая распространение аллели Δ32 с расселением викингов; 2) предполагающая селекцию людей с данной мутацией во время пандемии чумы «черной смерти» (1346–1351 гг.). Причем для обоснования последней теории сделано предположение о значительно большей устойчивости к возбудителю чумы людей, носителей мутации CCR5-Δ32 (Galvani A., Slatkin M., 2003). Эти гипотезы встретили трудности из-за противоречащих им фактов. Обобщенные в работе S. Hummel et al. (2005) результаты исследования образцов ДНК из скелетов людей, умерших более чем 2900 лет назад, свидетельствуют о сходстве частот встречаемости CCR5-Δ32 мутаций среди людей Бронзового века и современных (рис. 81).
Рис. 81. Частоты встречаемости носителей CCR5- Δ32 в ДНК образцов, отобранных из скелетов людей, живших в Бронзовом веке и в Средние века
Цифрами указано количество исследованных образцов ДНК. Чума — люди, умершие от чумы. Голод — люди умершие от голода. По S. Hummel et al. (2005)
Среди людей Бронзового века, живших на территории современной Германии, мутация встречалась у 11,8 %, но и 9,2 % современных немцев гетерозиготны по CCR5-Δ32. S. Hummel et al. (2005) не нашли значительных различий в частотах встречаемости таких мутаций среди людей, погибших от чумы в XIV в., и современных европейцев (см. рис. 81). Сохранились даже различия в частоте встречаемости CCR5-Δ32 на севере и юге Европы, по крайней мере, они не менялись за 200-летний промежуток времени. Sabeti P. C. et al. (2005), используя новые генетические карты, «отодвинули» появление CCR5-Δ32 на 5 тыс. и более лет. Эти данные «перечеркивают» первую гипотезу, но не в пользу второй. J. Mecsas et al. (2004) сравнили в экспериментах и по литературным данным восприимчивость мышей к Yersinia (Y. pestis и Y. pseudotuberculosis), Listeria, Cryptococci и Leishmania, гомозиготных по CCR5-Δ32. Макрофаги таких мышей утрачивают способность к ответу на воспалительный белок 1b (inflammatory protein-1b). У людей мутация CCR5-Δ32 является нейтральной. У мышей, гомозиготных по CCR5-Δ32, иммунологические нарушения проявляются только тогда, когда иммунная система испытывает нагрузку. Мыши, гомозиготные по CCR5-Δ32, отличаются от контрольных повышенной восприимчивостью к инфицированию Listeria, Cryptococci, Leishmania и Yersinia. Данные J. Mecsas et al. (2004) противоречат гипотезе о положительной селекции людей с CCR5-Δ32 мутациями во время масштабных вспышек чумы. Скорее всего, имела место элиминация носителей такой аллели (т. е. отрицательная селекция). «Змеиный клубок». ВИЧ/СПИД-пандемия — это многокомпонентный и постоянно усложняющийся процесс. Помимо двух десятков СПИД-ассоциируемых инфекций, находящихся в причинно-следственной связи с распространяющимся ВИЧ (см. разд. 3.2), ВИЧ/СПИД-пандемия дала следующие эпидемические «новинки». 1. Антибиотикоустойчивые штаммы возбудителей инфекций, распространяющиеся среди иммунокомпетентных людей — сальмонеллеза, туберкулеза, кандидоза и др. (Morris J. G., Morris P., 1997). Резистентность к химиопрепаратам и антибиотикам у микроорганизмов формируется в иммунодефицитных популяциях значительно быстрее, чем в иммунокомпетентных популяциях (Бердсли Т., 1993). Чем выраженнее иммунодефицитное состояние, тем более резистентные штаммы выделяют от больных (Ampel N., 1996). Это связано с большими возможностями по отбору вариантов и отсутствием давления на них со стороны иммунной системы (см. ниже «Эволюционные процессы в ВИЧ-инфицированных популяциях людей»). D. Palmero et al. (2003) описали вспышку лекарственно резистентного туберкулеза среди иммунокомпетентных людей, развившуюся в стационаре, где одновременно с ними проходили лечение ВИЧ-инфицированные пациенты. Вспышка началась среди ВИЧ-инфицированных, затем она перекинулась на иммунокомпетентных больных. Идентичность штаммов возбудителя туберкулеза, выделенных от тех и других, была подтверждена молекулярно-генетическими методами. 2. Вирулентные штаммы возбудителей малоизвестных инфекций, не считавшихся ранее серьезной проблемой для иммунокомпетентных лиц. Например, в экспериментах на животных было показано, что штаммы грамположительной коккобациллы Rhodococcus eque, выделенные от больных СПИДом, почти в сто раз более вирулентны, чем штаммы этого же микроорганизма, полученные от иммунокомпетентных людей (Pakai S. et al., 1995). Эпидемиологам данное явление известно давно — в более чувствительных популяциях отбираются более вирулентные штаммы, в иммунных (резистентных) популяциях — маловирулентные (Беляков В. Д. и др., 1987). Только теперь оно приобретает все более глобальный характер. 3. Возбудители инфекций, ранее не встречавшихся клиницистам. Например, широкое применение у ВИЧ-инфицированных с целью подавления инфекций, вызываемых грибковыми микроорганизмами, нового препарата триазола флюконазола, привело к заметному увеличению количества больных, инфицированных устойчивой к этому препарату Candida krusei. Раньше она считалась микроорганизмом, имеющим второстепенную клиническую значимость (Samaranayake Y., Samaranayake L., 1994) 4. Распространение малопатогенных возбудителей инфекционных болезней. Эпидемиологами Лос-Анджелеса обнаружен почти 35-кратный рост среди больных СПИДом числа лиц, инфицированных Campylobacter jejuni (Sorvillo F. et al., 1991). В Сан-Франциско количество лиц, инфицированных Listeria среди ВИЧ-инфицированных, превышало этот показатель для иммунокомпетентных людей в 280 раз (Schuchat A., 1992). 5. Штаммы ВИЧ, устойчивые к широко используемым в клинической практике антиретровирусным препаратам. К настоящему времени уже исчерпаны возможности разработки эффективных препаратов так называемых «старых классов» — нуклеозидных ингибиторов обратной транскриптазы и ингибиторов протеазы. Сегодня основные надежды ученые возлагают на ингибиторы слияния и созревания ВИЧ, да на еще не сделанные научные открытия (Dunne M., 2008). 6. Возвращение проказы. По мере вовлечения в ВИЧ/СПИД-пандемию все большего количества людей и территорий, становится очевидным возвращение проказы. Еще в 1991 г. R. A. Miller в опытах на обезьянах показал, что инфекция SIV увеличивает восприимчивость экспериментальных животных к M. leprae (Miller R. A., 1991). Эпидемиологические исследования, проведенные в Танзании в конце 1990-х гг., позволили установить возрастание риска инфицирования M. leprae для ВИЧ-инфицированных жителей страны и поставили под сомнение эффективность вакцины BCG, как средства специфической профилактики лепры в ее природных очагах (van den Broek J. et аl., 1997). ВИЧ-инфекция у больных проказой гораздо быстрее приобретает манифестное течение и переходит в СПИД, чем у людей, не страдающих проказой (Moses A. E. et al., 2001; Kalu W., 2006). В целом же причины проявления проказы среди ВИЧ-инфицированных пациентов весьма разнообразны и еще плохо изучены. На рис. 82 показаны проявления проказы у ВИЧ-инфицированных пациентов в Бразилии.
Рис. 82. Проявления проказы у ВИЧ-инфицированных пациентов в Бразилии По М. А. Trindade (2006)
I. A. Эритроматозное (еrythematous) и отечное (edematous) пятно на правой щеке первого пациента. Б. Эритроматозное, хорошо отграниченное пятно на правом предплечье второго пациента. II. A. Гистопатология биопсии поврежденных проказой тканей первого пациента соответствует небольшой туберкулоидной гранулеме в дермисе, разъединенной через отек около волосяного фолликула. Стрелки определяют границы зоны с небольшим скоплением эпителиоидных гистиоцитов (epithelioid histiocytes), которые окружены «мантией» из лимфоцитов. Участок повреждения окрашен гемотоксилинэозином. Первоначальное увеличение — 200 раз. Б. Гистопатология биопсии повреждений ткани второго пациента показывает хорошо организованные туберкулоидные гранулемы (tuberculoid granulomas) в дермисе. Стрелки определяют границы области, богатой эпителоидными гистиоцитами, с многочисленными лимфоцитами, инфильтрировавшими на периферию. Повреждение окрашено гемотоксилинэозином. Первоначальное увеличение — 100 раз. Оба ВИЧ-инфицированные пациента обнаружили первый тип лепрозной реакции в отсутствие антиретровирусной терапии. У первого пациента, 36-летней женщины, кожные поражения появились за год-полтора до проведения HAART. На момент данного наблюдения вирусная нагрузка не определялась, CD4+ T-клетки — 120/мм3. Второй пациент, мужчина, 32 года. ВИЧ-инфекция уже 8 лет, кожные поражения не менее двух лет, никакого лечения не получал. Вирусная нагрузка — 85 400 копий/мл; CD4+ T-клетки — 353/мм3
7. Синдром восстановления иммунитета (СВИ) — развитие у ВИЧ-инфицированного пациента туберкулеза или проказы либо впервые, либо в новой локализации на фоне увеличенного числа лимфоцитов CD4 и снижения вирусной нагрузки, достигнутых благодаря HAART (Pereira G. A. et al., 2004). Синдром отмечен у 20–30 % пациентов, совмещающих антиретровирусную терапию с противотуберкулезной. Развитие СВИ у больных туберкулезом объясняют тем, что обусловленное HAART резкое повышение числа специфических Т-лимфоцитов приводит к взрывному усилению иммунного ответа на антигены микобактерий. Обычно СВИ развивается тогда, когда от начала противотуберкулезной терапии до начала HAART проходит около 2 месяцев (Breen R. A. et al., 2005). Самый большой срок для туберкулезной инфекции, описанный в литературе, составил полтора года (Cailhol J. et al., 2008). Синдром описан у пациентов, коинфицированных нетуберкулезными микобактериями, вирусами гепатита В и С, цитомегаловирусами (Pereira G. A. et al., 2004). Эволюционные процессы в ВИЧ-инфицированных популяциях людей. «Откат» иммунной системы человека почти на 600 млн лет назад к иммунной системе первых многоклеточных организмов предоставляет новые эволюционные возможности микроорганизмам-оппортунистам (см. разд. 3.2, «Эволюционный смысл ВИЧ-инфекции»). Популяционные волны. Высокий темп размножения и высокая плотность их популяций в иммунодефицитном хозяине способствуют накоплению мутаций в их популяциях, колонизировавших эктопические органы и ткани. Проникновение паразита в новую для него экологическую нишу сопровождается явлением, известным эволюционистам как популяционная волна или «волна жизни». Такие волны являются самостоятельными факторами эволюции микроорганизмов в иммунодефицитных хозяевах и касаются колебаний численности сразу многих их мутантных производных. Поэтому действие любых факторов, снижающих численность паразитов (лекарственных препаратов или сохранившихся звеньев иммунной системы, вытеснение другим паразитическим видом и др.), приводит к тому, что от многочисленной популяции остаются отдельные особи, имеющие уже измененный набор генов. Снятие такого давления, например, из-за прекращения введения лекарственного препарата после исчезновения клинических признаков болезни, дальнейшего нарастания иммунодефицита, либо прекращения колонизации органа (ткани) другим паразитом, приводит росту численности уже измененного возбудителя. У микроорганизмов, использующих стратегию паразитизма первого типа, вызывающих инфекционный процесс у иммунокомпетентного хозяина, обычно имеется возможность только для одной эволюционной волны, в результате которой должна произойти его передача новому хозяину, а затем либо наступит смерть хозяина, либо иммунная система очистит организм от возбудителя инфекции. Но поскольку иммунодефицитность — это не состояние, а процесс, то в иммунодефитных хозяевах такие волны будут повторяться многократно, каждый раз в различных условиях, периодически меняя генотипический состав одних и тех же возбудителей. Градиент иммунодефицитности. Важным элементом среды обитания паразитов, формирующихся в иммунодефицитных популяция, является градиент иммунодефицитности в эпидемических цепочках. Практически нельзя найти двух ВИЧ-инфицированных людей с одинаковой вирусной нагрузкой; вариантами генов, изменяющих динамику и клинические проявления ВИЧ/СПИД-пандемии (см. табл. 25); количеством CD4+ T-клеток. При достижении «критической массы» иммунодефицитных людей формируются условия для последовательного пассирования вирулентных микроорганизмов через особи с большим иммунодефицитом, к особям с меньшим иммунодефицитом а потом и через иммунокомпетентных хозяев. Остановимся на механизмах такой эволюции. Дегенеративная эволюция. Как оказалось, нельзя ожидать того, что мутации у микроорганизмов в иммунодефицитных хозяевах происходят так, как об этом пишут в книгах по эволюции жизни для студентов — мутируют гены одних белков, затем других, а потом естественный отбор миллионы лет «отбрасывает» миллиарды нежизнеспособных вариантов генов, закрепляя новые. Паразиту, когда его эволюция направляется естественным отбором по пути специализации, новые гены не нужны; не нужны ему и многие уже имеющиеся. Рассмотрим это явление на примере распространения среди больных СПИДом полирезистентных штаммов возбудителя туберкулеза (multidrug-resistant tuberculosis, MDR-TB), фактически единственного фактора, сдерживающего сегодня эту пандемию. Резистентность М. tuberculosis к изониазиду у иммунодефицитных людей развивается не путем приобретения новых генов, а утратой имеющихся. Ген, кодирующий чувствительность туберкулезной палочки к изониазиду, локализуется на плазмиде или хромосоме возбудителя туберкулеза и определяет синтез фермента, активизирующего изониазид, который и убивает М. tuberculosis. В иммунодефицитных популяциях М. tuberculosis утрачивает этот ген, и антибиотик остается неактивным, ВИЧ-инфицированные люди, одновременно инфицированные резистентными к лекарственным препаратам штаммами М. tuberculosis, погибают всего за несколько недель. Такие штаммы с начала 1990-х гг. распространяются и среди иммунокомпетентных людей (Бердсли Т., 1993). Следовательно, в организме больных СПИДом и с иммунодефицитами другой этиологии создаются условия для дегенеративной эволюции возбудителей инфекционных болезней. Отбор более специализированных дегенеративных вариантов осуществляется в организме больных СПИДом из большого количества мутантов неспециализированных микроорганизмов-оппортунистов, активно размножающихся в отсутствии селективного давления иммунной системы. Видимо, это распространенный механизм эволюции паразитов в иммунодефицитных организмах. Согласно правилу «прогрессирующей специализации» Ш. Депре (1876), «группа, вступившая на путь специализации, в дальнейшем развитии будет идти по пути все более глубокой специализации». Возвращение оспы. Натуральная оспа «угасала» со середины XVIII в. В ее «ликвидации» основную роль сыграли: 1) цикличность оспенных пандемий; и 2) эпидназдзор в сочетании с вакцинацией населения, примененные в глобальных масштабах в период угасания последнего цикла оспенных пандемий (см. разд. 4.2.2, «Почему невозможно использовать вакцинацию в борьбе с ВИЧ/СПИД-пандемией»). Ликвидация эндемичной натуральной оспы в 1960–1970-х гг. в странах, находящихся к югу и юго-востоку от Сахары, происходила на фоне широко распространившихся менее опасных штаммов вируса (типа minor, см. разд. 3.1). Вызываемые такими штаммами оспоподобные болезни под разными названиями (аластрим, санага, самоа и др.) были известны ранее, однако длительное время они не были преобладающими. Любопытен механизм снижения вирулентности ВНО. Выполненные несколько лет назад молекулярно-генетические исследования вирусов, выделенных в последних очагах натуральной оспы, показали, что геномы менее вирулентных для людей штаммов отличаются от геномов высоковирулентных возбудителей натуральной оспы увеличением своих размеров за счет увеличения количества ITR. В то же время основная часть генома вируса остается неизмененной (табл. 26).
Таблица 26. Характеристика вирусов, выделенных в последних очагах натуральной оспы [33]
Изолят (страна), год выделения | Тип | Смертельные исходы, % | Размер ITR, пары оснований Harvey (Англия), 1944 | major | 27,3 | 518 Bangladesh (Бангладеш), 1975 | major | 18,5 | 725 Congo (Конго), 1970 | major | 9,6 | 793 Somalia (Сомали), 1977 | minor | 0,4 | 1051
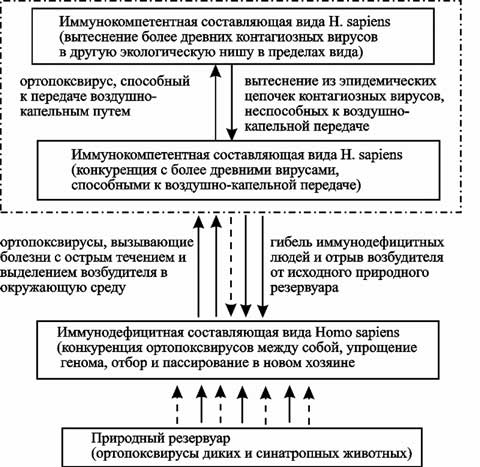
Считающийся последним очаг оспы, ликвидированный в 1977 г. в Сомали, был вызван штаммом ВНО типа minor. Смертность в очаге не превышала 0,4 %. И если быть строгим в терминах, то эта болезнь по клинике уже не была натуральной оспой, а представляла собой оспоподобную болезнь — аластрим. Приведенные данные свидетельствуют о возможности двух самостоятельных процессов: 1) приспособительном мутировании в ходе эпидемий самого вируса в направлении образования маловирулентных штаммов. Такие штаммы накапливаются в популяции ВНО за счет увеличения количества инвертированных терминальных повторов; 2) повсеместном исчерпании в первичных природных резервуарах высоковирулентных для людей вариантов вируса (например, из-за исчезновения простейших, в которых ВНО ведет себя как облигатный паразит). Первая гипотеза может помочь в объяснении причин исчезновения ВНО во второй половине ХХ в. Вторая — в объяснении механизмов возвращения высоконтагиозных для людей ортопоксвирусов. Теперь присмотримся к геному ВНО, воспользовавшись данными, приведенными в работе С. С. Маренниковой и С. Н. Щелкунова (1998). Если следовать формальной логике публикаций, объясняющих патогенность микроорганизмов приобретением ими «генов патогенности» (например, учебники Борисова Л. Б., 2001; Воробьева А. А. с соавт., 1994), то ВНО должен быть безобидным. У него разрушена ОРТ гена белка, обладающего IL-1бета-связывающей активностью, считающегося фактором патогенности. Однако вирус вакцины (ортопоксвирус, используемый для иммунизации против вируса натуральной оспы) синтезирует этот белок. У ВНО утратил свое значение ген 3бета-гидроксистероиддегидрогеназы (3бета-HSD), играющий важную роль в биосинтезе стероидных гормонов. Стероидные гормоны также обуславливают столь необходимые ВНО иммуносупрессию и противовоспалительное действие. Тем не менее вирус их утрачивает. В отличие от вируса вакцины и вируса оспы коров, у ВНО разрушены ОРТ всех белков межклеточных каналов (всего семейства!). С. С. Маренникова и С. Н. Щелкунов (1998) обратили внимание и на то, что по сравнению с маловируленым для человека вирусом вакцины, у ВНО за счет мутационных изменений разрушено значительное число других ОРТ. У ВНО существует механизм, ограничивающий возможность его генетической рекомбинационной изменчивости по сравнению с другими видами ортопоксвирусов, характеризующимися относительно высоким уровнем перестроек геномов. У него необычайно маленького размера ITR — от 518 до 1051 п. о. С их увеличением вирус теряет вирулентность для человека (см. табл. 26). У вируса вакцины, имеющего более широкий круг хозяев, ITR на порядок больше: 10–12 т. п. о. Кроме того, разные штаммы вируса вакцины содержат различающиеся наборы генов. У ВНО ITR — это минимальный теломерный элемент, необходимый для репликации поксвирусной ДНК в клетке, и не более. С. С. Маренникова и С. Н. Щелкунов (1998) считают, что столь малый размер ITR существенно ограничивает возможность генетической рекомбинации ВНО. Такая консервативность генома свидетельствует либо о приобретении необычайно глубокой адаптации ВНО к макрофагам человека уже после того как он сформировался как вид, либо ВНО адаптировался еще к эволюционным предкам человеческих макрофагов среди простейших. Разрушение рамок считывания генов ВНО — это такой же процесс дегенеративной эволюции, как утрата возбудителем чумы генов «вирулентности» или внутренними паразитами органов чувств, упрощение до предела нервной системы и исчезновение пищеварительной у ленточных червей — они им больше не нужны. Отбор перестал следить за формированием структуры, и этого оказалось достаточно, чтобы она исчезла (о феномене паразитизма см. у Медникова Б. М., 1982). Рассмотрим при каких обстоятельствах может произойти адаптация к макрофагам человека вируса — эволюционного предшественника ВНО, т. е. становление его как ВНО. Ортопоксвирусу, циркулирующему в различных природных резервуарах, например среди простейших (первичный резервуар) или грызунов (вторичный резервуар), нет необходимости проходить сложный путь эволюции, сопровождающийся приобретением новых генов. Чтобы стать высокоспециализированным паразитом, достаточно попасть в такие условия, когда многие собственные гены перестанут поддерживаться естественным отбором. Эти условия создаются в иммунодефицитных организмах. Причем, чем шире иммуннодефицитная прослойка среди населения, тем больше возможностей для специализации и отрыва от исходного природного резервуара имеется у паразита, использующего первую стратегию (рис. 83).
Рис. 83. Схематическое изображение возможного механизма формирования узкой специализации у ортопоксвируса в отношении вида Homo sapiens и его отрыва от исходного природного резервуара
|
|||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 73; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.166.7 (0.084 с.) |