
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт №5. Полный (необратимый) гидролизСодержание книги
Поиск на нашем сайте
Ход работы: 1. Внесите в пробирку 6-8 капель сульфата алюминия 2. Выводы. Почему не получилось карбоната алюминия? Какие соли подверглись полному гидролизу? Объясните, почему смешиваемые вещества усиливают гидролиз друг друга? 3. Контроль усвоения темы ( тесты для самоконтроля уровня текущих знаний). Образец теста 1. При экспериментальном определении электролитного состава ротовой жидкости установлено содержание белков 1) сильный 2) слабый 3) слабый 4) полиэлектролит 2. Степень диссоциации 1) 2) 3) 4) 3. Активность иона цинка в растворах с массовой долей сульфата цинка 0,1%; 0.25% ( 1) 0,006 и 0,0048 2) 0,003 и 0,0045 3) 0,05 0,045 4) 0,06 и 0,048 4. С целью моделирования физиологических процессов, которые происходят в слюне, необходимо приготовить раствор натрия хлорида 1) 0,015 2) 0,03 3) 0,15 4) 1,5 5. Если концентрация 1) 2) 3) 4) 6. Величина рН раствора 1) 4 2) 3 3) 2,5 4) 0,7 7. Нижеуказанное выражение _____ по результатам эксперимента позволяет рассчитать концентрацию 1) 2) 3) 4) 8. C целью определения функционирования околоушной слюнной железы, методом ацидиметрии, в образце жидкости данной секреции выявлена концентрация 1) 5 2) 7 3) 9 4) 12 9. При клиническом анализе у больного в образце крови рН составил 7,2. и такое кислотно-основное состояние крови в медицине для выбора курса лечения оценивают, как _____.
1) ацидоз 2) алкалоз 3) гипоксия 4) физиологическое 10. Фенолфталеин в щелочной среде изменяет свой цвет на _____. 1) желтый 2) оранжевый 3) синий 4) малиновый (розовый) 11. Метиловый оранжевый в кислой среде _____. 1) бесцветный 2) розовый 3) желтый 4) оранжевый 12. Метиловый оранжевый в щелочной среде _____. 1) розовый 2) бесцветный 3) оранжевый 4) желтый 13. Следствием гидролиза является _____. 1) разбавление раствора 2) изменение активной концентрации ионов соли 3) образование слабого электролита (электролитов) 4) накопление ионов 14. Основную соль (гидроксосоль) при гидролизе образует _____. 1) Na2CO3 2) AgNO3 3) AICI3 4) K3PO4 15. Кислую соль при гидролизе образует _____. 1) Cr2(SO4)3 2) ZnCl2 3) Na2SO4 4) K2S 16. Восстановите левую часть ионного уравнения гидролиза _____ + _____ ⇄ Al(OH)2+ + Н+. 1) Al3+ +2НОН ⇄ Al(OH)2+ + Н+ 2) AlOH2+ + НОH ⇄ Al(OH)2+ + Н+ 3) Al3+ + OH− +НОН ⇄ Al(OH)2+ + Н+ 4) Al2+ +2НОН ⇄ Al(OH)2+ + Н+: 17. При сливании растворов CrCl3 и K2S идет ______. 1) первая ступень гидролиза с образованием CrOHS и KHS 2) обменная реакция с образованием Cr2S3 и KCl 3) взаимное усиление гидролиза с образованием Cr(OH)3 и H2S 4) окислительно-восстановительная реакция 18. При сливании растворов Al2(SO4)3 и Na2CO3 идет _____. 1) обменная реакция с образованием Al2(CO3) 3 и Na2SO4 2) взаимное усиление гидролиза с образование Al(OH)3, CO2 и Na2SO4 3) окислительно-восстановительная реакция 4) первая ступень гидролиза солей с образованием AlOHSO4 и NaHCO3 18. Степень гидролиза Na3PO4 уменьшается при добавлении ______. 1) HCl 2) CO2 3) NaCl 4) NaOH 19. Степень гидролиза ацетата натрия возрастает при _____. 1) уменьшение температуры 2) увеличение температуры 3) добавление NaOH 4) увеличение концентрации раствора 20. Степень гидролиза 1) добавлении Na2CO3 2) уменьшении температуры 3) добавлении HCl 3) увеличение концентрации раствора 21. Уравнение для расчета 1) 2) 3) 4) 22. Уравнение: 1) 2) 3) 4) 4. Вопросы по теме для самостоятельного изучения их студентами. 4.1. Современные методы определения рН в живой клетке и в биологических жидкостях.
4.2. Роль гидролиза в жизни природы и в процессах жизнедеятельности живых организмов. Предотвращение гидролиза в практике приготовления лекарств и при выборе условий хранения. 5. Практические навыки, которыми должен овладеть студент по теме занятия. Студент должен владеть навыками: - вычисление активности ионов и ионную силу растворов, рН сильных и слабых электролитов, константы и степени гидролиза для объяснения нарушения работы различных систем организма на стадии диагностики заболевания; - выявления причин и следствия гидролиза для решения вопросов хранения и о допустимости одновременного назначения пациенту различных лекарственных препаратов; - умения работать с учебной, научной и справочной литературой, а также с сетью Интернет для постоянного усовершенствования своих знаний, с целью анализировать сложившуюся ситуацию и принимать решения в пределах своей профессиональной компетенции и полномочий.
|
||||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 167; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.138.124 (0.009 с.) |

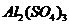 и столько же карбоната натрия
и столько же карбоната натрия 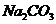 . Отметьте выделение пузырьков
. Отметьте выделение пузырьков 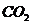 и выпадение осадка гидроксида алюминия
и выпадение осадка гидроксида алюминия 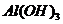 .
.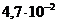 моль/л, поэтому тип данного электролита в медицине расценивают, как _____.
моль/л, поэтому тип данного электролита в медицине расценивают, как _____.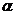 и концентрации ионов
и концентрации ионов 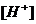 в 0,01 М растворе молочной кислоты /
в 0,01 М растворе молочной кислоты / 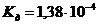 /, которая была предназначена для проведения биохимических исследований составили _____ % и _____ в моль/л соответственно.
/, которая была предназначена для проведения биохимических исследований составили _____ % и _____ в моль/л соответственно.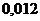 и
и 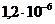
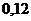 и
и 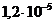
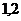 и
и 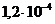
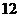 и
и 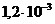
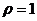 г/мл), предназначенный в качестве глазных капель как антисептическое средство составляют _____ и _____ моль/л.
г/мл), предназначенный в качестве глазных капель как антисептическое средство составляют _____ и _____ моль/л.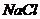 с величиной ионной силы 0,15 моль/л, учитывая при этом, что молярная концентрация данного раствора составила _____ моль/л.
с величиной ионной силы 0,15 моль/л, учитывая при этом, что молярная концентрация данного раствора составила _____ моль/л.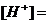
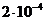 моль/л (
моль/л (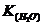 =
=  ), то концентрация гидроксид- ионов при температуре 20оС составляет _____в моль/л.
), то концентрация гидроксид- ионов при температуре 20оС составляет _____в моль/л.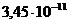
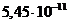
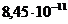
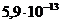
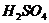 с концентрацией 0,1 моль/л равна _____.
с концентрацией 0,1 моль/л равна _____.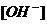 - ионов, при условии, если в лаборатории методом рН- потенциометрии установлена концентрация ионов
- ионов, при условии, если в лаборатории методом рН- потенциометрии установлена концентрация ионов 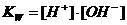
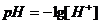
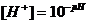
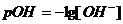
 моль/л, но, учитывая при этом тот факт, что рН определяет физико-химические свойства коллоидных структур в слюне, то рекомендуют найти эту величину, которая составила _____.
моль/л, но, учитывая при этом тот факт, что рН определяет физико-химические свойства коллоидных структур в слюне, то рекомендуют найти эту величину, которая составила _____.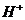 или
или 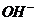 в растворе
в растворе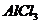 возрастает при _____
возрастает при _____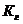 соли, образованной сильной одноосновной кислотой и слабым однокислотным основанием – это _____.
соли, образованной сильной одноосновной кислотой и слабым однокислотным основанием – это _____.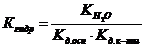
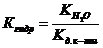

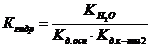
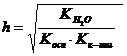 справедливо для гидролиза соли _____.
справедливо для гидролиза соли _____.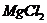
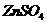
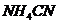
 .
.



