
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вычисление константы и степени гидролиза солейСодержание книги
Поиск на нашем сайте
Задача 8. Вычислите константу и степень гидролиза 0,1 М раствора no первой ступени. Эталон решение. 1. Первая ступень гидролиза
2. 3. Из ионного произведения воды находим, что: 4. Подставив выражение для 5. Для вычисления степени гидролиза воспользуемся формулой: 6. Следовательно, Ответ. 1.2. Ситуационные задачи (№№ с 9 по 19) для закрепления материала (выполнить в протокольной тетради). Задача №9. Вычислите степень и константу ионизации муравьиной кислоты, если концентрация ионов водорода в 0,2 М растворе муравьиной кислоты равна Задача №10. Для устранения условного рефлекса на алкоголь назначают 1% (ρ= 1 г/мл) раствор сульфата меди. Вычислите активность ионов меди в таком растворе (Т=298 К) и определите, сколько мг Задача №11. Каковы ионная сила и активность ацетилсалициловой кислоты (аспирина) в растворе концентрации 0,01 моль/л, если константа диссоциации равна Задача №12.. Вычислите концентрацию ионов водорода и гидроксида для следующих растворов: а) мочи (рН=6,0) б) ротовой жидкости (рН=6,39); в) крови (рН=7,34) г) желудочного сока (рН=0,9). Задача №13. Вычислите концентрацию ионов Задача №14. Определить концентрации Задача №15. При отравлении Задача №16. Для корреляции кислотно-щелочного равновесия при алкалозе используют 5% раствор аскорбиновой кислоты (
Задача №17. Определите рН раствора Задача №18. Определите, как изменится рН водного раствора формиата натрия с концентрацией С(HCOONa) = 0,10 моль/л, если раствор разбавить водой в 10 раз. Задача №19. Рассчитайте константу гидролиза 1.3. Контрольные вопросы 1. В чем заключается основная причина диссоциации? Как зависит способность электролитов к диссоциации от вида химической связи? 2. Какие вещества называют электролитами? По какому принципу их разделяют на сильные и слабые электролиты? 3. Что такое константа диссоциации? Чем она отличается от степени диссоциации и от чего зависит? 4. Что называют активной концентрацией или активностью? В каком соотношении она находится с аналитической концентрацией? 5. Что называют ионной силой раствора, и чем она определяется? Как изменяется ее значение с увеличением числа различных ионов, присутствующих в растворе, с увеличением заряда и концентрации каждого иона? 6. Почему в результате гидролиза изменяются кислотно-основные свойства среды? Как ее можно определить? 7. Дистиллированная вода в открытых сосудах со временем показывает слабокислую среду (рН=6). Как объяснить это явление? Экспериментальная часть Лабораторная работа. Факторы, влияющие на гидролиз веществ Цель работы. Экспериментально определить влияние различных нижеуказанных факторов на степень гидролиза солей и доказать его ступенчатый характер, а также определить природу конечного продукта гидролиза. Оборудование: набор пробирок в штативе, спиртовки, спички, держатели для пробирок. Реактивы: растворы – хлорида, ацетата, сульфита и карбоната натрия; сульфата алюминия; карбоната аммония; хлорида висмута; фенолфталеина; концентрированная соляная кислота; дистиллированная вода; универсальная индикаторная бумага.
|
|||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 153; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.25.100 (0.009 с.) |

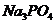 выражается уравнением:
выражается уравнением: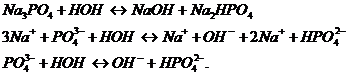
 Из уравнения закона действия масс выведем уравнение константы химического равновесия:
Из уравнения закона действия масс выведем уравнение константы химического равновесия: 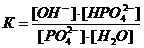 , а из него выведем константу гидролиза:
, а из него выведем константу гидролиза: 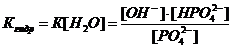
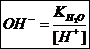 .
.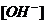 в уравнение константы гидролиза и зная, что:
в уравнение константы гидролиза и зная, что:  находим:
находим: 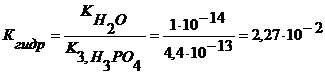 .
.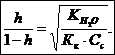 Поскольку величина
Поскольку величина  большая, то вычисления будем вести по полной формуле:
большая, то вычисления будем вести по полной формуле: 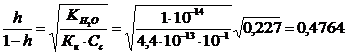
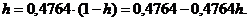 Таким образом,
Таким образом,  или 32,26%.
или 32,26%.
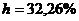
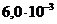 моль/л.
моль/л. содержится в шприце объемом 1 мл.
содержится в шприце объемом 1 мл. ?
? и величину
и величину  , если в центре долек клетка печени
, если в центре долек клетка печени 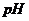 = 6,8.
= 6,8.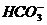 и
и 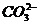 в 0,01 М растворе угольной кислоты, если рН этого раствора равен 4,18.
в 0,01 М растворе угольной кислоты, если рН этого раствора равен 4,18. , который является сильным окислителем, используют восстановитель -
, который является сильным окислителем, используют восстановитель - 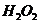 .Однако в препарате
.Однако в препарате 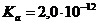 ,
, 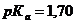 .
.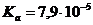 ;
; 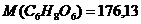 г/моль;
г/моль; 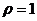 г/см3). Определите рН данного раствора.
г/см3). Определите рН данного раствора.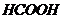 , в котором
, в котором 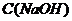 =0,1 моль/л (
=0,1 моль/л (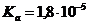 ) и раствора
) и раствора 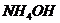 , в котором
, в котором 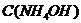 =0,2 моль/л (
=0,2 моль/л (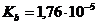 ).
).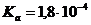 ,
, 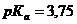 .
.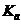 , степень гидролиза
, степень гидролиза 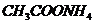 .
. 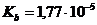 .
.


