
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
I. Закон и изотонический коэффициент Вант-ГоффаСодержание книги
Поиск на нашем сайте
Где: Þ Þ Т – температура раствора 0оС (273 К); Þ R – универсальная газовая постоянная, не зависящая от природы газа. В системе СИ R=8,314103 Дж/(кмольК) или R=8,314Дж/(мольК). Следовательно, осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы при данной температуре оно в виде газа занимало объём раствора ( осмотический закон Вант- Гоффа). Пример: 1 М раствор
Примечание: Чем Изотонический коэффициент (i) Вант-Гоффа. Степень диссоциации Изотонический коэффициент показывает, во сколько раз возрастает концентрация ионов за счет диссоциации электролита. В растворах электролитов вследствие электролитической диссоциации и увеличения числа частиц опытное осмотическое давление всегда больше, чем теоретически вычисленное по уравнению:
Ассоциация молекул вещества – причина понижения значений коллигативных свойств по сравнению с вычисленными значениями (например, As2S3).
Значение его увеличивается по мере разбавления электролита, приближаясь к определенному пределу для каждого отдельного электролита.
Если при диссоциации молекулы образуется два иона:
При вычислении степени диссоциации сильных электролитов говорят не об истинной, а о «кажущейся» степени диссоциации вещества в растворе, т.к. при опытном определении степень диссоциации сильных электролитов всегда оказывается меньше 100%. Это объясняется проявлением электростатического притяжения между ионами, вследствие чего активность их уменьшается и создается видимость неполной диссоциации.
Осмолярная и осмоляльная концентрация
Осмолярная концентрация раствора х арактеризует содержание подвижных частиц в миллиосмолях в 1 л раствора /
Осмолярная концентрация с вязана с его молярной концентрацией через изотонический коэффициент:
|
|||||||||||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 408; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.71.149 (0.008 с.) |

 – концентрация растворенного вещества;
– концентрация растворенного вещества; . Определите
. Определите 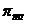 .
.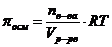
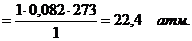 или
или 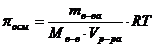 .
.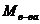 , тем
, тем 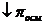 (например, белки).
(например, белки).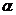 и связь между
и связь между 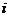
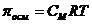 . Степень отклонения наблюдаемого осмотического давления
. Степень отклонения наблюдаемого осмотического давления 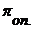 от теоретически вычисленной величины
от теоретически вычисленной величины 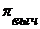 выражается изотоническим коэффициентом (i) т.е.
выражается изотоническим коэффициентом (i) т.е. 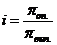 . Поэтому при вычислении осмотического давления растворов электролитов в уравнение вводят поправочный (изотонический) коэффициент:
. Поэтому при вычислении осмотического давления растворов электролитов в уравнение вводят поправочный (изотонический) коэффициент: 
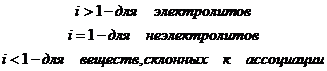
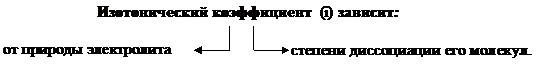
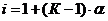 или
или 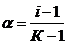
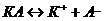 , то К=2 и формула примет простой вид:
, то К=2 и формула примет простой вид: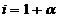 или
или 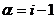

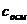 в практической медицине
в практической медицине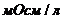 /, а осмоляльная концентрация – в 1 кг растворителя /
/, а осмоляльная концентрация – в 1 кг растворителя / 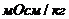 /. Биологические среды (сыворотка крови и моча) – это относительно разбавленные системы, поэтому разница между осмолярностью и осмоляльностью незначительная, т.е. эти термины взаимозаменяемые. Определяется криометрией.
/. Биологические среды (сыворотка крови и моча) – это относительно разбавленные системы, поэтому разница между осмолярностью и осмоляльностью незначительная, т.е. эти термины взаимозаменяемые. Определяется криометрией.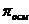 внутри и вне клетки одинаково, т.е. осмоляльность внутриклеточной жидкости равна осмоляльности плазмы крови.
внутри и вне клетки одинаково, т.е. осмоляльность внутриклеточной жидкости равна осмоляльности плазмы крови. 



