Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
История открытия вирусов и задачи вирусологии. Роль отечественных и зарубежных ученых в развитии этой науки.Стр 1 из 48Следующая ⇒
ВОПРОС 1. История открытия вирусов и задачи вирусологии. Роль отечественных и зарубежных ученых в развитии этой науки. Первую вакцину для предупреждения – оспы предложил английский врач Э.Дженнер в 1796г. Задачи вирусологии: изучение морфологии, физиологии, генетике и эволюции вирусов. Разрабатывает методы их культивирования и идентификации, а также методы их диагностики, лечения и профилактики. 1897г – Ф.Леффлер и П.Фрош показали, что возбудитель ящура животных – вирус. ВОПРОС 2. Основные характерные свойства вирусов. 1. Не имеют клеточного строения 2. Ультрамикроскопические размеры (20 – 350 нм) 3. Содержит один тип нуклеиновый кислоты (ДНК или РНК) 4. Не способны к росту и бинарному делению 5. Размножаются путем воспроизведения себя из собственной геномной нуклеиновой кислоты 6. У вирусов нет собственных белоксинтезирующих систем 7. Являются облигатными внутриклеточными паразитами ВОПРОС 3. Морфология вирусов и данные о кристаллизации вирусов. Выделяют вирусы палочковидные (Эбола), пулевидные (бешенство), сферические (герпес вирусы), овальные (вирус оспы), бактериофаги. В 1935г – У.Стенли выделил вирус табачной мозаики в кристаллической форме и доказал его молекулярную природу.
ВОПРОС 4. Тельца – включения и элементарные тельца. Методы их обнаружения, примеры. Тельца – включения – образования, состоящие или из скоплений вирусных частиц (вирионов), или из клеточного материала. Представляют собой овальные оксифильные тельца величиной 1 – 10 мкм, периферически окруженные светлой зоной – мантией. ВОПРОС 5. Характеристика бактериофагов, как представителей вирусов, их применение. 1. Неклеточные формы жизни 2. Содержат одну нуклеиновую кислоту (ДНК или РНК) 3. Отсутствуют белоксинтезирующие системы и самостоятельный метаболизм 4. Облигатные внутриклеточные паразиты на генетическом уровне Используют их для борьбы с бактериями, вызывающими заболевания живых организмов. ВОПРОС 6. Величина вирусов и методы её определения. Фильтрабельность и адсорбционная способность вирусов. Величина вирусов варьирует от 20 до 300 нм. Для определения концентрации частиц и их размеров служит свет. Измерив интенсивность света, рассеиваемого в растворе, можно установить именно эти характеристики. Причем по тому, как изменяется количество света, рассеянного под разными углами, можно рассчитать даже степень асимметрии удлиненных вирусов. Фильтрующиеся вирусы - это название было дано потому, что агенты, о которых идет речь, проходят через поры таких фильтров, которые задерживают самых маленьких микробов, и эта способность фильтроваться является одним из наиболее характерных их свойств. Взаимодействие вируса с клеткой начинается с процесса адсорбции, т. е. прикрепления вирусов к поверхности клетки. Это высоко специфический процесс. Вирус адсорбирует я на определенных участках клеточной мембраны — так называемых рецепторах. Клеточные рецепторы могут иметь разную химическую природу, представляя собой белки, углеводные копоненты белков и липидов, липиды. Число специфических рецепторов на поверхности одной клетки колеблется от 104 до 105. Следовательно, на клетке могут адсорбироваться десятки и даже сотни вирусных частиц.
ВОПРОС 7. ВОПРОС 8. Химический состав вирусов. Нуклеиновые кислоты (ДНК (4-40%) /РНК (1-4%)), белок (50-90%) (структурный, неструктурный), липиды (4-42%), углеводы (3-10%) ВОПРОС 9. Ферменты. Регулирование процессов репродукции вирусов выполняют структурные или неструктурные вирусные белки (ферменты). Ферменты играют важную роль в репродукции вируса, т.к. участвуют в репликации вирусных нуклеиновых кислот. Среди ферментов особое значение принадлежит ДНК-зависимой РНК-полимеразе и РНК-зависимой РНК-полимеразе (обратной транскриптазе). Вирусные ферменты подразделяются на вирионные и вирусиндуцированные. Вирионные ферменты входят в состав внеклеточных вирионов, приносятся в клетку при инфицировании и участвуют в процессах репродукции вирусов. Они подразделяются на 2 группы: ферменты первой группы обеспечивают проникновение вирусных нуклеиновых кислот в клетку и выход дочерних вирусных популяций из клетки, а ферменты второй группы участвуют в процессах репликации и транскрипции вирусного генома внутри инфицированной клетки. Вирусиндуцированные ферменты детерминированы вирусным геномом. Эти ферменты синтезируются непосредственно в клетках после инфицирования их вирусом, участвуют в процессах образования вирусного потомства, но в дальнейшем не входят в состав вирионов. РНК-содержащие ретровирусы имеют уникальный путь репродукции. После проникновения в клетку генетическая информация с РНК этих вирусов переписывается на ДНК. Этот процесс называется обратной транскрипцией. Для его осуществления требуется специфический фермент - обратная транскриптаза или ревертаза. Этот фермент приносится в клетку в составе ретровирусов. Обмен веществ. Вирусы не имеют собственного обмена веществ (метаболизма), живут и размножаются за счет ферментов и веществ клетки, в которой они паразитируют ВОПРОС 10. Нуклеиновые кислоты, как хранители и переносчики наследственных признаков вирусов, в том числе и фактора инфекционности. Нуклеиновые кислоты представляют собой линейные полимеры, состоящие из нуклеотидов. Нуклеотиды состоят из трех частей: остатка фосфорной кислоты, углеводного остатка (дезоксирибозы для ДНК, рибозы для РНК) и азотистого основания. Разнообразие структуры нуклеиновых кислот обусловлено различным порядком чередования в их цепях нуклеотидов. В отличие от клеток, вирусы содержат лишь один вид нуклеиновой кислоты – либо РНК, либо ДНК. И та, и другая может быть хранителем наследственной информации, выполняя таким образом, функции генома. Как и в других живых системах, у вирусов соответствие между аминокислотной последовательностью белка и нуклеотидной последовательностью геномной нуклеиновой кислоты устанавливается с помощью универсального вырожденного генетического кода, где кодирующей единицей является триплет нуклеотидов (кодон). В вирусных системах используются те же наборы кодоновых значений, что и в бактериальных, архейных и эукариотических системах. Однако у вирусов генетическая информация может храниться, как в смысловой полинуклеотидной цепи, так и в последовательности матричной цепи. Несмотря на микроскопические размеры, нуклеиновые кислоты вирусов несут информацию не только о капсидных белках, но и о ферментах, необходимых для синтеза ДНК, РНК и их модификации, для синтеза РНК транскриптов и их процессинга, для обеспечения синтеза белков и их посттрансляционной модификации и воздействия на биосинтетические процессы клетки-хозяина. Например, геном бактериофага Т4 кодирует несколько сотен белков, из них не менее 30-ти – ферменты. Для сохранения генетической информации в окружающей среде и передачи ее новому поколению вирусы упаковывают геномные нуклеиновые кислоты в белковый капсид и часто в суперкапсид (липидсодержащая оболочка), формируя внеклеточную форму вируса – вирион. Как правило, вирионы, попадая в клетку, обеспечивают продуктивный инфекционный цикл, давая вирусное потомство. Однако целый ряд так называемых интегративных вирусов встраивают свой геном в хромосомы хозяина, в том числе клеток зародышевой линии, обеспечивая длительное сохранение генетической информации вируса в ряду поколений хозяина.
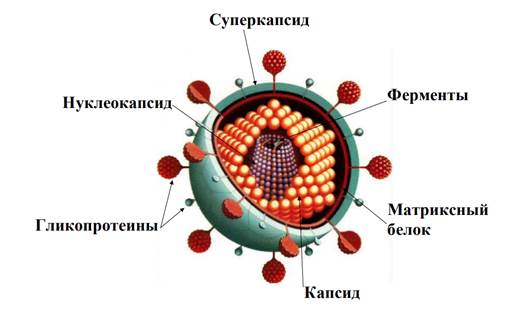
ВОПРОС 11. Вирусные белки, их значение и характеристика. Белки составляют от 50 до 90% всей массы вирусов. По аминокислотному составу вирусные белки принципиально не отличаются от белков позвоночных. Основная часть белка входит в состав вирусных оболочек. Небольшое количество белка связано с нуклеиновой кислотой и сосредоточено в центральной части вириона. Вирусные белки подразделяются на структурные и неструктурные. Структурные вирусные белки входят в состав зрелых внеклеточных вирионов. В зависимости от места расположения в вирионе выделяют следующие структурные белки: капсидные белки, матриксные белки и суперкапсидные белки (рисунок 1).
Рисунок 1 – Локализация структурных вирусных белков.
Белки вирусного капсида (капсомеры) являются собственно капсидными белками. Среди капсидных белков выделяют группу полипептидов, образующих комплекс с вирусными нуклеиновыми кислотами. Эти белки называются нуклеокапсидными (NP-белками). Некоторые вирусы в составе нуклеокапсида несут ферменты, необходимые для репликации вируса в инфицированной клетке. Например, в вирионах минус-нитевых РНК-содержащих вирусов имеется РНК-зависимая РНК-полимераза (транскриптаза); в вирионах ретровирусов присутствует РНК-зависимая ДНК-полимераза (обратная транскриптаза, ревертаза). У простых вирусов в составе капсида находятся также поверхностные или рецепторные белки.
Среди суперкапсидных белков выделяют: - наружный белок (выполняет функции рецепторного белка), - мембранный белок (обеспечивает интернализацию вируса, то есть проникновение вируса в клетку и его депротеинизацию, - матриксный белок (выполняет структурные функции). Суперкапсидные белки (пепломеры) располагаются в липопротеиновой оболочке сложных вирусов и являются гликопротеинами. У большинства сложных вирусов гликопротеины формируют на поверхности вириона выступы или шипы длиной 7-10 нм. Неструктурные вирусные белки не входят в состав вириона. Они кодируются вирусным геномом, образуются внутри инфицированной клетки и принимают участие в процессах внутриклеточной репродукции вирусов. В последующем они не встраиваются в состав дочерних вирионов. К неструктурным белкам относятся регуляторы экспрессии вирусного генома, предшественники вирусных белков, ингибиторы клеточного биосинтеза, вирусные ферменты. Вирусные белки выполняют следующие функции: - защитная - экранирование нуклеиновой кислоты вируса от ультрафиолетовых лучей, химических веществ, нуклеаз. - адресная - адсорбция вируса на клеточных рецепторах с помощью прикрепительных белков и проникновением вириона в чувствительную клетку хозяина. У сложных вирусов адресную функцию выполняют белки суперкапсида, а у простых вирусов - один из белков капсида. На поверхности одной клетки имеется до 104 -105 рецепторов для адсорбции вирусов. Для каждого вируса имеются определенные чувствительные клетки (тропизм вирусов): для вируса гриппа чувствительными клетками является мерцательный эпителий верхних дыхательных путей (эпителиотропный вирус), для вируса бешенства - нейроны головного мозга (нейротропный вирус). - регулирующая - регулирование процессов репродукции вирусов. Эту функцию выполняют структурные или неструктурные вирусные белки (ферменты). Ферменты играют важную роль в репродукции вируса, так как участвуют в репликации вирусных нуклеиновых кислот. ВОПРОС 12 ВОПРОС 13. ВОПРОС 14. Методы концентрации вирусов. Методы концентрации вирусов в рабочей суспензии. При многих вирусных инфекциях наблюдается феномен посмертной аутостерилизации. В таком случае вирус настолько мал, что выделить его не удается, поэтому применяют концентрацию вируса, используют 3 метода: - метод дифференциального центрифугирования; - метод фильтрации рабочей суспензии через коллоидные фильтры; - адсорбционный метод.
1. Метод дифференциального центрифугирования:
Метод основан на том, что вирусные частицы в жидкости значительно легче суспензируются, чем обрывки тканей или микроорганизмов. Метод заключается в следующем: - 10% рабочую суспензию разливают в стерильные центрифужные пробирки и центрифугируют при 2,5 - 3 тыс. об/мин в течение 10-15 мин. (оседают твердые частицы и тканевые элементы); - берется 2/3 надосадочной жидкости, центрифугируется при 6,0 – 8,0 тыс. об/мин - 15-20 мин. (оседают микроорганизмы); - берется 2/3 надосадочной жидкости, центрифугируется 20–25 тыс. об/мин - 20-25 мин. (оседают вирусы). - осторожно удаляют 2/3 надосадочной жидкости, встряхивают, вирус суспензируется и его концентрация в 2-3 раза будет выше, чем в первоначально приготовленной рабочей суспензии, и он будет очищен от тканевых элементов и микроорганизмов.
2. Метод фильтрации рабочей суспензии через коллоидные фильтры: Поры коллоидных фильтров пропускают только воду, но не пропускают микробы и вирусы. При фильтрации 10% рабочей суспензии вирусы адсорбируются на поверхности фильтра, микробы нет. Фильтр промывают фосфатно-буферным раствором. При этом удаляются крупные тканевые частицы и значительная часть микрофлоры. Фильтр измельчают и помещают в меньший объемом стерильного фосфатного буфера. Центрифугируют 10-15 минут при 8000 об/мин. При этом в осадок уйдут частицы коллоидного фильтра, бактериальная микрофлора. А в надосадочной жидкости останется вирус, и его концентрация будет больше, чем в исходном растворе.
3. Адсорбционный метод (по Соколову): Метод основан на способности вирусов адсорбироваться на поверхности эритроцитов. Спектр адсорбционной способности вируса широк – частицы глины, гипса, угля, гидроокись алюминия и др., что находит применение в вирусологической практике. Сущность метода: берется 20 мл вируссодержащей жидкости, добавляется 1%-ая взвесь отмытых эритроцитов кур или других животных (1% к объему жидкости). Смесь встряхивают, помещают в холодильник при температуре +40℃...+50℃ на 2-3 часа. При этом вирус адсорбируется на эритроцитах. Смесь центрифугируют при 1,5 - 2,5 тыс. об/мин - 5-10 минут, в результате чего в осадок выпадают эритроциты вместе с адсорбированным вирусом. Надосадочную жидкость сливают, добавляют к осадку 2 мл физиологического раствора, осадок встряхивают, помещают в термостат при температуре 370℃ на 2 часа, где происходит элюция (сползание) вируса с эритроцитов. Суспензию центрифугируют при 1,5 - 2,0 тыс. об/мин - 5-10 минут. В осадок выпадают эритроциты, а в надосадочной жидкости находится вирус концентрация которого в 10 раз больше, чем в исходном вируссодержащем материале.
ВОПРОС 15. ВОПРОС 17. ВОПРОС 18. Тропизм вирусов. Вирусы могут развиваться только в определенных клетках. По тропизму вирусы подразделяются на: 1. Пантропные (поражают различные ткани организма – чума свиней) 2. Нейротропные (поражающие центральную нервную систему – энцефалит) 3. Дерматотропные (вызывают поражение кожи – вирус оспы) 4. Эпителиотропные (вирус Ящура в эпителиальных тканях) 5. Пневмотромные (поражают верхние дыхательные пути) 6. Гематотропные (поражают клетки крови - вирус лейкоза) В других источниках вирусы по тропизму делят на 3 основные категории: 1. вирусы, поражающие слизистые оболочки респираторных органов или желудочно-кишечного тракта (ортомиксо-, корона-, рота-, торовирусы, вирусы парагриппа, обширная группа мелких энтеропатогенных вирусов); 2. вирусы, реплицирующиеся на слизистых поверхностях, а затем системно распространяющиеся через кровоток или нервную систему и вызывающие поражения висцеральных органов-мишеней, кожи или ЦНС (пикорна-, парамиксо-, герпес-, парво-, калици-, аденовирусы); 3. вирусы, проникающие непосредственно в кровяное русло инъекционным путем, а затем мигрирующие к своим органам-мишеням (альфа-, флави-, бунья-, рабдо-, орби-, вирусы гепатита В). ВОПРОС 19. Классификация вирусов. Современная классификация является универсальной и опирается на фундаментальные свойства вирионов, из которых ведущими служат признаки, характеризующие нуклеиновую кислоту, морфологию и антигенные свойства. Классификация вирусов предусматривает следующие таксономические группы: вид, род, семейство, класс, отряд, тип. Вид – это совокупность схожих вирусов, которые имеют одинаковое строение, функции и происхождение. Номенклатура вирусов. Всем вирусам присвоены латинские названия. Научные названия вирусов пишутся с заглавной буквы и состоят из двух латинских слов, означающих род и вид. Название рода стоит на первом месте и пишется с прописной буквы, а название вида – на втором и пишется со строчной буквы. Пример: Семейство Picorviridae, Род Rinovirus, Вид Rinovirus aphtae В зависимости от того, кого они поражают, все вирусы подразделяют на: - вирусы позвоночных; - вирусы растений; - вирусы простейших; - вирус беспозвоночных. В основу классификации положены следующие основные свойства вирусов: 1. Тип нуклеиновой кислоты. Все вирусы позвоночных подразделяют на 2 подтипа – ДНК и РНК-содержащие. 2. Количество нитей в ДНК и РНК. 3. Наличие второй липопротеидной оболочки. 4. Чувствительность вирионов к органическим растворителям. 5. Тип укладки (симметрии) капсомеров в белковой оболочке вирионов. 6. Количество капсомеров в вирионах. 7. Размер вирионов в нанометрах. 8. Место репродукции вирионов. 9. Способность агглютинировать эритроциты.
Вирусы позвоночных входят в 28 семейств, из них: 10-ДНК-содержащие 18-РНК-содержащие.
ВОПРОС 20. ВОПРОС 21. ВОПРОС 22. ВОПРОС 23. Цитопагенное действие (ЦПД) или цитопатический эффект (ЦПЭ) и гемадсорбция. Обнаружить вирус в клетках можно по цитопатическому действию или цитопатическому эффекту. ЦПД – это любые изменения клеток под влиянием размножающегося в них вируса. Проявляются в виде многообразных функциональных, биохимических и структурных изменений. Функциональные и биохимические изменения в клетке возникают вскоре после инфицирования клетки вирусом. Они заключаются в угнетении процессов деления клеток, синтеза клеточных нуклеиновых кислот (ДНК и РНК) и белков, а на более поздних стадиях инфекционных процесса — в полном прекращении синтетических процессов (в клетке прекращается собственный метаболизм). Для обнаружения ЦПД зараженные культуры клеток просматривают под малым увеличением светового микроскопа. Наиболее существенно различаются три формы ЦПД: 1. Фрагментация. Разрушение клеток на отдельные фрагменты (вирус везикулярного стоматита). 2. Округление. Клетки принимают шаровидную форму и отделяются от стекла (аденовирусы). 3. Симпластообразование. Образование гигантских клеток: цитоплазма соседних клеток сливается вследствие растворения клеточных оболочек и образуется одна большая клетка со многими ядрами (вирус чумы КРС).
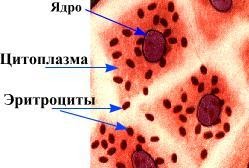
Гемадсорбция – адсорбция эритроцитов на поверхности пораженных вирусом клеток. Используется только для индикации вирусов, содержащих гемагглютинины. В пробирки с зараженным вирусом культурой ткани вносят 0,2 мл 0,4%-ной взвеси эритроцитов. Пробирки встряхивают и оставляют в наклонном положении. Длительность контакта эритроцитов с клетками зависит от температуры инкубации и вида вируса. Учет реакции производят под малым увеличением микроскопа после непродолжительного покачивания пробирки для отделения неадсорбированных эритроцитов от поверхности клеток. При вирусной гемадсорбции эритроциты прочно фиксированы на клетках и сохраняются на них после 1-2 кратного отмывания. Адсорбируясь на поверхности пораженных вирусом клеток, эритроциты образуют характерные скопления.
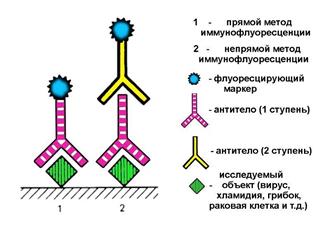
ВОПРОС 24. Иммунофлуоресценция. Прямая иммунофлуоресценция – обнаружение вирусных антигенов в интересующем образце окрашиванием со специфическим меченым флуоресцином антивирусным антителом. Срез замороженной ткани, клеточный мазок или клеточный монослой на покровном стекле обычно фиксируется метанолом или ацетоном и заливается флуоресцином, конъюгированным с противовирусным антителом. Затем несвязанные антитела отмывают. Клетки исследуют при помощи световой микроскопии, используя мощный источник ультрафиолетового света. Зеленый свет, выделяемый образцом, обнаруживается при помощи встроенного в окуляры фильтра, который поглощает весь случайный ультрафиолетовый и голубой свет. Непрямая иммунофлуоресценция- противовирусные антитела являются не мечеными. Они связаны с антигеном и их распознают при помощи конъюгированного с флуоресцином антииммуноглобулина. Респираторные инфекции, вызванные парамиксовирусами, ортомиксовирусами, аденовирусами и герпесвирусами, определяются благодаря быстрой диагностики при помощи иммунофлуоресценции. Также этот метод может применяться в отношении тканей, например, при биопсии для диагностики герпесвирусных заболеваний или при аутопсии для подтверждения бешенства животного, умерщвленного после укуса человека.
ВОПРОС 25. Методы серологической диагностики вирусных болезней. Серологические методы могут быть использованы для обнаружения в исследуемом материале как специфических антител, так и вирусных антигенов. Для этой цели исследуют парные сыворотки крови больных животных, для получения которых от каждого животного кровь для исследования на наличие специфических антител берут дважды с интервалом в 2—3 нед: в начале заболевания (в острой фазе) и в конце его (в период выздоровления — реконвалесценции). Серологические реакции: 1. Реакция связывания комплемента.2. Реакция пассивной гемагглютинации и ее варианты (РНАг, РНАт).3. Реакция торможения гемагглютинации.4. Реакция гемагглютинации иммунного прилипания (комплекс антиген + антитело в присутствии комплемента адсорбируется на эритроцитах),ИФА и тд.
ВОПРОС 26. РЕАКЦИЯ ТОРМОЖЕНИЯ ГЕМАГГЛЮТИНАЦИИ(РТГА) Гемагглютинины вирусов склеивают эритроциты. Это свойство используют в реакции гемагглютинации для индикации и титрования вирусов, что необходимо для последующей постановки РТГА. Реакция торможения гемагглютинации основана на блокаде, подавлении антигенов (гемагглютининов) вирусов антителами иммунной сыворотки, в результате чего вирусы теряют свойство агглютинировать эритроциты. РТГА применяют для диагностики многих вирусных болезней, возбудители которых (вирусы гриппа, кори, краснухи, клещевого энцефалита и др.) могут агглютинировать эритроциты различных животных. Положительная реакции - осадок в виде "зонтика", отрицательная - в виде "пуговицы". Вывод: реакція положительная в 1 ряду с сывороткой типа А, т.к. произошло торможение гемаглютинации, следовательно заболевание визвано вирусом типа А. ВОПРОС 27. ВОПРОС 28. ВОПРОС 29. Сущность реакции связывания комплемента (РСК) и её значение в диагностике вирусных болезней животных. Реакция связывания комплемента (РСК) заключается в том, что при соответствии друг другу антигены и антитела образуют иммунный комплекс, к которому через Fc-фрагмент антител присоединяется комплемент (С), т. е. происходит связывание комплемента комплексом антиген—антитело. Если же комплекс антиген—антитело не образуется, то комплемент остается свободным. Специфическое взаимодействие АГ и AT сопровождается адсорбцией (связыванием) комплемента. Поскольку процесс связывания комплемента не проявляется визуально, Ж. Борде и О. Жангу предложили использовать в качестве индикатора гемолитическую систему (эритроциты барана + гемолитическая сыворотка), которая показывает, фиксирован ли комплемент комплексом АГ-АТ. Если АГ и AT соответствуют друг другу, т. е. образовался иммунный комплекс, то комплемент связывается этим комплексом и гемолиза не происходит. Если AT не соответствует АГ, то комплекс не образуется и комплемент, оставаясь свободным, соединяется со второй системой и вызывает гемолиз. Комплемент – это сложный комплекс, входящий в состав сыворотки крови всех млекопитающих. Но больше всего комплемента в сыворотках крови морской свинки и человека (0-группа). Комплемент обладает следующими свойствами: легко разрушается под действием тепла и света (t 56 °С полностью разрушает комплемент за 30 мин); адсорбируется на любом комплексе антиген – антитело независимо от его природы; его присутствие необходимо для протекания некоторых серологических реакций (в частности для лизиса эритроцитов барана сывороткой кролика, иммунизированного эритроцитами барана). Реакцию ставят в два этапа. Сначала в пробирки наливают равные объемы антигена, сыворотки и комплемента. Полученные смеси выдерживают либо 30 мин при 37 °С, либо 18–20 ч при 4 °С. Если в сыворотке имеются антитела, гомологичные взятому антигену, образуется комплекс антиген + антитело и на нем адсорбируется присутствующий в смеси комплемент, а свободный в этом случае исчезает из смеси. Если же в сыворотке нет антител, гомологичных взятому антигену, комплекс антиген + антитело не образуется и в смеси остается свободный комплемент. На втором этапе РСК устанавливают, остается ли свободный комплемент или он исчез. К 3-компонентным смесям дополнительно добавляют равные объемы гемолизина кроликов, 3 %-й суспензии эритроцитов барана и вторично выдерживают при 37 °С 15–20 мин. Результаты РСК оценивают в процентах гемолиза или в крестах. Для обнаружения в биоматериале антигенов определенного вируса с помощью РСК готовят суспензию этого материала, разливают ее по пробиркам и добавляют равные объемы сыворотки крови, содержащей антитела к предполагаемому вирусу. Затем в каждую пробирку доливают такие же объемы комплемента в разведениях (обычно с коэффициентом разведения 1, 2). Смеси выдерживают 18–20 ч при 4 °С, добавляют гемолитическую систему и после 20 мин нагревания при 37 °С учитывают результат. Параллельно ставят со всеми дозами 20 комплемента контроля с нормальными сывороткой, антигеном и контроли всех антигенов. Если окажется, что хотя бы с одной дозой комплемента РСК в опыте будет положительной, а во всех контролях отрицательной, то это указывает на наличие в биоматериале антигена, гомологичного антителам сыворотки. В такой модификации РСК достаточно чувствительна, но выявляет антигены не только истинно специфические для данной сыворотки, но и родственные им, то есть чувствительность РСК здесь групповая. Рис. 1 Схема РСК с сывороткой больного Рис. 2 Схема РСК с сывороткой здорового Применение. РСК применяют для диагностики многих инфекционных болезней, в частности сифилиса (реакция Вассермана). Также РСК применяют для идентификации вирусов, например, для определения типа и варианта вируса ящура. Реакцию связывания комплемента ставят с двукратными разведениями стандартных сывороток (содержащих антитела к определенным вирусам) и исследуемым вирусом, используемым в качестве антигена. Сыворотки берут с одинаковыми титрами антител. Гомологичной для исследуемого вируса признают ту сыворотку, которая дает положительную РСК в наиболее высоком разведении. Постановка реакции в значительной степени осложняется необходимостью предварительного титрования практически всех ее компонентов. При необходимости ознакомиться с деталями техники идентификации вирусов в РСК рекомендуется проработать, например, инструкцию по типированию вируса ящура.
ВОПРОС 30. Сущность реакции гемадсорбции (РГАд) и задержки гемадсорбции (РЗГАд) Гемадсорбция – это прикрепление эритроцитов крови к поверхности зараженных клеток; наблюдают при добавлении в испытуемую культуру клеток эритроцитов того вида животных, которые агглютинируются вирусом, присутствующим в зараженных клетках. Реакция гемадсорбции (Ргад) ставится на культурах ткани при некоторых вирусных болезнях с целью обнаружения вируса в клетках зараженных культур ткани на ранних стадиях размножения вируса, то есть до появления цитопатогенного действия (ЦПД). По своей сущности эта реакция не является серологической и основана на способности зараженных вирусом клеток культуры ткани адсорбировать на себе эритроциты. Для постановки РГад используют зараженные вирусом культуры ткани в пробирках. В пробирки с культурой ткани, зараженной вирусом, не удаляя поддерживающую среду, вносят 0,2 мл 0,5% взвеси эритроцитов. После этого пробирки оставляют в наклонном положении под углом в 7-10° на 10-15 минут и по истечению этого времени просматривают под микроскопом. При постановке реакции во втором варианте из пробирок с зараженной культурой ткани предварительно сливают культуральную жидкость, затем вносят 0,2 мл 0,5% взвеси эритроцитов, пробирки оставляют в наклонном положении на 10-15 минут, затем культуру ткани промывают физиологическим раствором (осторожно ополаскивают и сливают) и смотрят под микроскопом. При положительной реакции эритроциты адсорбируются на зараженных клетках и хорошо видны в форме гроздьев, розеток или беспорядочных скоплений. Если клетки не инфицированы вирусом, то на них эритроциты не адсорбируются и свободно плавают в культуральной жидкости (в первом варианте) или смываются при промывании физраствором и не видны (во втором варианте). Реакция задержки гемадсорбции. В основе этой серологической реакции задержки гемадсорбции (РЗГад) лежит способность специфической иммунной сыворотки нейтрализовать гемадсорбирующие свойства клеток культуры ткани, зараженных вирусом. С помощью РЗГад можно идентифицировать вирус по известной иммунной сыворотке или выявлять антитела в исследуемых сыворотках крови по известному антигену (вирусу). Для постановки реакции из зараженных пробирок с культурой ткани сливают поддерживающую среду и культуру ткани промывают ополаскиванием раствором Хенкса, затем в пробирки вносят по 0,2 мл специфической иммунной сыворотки и 0,8 мл раствора Хенкса (в контрольные пробирки вносят только раствор Хенкса без добавления сыворотки). Сыворотку с зараженной культурой ткани вылеживают в термостате или при комнатной температуре 40-60 минут и затем в пробирки вносят по 0,2 мл 0,5% взвеси эритроцитов, оставляют на 10-15 минут и просматривают под микроскопом. При положительной реакции эритроциты свободно плавают в поле зрения. Это обусловлено тем, что гемадсорбирующая способность вируса нейтрализована антителами специфической сыворотки. При отрицательной реакции происходит адсорбция эритроцитов на поверхности клеток.
ВОПРОС 31. ВОПРОС 32. Генотипические формы изменчивости вирусов (мутации и рекомбинации). Спонтанные и индуцированные мутации вирусов, их значение. Вирусам, как и всем живым организмам, свойственны наследственность и изменчивость. Основной особенностью вирусного генома является то, что наследственная информация у вирусов может быть записана как на ДНК, так и на РНК. Геном ДНК-содержащих вирусов двухнитевой (исключение составляют парвовирусы, имеющие однонитевую ДНК), несегментированный и проявляет инфекционные свойства. У вирусов, принадлежащих к родам Poxvirus и Hepadnavirus геном представлен двумя цепочками ДНК разной длины. Геном большинства РНК-содержащих вирусов однонитевой (исключение составляют реовирусы и ретровирусы, обладающие двунитевыми геномами) и может быть сегментированным (представители родов Retrovirus, Orthomyxovirus, Arenavirus и Reovirus) или несегментированным. Вирусные РНК в зависимости от выполняемых функций подразделяются на две группы: - К первой группе относятся РНК, способные непосредственно транслировать генетическую информацию на рибосомы чувствительной клетки, т.е выполнять функции иРНК и мРНК. Их называют плюс-нити РНК и обозначают как +РНК (позитивный геном). Они имеют характерные окончания (`шапочки') для специфического распознавания рибосом. - У другой группы вирусов РНК не способна транслировать генетическую информацию непосредственно на рибосомы и функционировать как иРНК. Такие РНК служат матрицей для образования иРНК, т.е. при репликации первоначально синтезируется матрица (+РНК) для синтеза -РНК. Такой тип РНК определяют как минус-нить и обозначают -РНК (негативный геном). У вирусов этой группы репликация РНК отличается от транскрипции по длине образующихся молекул: при репликации длина РНК соответствует материнской нити, а при транскрипции образуются укороченные молекулы иРНК. Молекулы +РНК проявляют инфекционность, а -РНК не проявляют инфекционные свойства и для воспроизведения должны транскрибироваться в +РНК. Исключение составляют ретровирусы, которые содержат однонитевую +РНК, служащую матрицей для вирусной РНК-зависимой ДНК-полимеразы (обратной транскриптазы). При помощи этого фермента информация переписывается с РНК на ДНК, в результате чего образуется ДНК-провирус, интегрирующий в клеточный геном.
|
|||||||||
|
Последнее изменение этой страницы: 2021-01-09; просмотров: 274; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.27.232 (0.114 с.) |