
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 3.1.4. Особые случаи приготовления растворов.Содержание книги
Поиск на нашем сайте
1. Особые случаи приготовления растворов: - из ЛС труднорастворимых в холодной воде - из крупнокристаллических веществ - с гигроскопичными ЛС 2. Растворы с окислителями. 3. Растворы фурацилина 4. Растворы рибофловина, этакридиналактата 5. Растворы кальция глюконата. 6. Растворы натрия тиосульфата. 7. Растворы натрия гидрокарбоната 8. Растворы йодопирона
Для ускорения растворения веществ умеренно, мало или медленно растворимых применяют следующие приемы: - нагревание (труднорастворимые вещества) - предварительно измельчают в ступке (крупнокристаллические вещества) - комплексообразование (раствор Люголя) - применение солюбилизаторов в соответствии с НТД,(в качестве солюбилизаторов – поверхностно – активных веществ ПАВ) - особые приемы (раствор йода в спирте: вещество подвешивают в марлевом мешочке так, чтобы оно касалось только верхнего слоя растворителя, при этом насыщенный раствор опускается вниз, а вверх поднимается чистый растворитель. Скорость растворения возрастает.
Особые случаи приготовления растворов. 1. Труднорастворимые вещества в холодной воде, хорошо в горячей: дибазол, борная кислота, натрия тетраборат, кофеин, кислота никотиновая, глютаминовая кислота, кодеин, рибофлавин, глюконат кальция, этакридиналактат и др. Для их растворения используют горячую воду. 2. Крупнокристаллические вещества: магния сульфат, меди сульфат, натрия сульфат, алюмокалиевые квасцы. Их предварительно измельчают в ступке с небольшим количеством воды, затем добавляют еще воду, фильтруют через тампон, часть воды оставляют для споласкивания ступки и пестика. 3. С гигроскопичными веществами: а) Если вещество теряет сыпучее состояние, например кальция хлорид, то готовят концентрированный раствор (50%) б) Если не теряет сыпучее состояние, то его берут больше с учетом влажности (например, для глюкозы процент влажности указывается в сопроводительных документах при получении и переносится на этикетку штангласа)
Расчет ведут по формуле: Х = а – масса безводной глюкозы б – содержание влажности в % Возьми: Раствора глюкозы 10% - 200,0 22,22 Дай. Обозначь: воды до 200 мл или 184,67 мл mб/вглюк = mв.глюк= Норма отклонения прирост V = 22,22 значит воды до 200 мл или Vводы = 200 – 22,22 КУО глюкозы с влажностью 10% - 0,69 Растворы с окислителями. Окислители - нитрат серебра, перманганат калия, йод. Легко разрушаются в присутствии органических веществ (могут содержаться в воде, при фильтровании). Поэтому готовят на свежеперегнанной очищенной воде. Фильтруют при необходимости через стеклянные фильтры.
Растворы нитрата серебра Это вещество с нормируемыми дозами. Отвешивают на специальных весочках или на весах с пергаментной бумагой как окислитель. Технология изготовления: во флакон отмеривают необходимое количество воды. При растворении опускают один кристаллик нитрата серебра. Если нет мутной дорожки, то растворяют все количество. При необходимости раствор до1% можно профильтровать через маленький ватный тампон, тщательно промыть горячей очищенной водой (более крепкие растворы фильтруют через стеклянные фильтры). Оформляют дополнительной этикеткой «Обращаться с осторожностью». Опечатывают. Флакон темного стекла. Возьми: Раствора нитрата серебра из 0,06 – 120 мл 0,06 Дай. Обозначь: По столовой ложке 3 раза в день Vобщий=120 мл 120: 15 = 8 приемов р.д.=0,06: 8 = 0,0075 норма отклонения прирост V = 0,06
Растворы калия перманганата Медленно растворяется в холодной воде 1:18. Хорошо в горячей воде1:3,5. Отвешивают на весах с пергаментной бумагой. Технология изготовления: растворы до 1% готовят сразу во флаконе для отпуска. При необходимости до 5% растворы можно профильтровать через маленький ватный тампон, тщательно промытый горячей очищенной водой. Растворы 1% и более 1% готовят в ступке на горячей воде. Растирают перманганат калия с небольшим количеством горячей воды в ступке, затем добавляют еще воду и не фильтруя переносят во флакон для отпуска. Часть воды оставляют для споласкивания ступки. Отпускают во флаконе темного стекла.
Растворы йода Кристаллический йод очень мало растворим в воде 1:5000. Используют способность йода образовывать легкорастворимые комплексные соединения с калия или натрия йодидами. Применяют растворы йода водные и на глицерине. Растворы Люголя могут быть выписаны внутрь. Если не указана концентрация, то готовят 5% растворы йода внутрь. Наружно. Если не указана концентрация, то растворы Люголя наружно готовят 1% раствор йода. Технология изготовления: водные растворы йода готовят в мерной посуде или во флаконе для отпуска массо-объемным методом. Воды берут столько, сколько выписано калия йодида, растворяют калия йодид и в его насыщенном растворе растворяют йод (отвешивают на пергаментной бумаге).Затем объем раствора доводят до требуемого. Или воду можно рассчитать с учетом КУО йода и калия йодида:
Возьми: Раствора Люголя 20,0 Дай. Обозначь: По 5 капель внутрь 3раза в день на молоке
mйода = mку = 1,0 норма отклонений от Vоб. прирост V= 1,0 значит Vводы=20мл готовят во флаконе. Глицериновые растворы Люголя готовят по массе. Технология изготовления: в предварительно старированном флаконе растворяют калия йодид (воды берут столько, сколько выписано йода и калия йодида). В насыщенном растворе растворяют йод, затем отвешивают глицерин до нужной массы. Если в рецепте не указан растворитель, то готовят водный раствор Люголя. Возьми: Раствора Люголя на глицерине 20,0 У2 0,2 3 Дай. Обозначь: Для смазывания горла. КУ 0,4 2 воды0,6мл (12кап) 1 глицерин 18,8 4 Готовят во флаконе. 3. Растворы фурацилина. Фурацилин растворяется в соотношении 1:4200. Готовят в концентрации 1: 5000 на кипящем изотоническом растворе хлорида натрия (0,9%) Возьми: Раствора фурацилина 1:5000 – 300,0 0,06 Выдай. Обозначь: Для полоскания Натрия хлорида – 2,7 Воды 300мл mфур = норма отклонений в Vоб ДО = прирост V составит = 2,7 Мерным цилиндром отмеривают 300мл воды очищенной. Помещают в термостойкую колбу. Фурацилин отвешивают как красящее (на простой прокладке), помещают в колбу с водой, отвешивают и помещают в колбу натрия хлорид и ставят на плитку нагревают до растворения. После охлаждения переливают в мерный цилиндр, проверяют объем, при необходимости доводят объем водой очищенной до 300мл. Затем фильтруют во флакон. 4. Растворы рибофлавина, этакридиналактата. Рибофлавин и этакридинлактат (риванол) мало растворимы в воде. Для изготовления растворов рибофлавина используют нагревание т.е. готовят в колбе термостойкого стекла. Применяют в концентрации 0,01%; 0,02% Этакридиналактат легко растворим в кипящей воде. Поэтому его растворяют во всем количестве кипящей воды. Возьми: Раствора риванола 1:1000 – 200,0 0,2 Vобщий=200мл Для фурацилина, рибофлавина, риванола нет КУО, т. к. применяют растворы малой концентрации.
5. Растворы глюконата кальция. Готовят при нагревании. Применяют 5%, 10% концентрации. В такой концентрации получаются пересыщенные растворы. Для очистки добавляют активированный уголь в количестве 3% - 5% от массы глюконата кальция. Раствор кипятят с углем минут 10-15, затем фильтруют в горячем виде через фильтр бумажный и доводят объем до нужного. В растворы меньшей концентрации уголь не добавляют, а фильтруют через тампон.
6. Растворы тиосульфата натрия. Часто встречается в рецептах как раствор №1 по Демьяновичу (раствор №2-раствор хлороводородной кислоты) для лечения чесотки. Возьми: Раствора тиосульфата натрия 60% - 100,0
По авторской прописи раствор готовился по массе, т.е. 60,0 тиосульфата натрия и 40,0 воды; общая масса раствора 100,0. Объем полученного раствора составляет 40мл + 60,0 70,6 мл – 60,0 тиосульфата натрия 100мл – х х=85,0тиосульфата натрия. Технология изготовления: В мерной посуде в части горячей воды очищенной растворяют 85,0 натрия тиосульфата и объем раствора доводят до 100мл. Или используют КУО: Vводы=100-(85,0 В 57мл воды в подставке растворяют 85,0 натрия тиосульфата и фильтруют во флакон для отпуска.
7. Растворы гидрокарбоната натрия. Готовят на воде очищенной, температура до 20оС, т.к. при высокой температуре натрия гидрокарбонат переходит внатрия карбонат. При растворении избегают сильного взбалтывания.
8. Растворы йодопирона. Йодопирон- йодофор, представляющий собой смесь комплекса ПВП (поливинилпирролидона) – йода с калия йодидом. Это желто-коричневый аморфный порошок со слабым специфическим запахом, содержащий 6-8% активного йода. 1% раствор изготавливают в аптечных условиях. 150,0 порошка йодопирона (готовая фасовка) растворяют в 800мл очищенной воды. Во флакон емкостью 1л к навеске порошка (150,0) вначале прибавляют 200мл воды, встряхивают, перемешивают стеклянной палочкой. Оставляют на 0,5часа. Затем добавляют оставшуюся воду, встряхивают, через 10-15 минут. Раствор готов к применению. Хранят не более 2месяцев.
|
||||
|
Последнее изменение этой страницы: 2020-12-17; просмотров: 4178; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.6.140 (0.007 с.) |

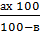 где х – масса водной глюкозы
где х – масса водной глюкозы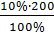 = 20,0
= 20,0 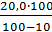 = 22,22
= 22,22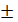 2% ДО =
2% ДО = 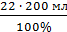 = 4 мл
= 4 мл 0,69 = 15,33 мл
0,69 = 15,33 мл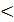 0,03 с.д 0,0225
0,03 с.д 0,0225 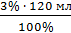 = 3,6 мл
= 3,6 мл 0,18 = 0,01мл, значит Vводы = 120 мл
0,18 = 0,01мл, значит Vводы = 120 мл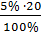 = 1,0
= 1,0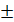 8% ДО =
8% ДО = 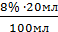 = 1,6мл
= 1,6мл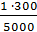 = 0,06
= 0,06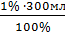 = 3мл
= 3мл


