Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изучение их влияния на показатели качества зародышей пшеницы
С целью дальнейшего изучения влияния ингибиторов на качественные показатели ЗП, опытные образцы, стабилизированные вышеприведенными смесями А-D органических кислот, были заложены на хранение в условиях холодильника при регулируемых параметрах (температура 4-6 оС, относительная влажность воздуха 75-80 %). ЗП смешивали с определенным количеством стабилизатора аналогично методу, приведенному в п. 3.1. Концентрацию композиций кислот в продукте варьировали в пределах 2-7 % с учетом синергетического эффекта смеси кислот относительно их индивидуального влияния. Применение смесей кислот в количестве 7 % позволило оказать сильное стабилизирующее действие на продукт и ликвидировать рост кислотности в течение всего периода хранения, но при этом значения этого показателя находились в диапазоне 12,9-14,2 мгКОН/г, что снижало технологическую пригодность конечного продукта (рисунок 3.10).
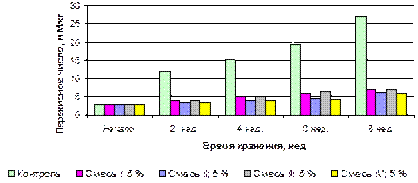
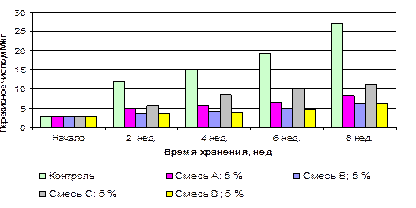
За два месяца существенно возросло перекисное число в контроле – с 2,8 мМ/кг до 27,1 мМ/кг (рисунок 3.11). При этом в образцах, содержащих композиции кислот в количестве 2 %, рост кислотного числа замедлялся, наиболее интенсивное воздействие оказывали композиции В, D (перекисные числа в продукте с этими смесями кислот достигли величин 10,0 мМ/кг и 13,0 мМ/кг соответственно), но этого было недостаточно для обеспечения требуемых показателей качества конечного продукта [15, 251].
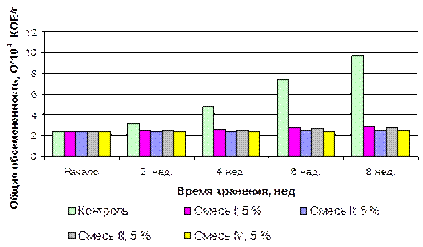
Изменение органолептических и физико-химических показателей (влажность, объемная масса, угол естественного откоса) хранящихся образцов в течение всего периода хранения были незначительными и были аналогичны соответствующим показателям, представленным в таблице 3.4. Введение в хранящуюся массу продукта смесей органических кислот способствовало подавлению роста микрофлоры (рис. 3.12). Следует отметить, что при обработке индивидуальными кислотами ЗП значения общей обсемененности в образцах на тот же период хранения были выше, чем при стабилизации комплексами органических кислот.
При введении в продукт ингибирующих смесей А, В, С, D, рост кислотного числа не происходил и составил 11,6 мгКОН/г, 12,3 мгКОН/г, 13,1 мгКОН/г и 12,1 мгКОН/г, соответственно.
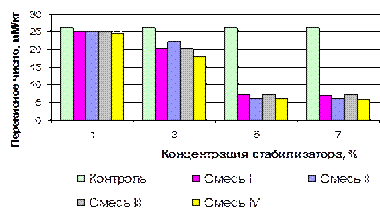
Рост перекисного числа (мМ/кг) в продукте, стабилизированном смесями А, В, С, D было незначительным: с 2,8 мМ/кг до 8,2 мМ/кг, 6,3 мМ/кг, 11,1 мМ/кг, 6,2 мМ/кг соответственно (рисунок 3.13). В образцах, обработанных индивидуальными кислотами рост этого показателя был значительно интенсивнее (на 19-45 %) [15].
Для оптимизации соотношения органических кислот в смесях были исследованы варианты бинарных композиций с диапазоном соотношений компонентов от 1:9 до 9:1. Оптимизацию количественного соотношения органических кислот в композиционных стабилизирующих смесях ЗП проводили посредством разработанного программного продукта на языке Python 2.6 с использованием метода линейного программирования и применением операционной системы Windows XP. Метод оптимизации количественного соотношения вносимых органических кислот в ЗП позволил рассчитать оптимальное процентное содержание аскорбиновой, янтарной и фумаровой кислот в стабилизирующих композиционных смесях I-IV. На основании выявленного механизма перекисного окисления липидной фракции ЗП совокупным критерием значимости, характеризующим степень влияния стабилизатора на хранящийся продукт, был выбран рост перекисного числа ЗП. Результаты оптимизационного расчета процентного соотношения органических кислот в композиционных смесях I-IV представлены на рисунках 3.14-3.17. Из номограмм (рисунок 3.14-3.17) следует, что заданный эффект достижим при содержании в композиционной смеси аскорбиновой кислоты – 60-65 %, фумаровой – 35-40 %; аскорбиновая кислота – 70-75 %, янтарная – 25-30 %.янтарной кислоты – 15-20 %, фумаровой – 80-85 %, аскорбиновой – 50-55 %; янтарной – 15-20 %; фумаровой - 25-30 %.
С целью разработки практических рекомендаций по режимам хранения ЗП были выбраны интервалы варьирования факторов (таблица 3.11). Воспользовавшись программой обучения и анализа обучения искусственной полносвязной нейронной сети (ИНС) на языке Python 2.7 с программными библиотеками математической обработки научных данных «scipy» был разработан программный продукт, с помощью которого экспериментальные данные были обработаны.
Таблица 3.10 Соотношения органических кислот в композициях с максимальным стабилизирующим эффектом
Для работы была выбрана полносвязная нейронная сеть. В качестве входных параметров нейронной сети рассматривали: влажность пшеничных зародышей (х 1, %), относительную влажность окружающего воздуха (х 2, %), температуру окружающей среды (х 3, оС) и концентрацию смеси органических кислот (х 4, %). Сеть будет иметь один выход – значение перекисного числа (у, мМ/кг). Время хранения считалось постоянным (8 недель). При определении диапазона изменения факторов интервалы измерений устанавливались таким образом, чтобы нужные нам величины располагались внутри интервала (таблица 3.12) [15, 251].
Таблица 3.12 Интервалы варьирования входных параметров нейронной сети
Искусственная нейронная сеть (ИНС) - математическая модель, построенная по принципу организации и функционирования биологических нейронных сетей — сетей нервных клеток живого организма. Нейронные сети позволяют решать очень большой круг практических проблем, в частности, классификаций. Задача, решаемая в данной работе, в представленном виде не является задачей классификации, но может быть сведена к ней[86, 124, 242]. При осуществлении функционирования нейрон одновременно принимает множество входных сигналов. Каждый вход нейронной сети обладает своим личным синоптическим весом, который оказывает влияние на него и необходим для функции сумматора. Вес считается мерой значимости входных связей. Весы влиятельного входа увеличиваются и, наоборот, вес несущественного входа принудительно сокращается, что характеризует силу входного сигнала. Весы могут меняться в соответствии с обучающими примерами, в качестве которых используются значения перекисных чисел на 8 неделе хранения зародышей пшеницы, стабилизированных комплексами органических кислот. Также влияние оказывает архитектура сети и правила обучения. Первым действием нейрона считается расчет взвешенной суммы всех входов, в результате будет получено одно число. Результат функции сумматора проходит через передаточную функцию и преобразуется в выходной сигнал. В передаточной функции для выявления выхода нейрона общая сумма сверяется с некоторым порогом. Если сумма больше значения порога, нейрон генерирует сигнал, в противном случае сигнал будет нулевым или тормозящим [40, 75, 277, 317, 350]. Далее после передаточной функции выходной сигнал проходит дополнительную обработку масштабирования, то есть результат передаточной функции множится на масштабирующий коэффициент и добавляется смещение. По аналогии с биологическим нейроном, каждый искусственный нейрон имеет один выходной сигнал, который передается множеству других нейронов. В основном, выход прямо пропорционален результату передаточной функции. В некоторых сетевых архитектурах результаты передаточной функции изменяются для создания соревнования между соседними нейронами. Нейронам предлагается соревноваться между собой, блокируя действия нейронов, имеющих несильный сигнал. Конкуренция может происходить между нейронами, расположенными на одном или разных слоях. Во-первых, конкуренция определяет, какой искусственный нейрон будет активным и обеспечит выходной сигнал. Во-вторых, конкурирующие выходы помогают выяснить, какой нейрон будет участвовать в процессе обучения [258, 316].
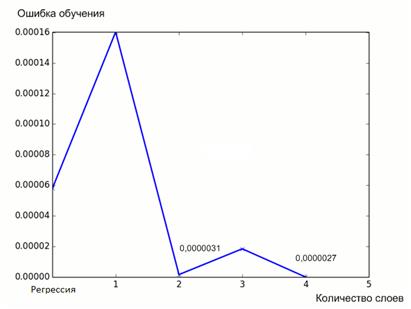
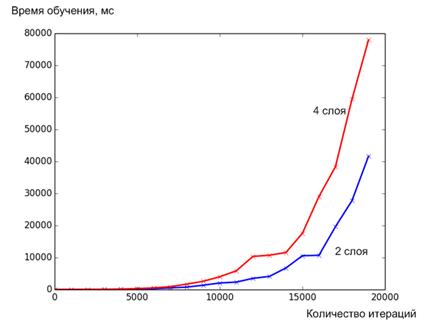
Целью обучения является настраивание весов соединений на входах каждого нейрона в соответствии с заданным алгоритмом обучения для получения требуемого результата. Существует два способа обучения: контролируемое и неконтролируемое. В случае неконтролируемого обучения система самоорганизовывается по внутреннему критерию, заложенному в алгоритм обучения. Контролируемое обучение (применяемое в нашем случае) требует обучающего множества данных или наблюдателя, который отслеживает эффективность результатов сети. Среди известных архитектурных решений выделяют группу слабосвязанных нейронных сетей, в которой нейроны связаны лишь со своими соседями и полносвязные сети (применяемые в нашем случае), в которых нейроны связаны по принципу “каждый с каждым”. Анализируя наиболее известные на данное время разработки нейронных сетей, необходимо отметить, что самым распространенным вариантом архитектуры являются многослойные сети с прямым распространением. Нейроны в данной архитектуре объединяются в структуры под названием слои, у которых существует один вектор входов. Внешний набор входов называется рецепторами, а внешний набор выходов из последнего слоя называются эффекторами. Между наборами входов и выходов имеется некоторое количество слоев [93, 258, 317, 349]. Далее, для исследования зависимости перекисного числа речь будет идти исключительно про полносвязанные нейронные сети. На рисунке 3.19 представлен результат обучения нейронной сети, где по оси абсцисс расположены значения количества слоев, по оси ординат – ошибка обучения. Несложно увидеть, что минимальная ошибка соответствует сетям с количеством слоев 2 и 4 (рисунок 3.19). Особенность нейронных сетей, как аналога биологического мозга, состоит в способности к обучению ”с учителем”, что означает наличие исходного обучающего множества. Обучение нейронной сетей в данном контексте рассматривается как синтез и анализ архитектуры и весовых коэффициентов нейронных связей в соответствии с данными обучающего множества для решения проблемы. Наличие экспериментальных данных в этой работе позволяет использовать режим контролируемого обучения. Были спроектированы и обучены несколько нейронных сетей. По результатам обучения, выбранные сети необходимо протестировать на скорость работы. Результаты исследования представлены на рисунке 3.20. Очевидно, что для моделирования следует использовать сеть с двумя слоями, как наиболее “быструю” с точки зрения эффективности использования машинного времени и ошибки обучения (рисунок 3.19).
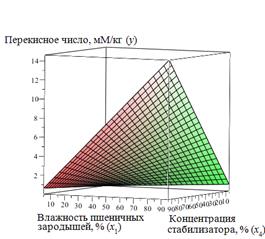
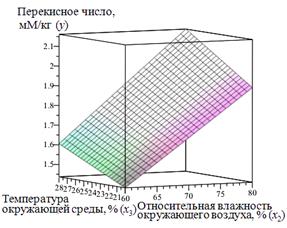
Коэффициенты выбранной нейронной сети представлены на рисунке 3.21. Результат работы ИНС представлен на рисунках 3.22, 3.23. Применяя разработанную и обученную нейронную сеть можно построить зависимость у (х 1, х 2, х 3, х 4) – это пятимерное пространство, которое сложно визуализировать. Для визуализации в трехмерном пространстве необходимо ограничить количество аргументов функции двумя. На рисунке3.22 представлен результат работы нейронной сети y (x 1, x 4) с зафиксированными входными параметрами (x 2 = 60, %, x 3=20, oC). На рисунке 3.23 представлен результат работы нейронной сети y (x 2, x 3) с зафиксированными входными параметрами (x 1 = 15 %, x 4=5 %).
Таблица 3.13 Изменение органолептических и физико-химических показателей качества зародышей пшеницы, стабилизированных композициями органических кислот
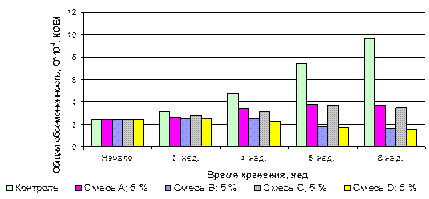
Из таблицы 3.13 видно, что в течение всего периода хранения органолептические показатели, влажность, объемная масса и величина угла естественного откоса не претерпевали существенных изменений (влажность изменялась не более 0,6 %). У хранящихся образцов продукта не наблюдалось слеживания и наличия посторонних привкусов и запахов. Применение композиций органических кислот существенно понижало величины общей обсемененности ЗП (рисунок 3.24). При стабилизации продукта композиционными смесями I, III значение показателя возрастало незначительно: с 2,4·104 КОЕ/г до 2,9·104 и 2,8·104КОЕ/г соответственно, что соответствует требованиям СанПин на пищевые продукты. Более интенсивное воздействие на микрофлору ЗП наблюдалось у продукта с ингибирующими смесями II, IV, в них к 8 неделе хранения общая обсемененность продуктов практически не изменялась и составила на конец хранения 2,5·104 КОЕ/г [15].
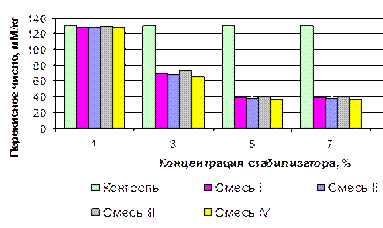
Рисунок 3.24. Изменение общей обсемененности в процессе хранения зародышей пшеницы, обработанных композициями органических кислот Кислотное число при введении в продукт ингибирующих смесей I, II, III, IV не изменялось и составило в течение всего периода хранения 11,8 мгКОН/г, 12,0 мгКОН/г, 13,9 мгКОН/г и 12,4 мгКОН/г, соответственно. В продуктах, обогащенных стабилизационными смесями I, II, III, IV рост перекисного был незначительным и к 8 неделе хранения составил 7,1 мМ/кг, 6,1 мМ/кг, 7,2 мМ/кг и 5,9 мМ/кг соответственно (рисунок 3.25). Рост перекисного числа был менее интенсивным в продукте, стабилизированном смесью IV, более значительным – в ЗП со смесью I.
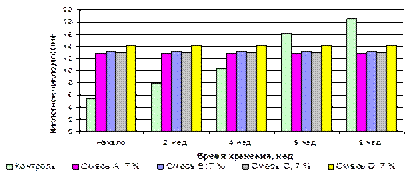
В образцах со смесями I-IV наблюдалось значительное снижение активности липазы, липоксигеназы и каталазы (таблица 3.14). Использование 5% смеси I снижало активность липазы с 3,9 до 2,6 мкМ/мин·мг, липоксигеназы – с 4,2 до 2,9 мМ/мл·мин, каталазы – с 3,5 до 2,4 мМ/мг·мин. Применение смеси III было менее эффективным: активность липазы уменьшилась на 0,9 мкМ/мин·мг, липоксигеназы – 0,8 на мМ/мл·мин и каталазы – на 0,7 мМ/мг·мин. Наибольшее подавляющее влияниена активность энзимов оказали смеси II, IV: величины активности липазы уменьшились с 3,9 мкМ/мин·мг до 2,6 и 1,9 мкМ/мин·мг соответственно, липоксигеназы - с 4,2 мМ/мл·мин до 3,0 и 2,2 мМ/мл·мин соответственно, каталазы с 3,5 мМ/мг·мин до 2,4 и 1,9 мМ/мг·мин соответственно. В то время как аналогичные показатели со смесями 1-4 были менее эффективными (таблица 3.14). Таблица 3.14 Изменение активности липазы, липоксигеназы и каталазы зародышей пшеницы, обработанных композициями органических кислот
Рациональное количество и оптимальное соотношение органических кислот (фумаровой, янтарной, аскорбиновой) в стабилизационных смесях позволяет обеспечивать исходные показатели качества зародыша до 8-ми недель без негативного влияния на его органолептические и технологические показатели, что делает возможным применение его в биотехнологиях. Дальнейшие исследования в направлении разработки новых высокоэффективных технологических решений стабилизации показателей качества белково-углеводной части зародыша пшеницы – МЗП «Витазар» проводили в отношении применения натуральных антиоксидантов и композиций пряных трав.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-12-19; просмотров: 127; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.220.114 (0.074 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||





 а
а
 б
б