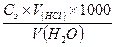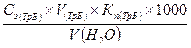Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение щелочности молока.Содержание книги
Поиск на нашем сайте Методика: 1. В колбу для титрования отмерить 15мл молока. 2. Добавить туда 15мл дистиллированной воды и 7-10 капель фенолфталеина. Титровать до слабо-розовой окраски. 3. Титрование повторить 6 раз. 4. Результаты записать в лабораторный журнал. 5. Сделать вывод в соответствии с требованиями к качеству молока.
Требования к качеству молока: 1. Свежее – 16% - 22% 2. Не свежее – 23% и более 3. Разбавленное или с примесью соды – 16% и менее. За 1% кислотности принимают 1мл 0,1N NaOH, израсходованного на нейтрализацию кислоты в 100мл молока. Кислотность определяется в % Тернера.
Оформление результатов.
Т = Vср*Кп*6,67, где Vср – объем гидроксида натрия Кп – поправочный коэффициент гидроксида натрия
Определение временной жесткости воды. Методика: 1. Мерной колбой отмерить 100мл водопроводной воды и поместить ее в колбу для титрования. 2. Добавить в колбу для титрования 2-3 капли метилового оранжевого и титровать 0,1N HCI до розово-оранжевого окрашивания. 3. Титрование повторить 6 раз. 4. Результаты записать в лабораторный журнал. 5. Сделать вывод в соответствии с классификацией жесткости.
Классификация жесткости. 1. мягкая вода – до 3ммоль/л 2. средне жесткая вода – 3-6 ммоль/л 3. жесткая вода – 6-10 ммоль/л 4. очень жесткая вода – более 10 ммоль/л Оформление результатов.
Ж =
Определение общей жесткости воды. Методика: 1. В колбу для титрования отмерить 50мл водопроводной воды. Туда же поместить 5мл аммиачно-буферного раствора и титровать Тритоном Б по кислотному хрому черному до синей окраски. 2. Титрование повторить 6 раз. 3. Результаты записать в лабораторный журнал. 4. Сделать вывод в соответствии с классификацией жесткости.
Классификация жесткости. 5. мягкая вода – до 3ммоль/л 6. средне жесткая вода – 3-6 ммоль/л 7. жесткая вода – 6-10 ммоль/л 8. очень жесткая вода – более 10 ммоль/л Оформление результатов.
Ж =
Тест для самоконтроля
1. Цель количественного анализа. 1. Установить количество составных смеси. 2. Определить элементарный состав вещества 3. Выявить одну часть смеси 4. Определить концентрацию компонентов смеси 2. Нейтральная среда 5. 5 6. 7 7. 9 8. 2 3. Кислоты 5. ОН- + кислотный остаток 6. Н+ + кислотный остаток 7. Ме + кислотный остаток 8. Вещества, только неорганической природы 4. Точные пипетки 1. Пастера 2. Градуированная с мёртвым пространством 3. Глазная 4. Мора 5. Цена деления мерной посуды 1. Наименьший объём жидкости 2. Наибольший объём жидкости 3. Объём между двумя цифровыми значениями 4. Объем по мениску 6. Концентрация показывает количество 1. Вещества в (г) в 100 (г) раствора 2. Молей в (г) в 1 литре раствора 3. Эквивалентов в (г) в 1 л раствора 4. Миллитров в 1л раствора 7. Нормальная концентрация показывает количество 1. Вещества в (г) в 100 (г) раствора 2. Молей в (г) в 1 литре раствора 3. Эквивалентов в (г) в 1 л раствора 4. Вещества в (г) в 100 (г) раствора 8. Реакция метода нейтрализации 1. АgС1 + 2 NH3 → [ Аg(NH3)2] С1 2. Н+ + ОН- → НОН 3. Н2SО4 + Zп → Zп SО4 + Н2 4. Ведет к образованию осадка 9. рН = 5,5, значит среда 10. Количество граммов вещества в 100 г раствора 1. Молярная концентрация 2. Нормальная концентрация 3. Мольная доля 4. Массовая доля 11. Численное значение суммы концентраций ионов Н+ и ОН- равно 1. 7 2. 14 3. 10 4. 12
Лабораторно-практическое занятие№23 «Проведение электрометрических методов анализа» Задание: 1 Изучите материал учебника: Камышников В.С. «Техника лабораторных работ в медицинской практике». 3-е издание переработанное и дополненное М.: «МеЕДпресс-информ», 2013. Стр. 176-178, 182-187 2 Пустовалова Л.М. /Л.М. Пустовалова, И.Е.Никанорова/ - Техника лабораторных работ. Ростов н/Д.: «Феникс», 2004 - 288с. Материал для самостоятельной работы на практическом занятии Задание: Внимательно прочитайте предложенный материал. В лабораторной тетради сделайте краткий конспект-схему про плану: 1. Работа с измерительными приборами. 2. Построение калибровочного графика. 3. Устройство и работа КФК - 2 4. В лабораторной тетради заполните таблицу. Вклейте картинки в нужную колонку.
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-11; просмотров: 224; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.007 с.) |