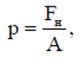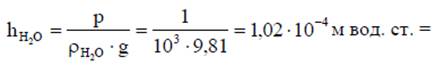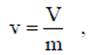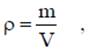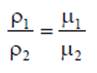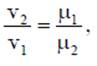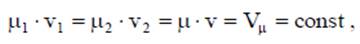Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамические параметры состояния системы.Содержание книги
Поиск на нашем сайте
Основные законы и уравнения состояния идеальных газов
К термодинамическим параметрам состояния системы относят абсолютное давление (р), удельный объем (v) и абсолютную температуру (Т). Термодинамические параметры входят в уравнение состояния вида F(p,v,T) =0 и могут быть непосредственно измерены. Абсолютное давление. Давление – величина, определяемая отношением силы (ее нормальной составляющей), действующей на поверхность, к площади этой поверхности
где p – давление, Па; Fн – сила, Н; А – площадь, м2. В расчетах используют величины, кратные одному паскалю: 1 кПа=103 Па; 1 МПа =106 Па; 1 ГПа = 109 Па; 1 бар = 105 Па = 100 кПа, где обозначения единиц измерения давления читают следующим образом: кПа – килопаскаль; МПа – мегапаскаль; ГПа – гигапаскаль. В технике для измерения давления применяют техническую атмосферу, равную силе в 1 кгс, действующей на 1 см2 площади. 1 ат = 1 кгс/см2. Для измерения малых давлений используют высоту столба жидкости (вода, ртуть, спирт и т.д.). Столб жидкости своим весом производит на основание давление: p = ρgh, откуда следует, что h = p/(ρg), где р – давление, Па; ρ - плотность жидкости, кг/м3; g = 9,80665 ≈ 9,81 м/с2 - ускорение свободного падения. Например, для воды (ρH2O = 1000 кг/м3) 1 Па равен
= 0,102 мм в. ст., где обозначения единиц измерения давления читают следующим образом: м вод. ст. - метры водяного столба; мм в. ст. - миллиметры водяного столба. При определении давления р или перепада давлений Δр надо учитывать зависимость плотности вещества от температуры и приводить высоту столба жидкости к температуре 0 °С по формуле h0=h(1- βt), где h0 - показания прибора, приведенные к 0 °С, м или мм; h - высота столба жидкости при данной температуре, м или мм; β - коэффициент объемного расширения жидкости. К-1 (для ртути β = 0,000172 К-1); t - температура жидкости, °С. В термодинамических расчетах различают атмосферное давление, избыточное (манометрическое) давление, разрежение (вакуум) и абсолютное давление. При этом за нормальное атмосферное давление принимают давление воздуха на уровне моря при температуре t=0°С, которое равно 760 мм рт. ст..
Перевод единиц измерения давления приведен в табл. 2.1.1 Таблица 2.1.1 Перевод единиц измерения давления
Термодинамическим параметром состояния служит абсолютное давление р, Па. Используемые в технике приборы, как правило, измеряют не абсолютное давление, а разность давлений давления в сосуде и давления атмосферного воздуха. При давлении в сосуде больше атмосферного, абсолютное давление рассчитывают по формуле Р = В + рм, где В - барометрическое давление; рм - манометрическое давление или избыточное давление. Аналогично, при давлении в сосуде меньше атмосферного измеряют вакуум или разрежение и в этом случае абсолютное давление равно Р = В-рв, где рв - вакуумметрическое давление или разрежение. Абсолютная температура Температура характеризует степень нагретости тела. В настоящее время в практике инженерных расчетов широкое распространение получили две температурные шкалы: 1. Термодинамическая шкала температур, которая имеет одну реперную точку - тройную точку воды (вода находится одновременно в трех фазовых состояниях) при t = 0.01 °С (Т= 273.16 К) и р = 610 Па. Температуру измеряют по шкале Кельвина. К. Начало отсчета Т = 0 К = - 273.15 °С. 2. Международная практическая шкала температур (МПШТ) имеет две реперные точки: первая точка - точка таяния льда при t1 = 0°С и р=760 мм рт. ст.; вторая точка - точка кипения воды при t2 = 100 °С и р = 760 мм рт.ст. МПШТ для измерения температуры использует градусы Цельсия, °С. Перевод температуры из термодинамической шкалы температур в практическую шкалу температур и наоборот выполняют по формулам: T = t + 273.15K: t = Т - 273.15°С. Термодинамический параметр — абсолютная температура, выражаемая в Кельвинах. К. Удельный объем Удельный объем равен объему единицы массы вещества
где v - удельный объем, м3/кг; V - объем, м3; m - масса вещества, кг. Плотность равна массе вещества, содержащегося в единице объема
где ρ - плотность вещества, кг/м3: m - масса вещества, кг; V - объем, м3. Соотношение между удельным объемом и плотностью вещества ρv = l. Удельный вес рассчитывают по формуле, Н/м3 γ = g∙ρ. В XIX веке экспериментально были установлены следующие соотношения между термодинамическими параметрами для газов, близких по своим свойствам к идеальному газу: для изобарного процесса р = const, v/T= const — закон Гей-Люссака; для изохорного процесса v = const, p/T = const - закон Шарля; для изотермического процесса Т = const, р/ρ = const или р∙v = const с учетом соотношения р∙v = 1 — закон Бойля - Мариотта. В 1834 году французский ученый Клапейрон объединил эти законы и получил характеристическое уравнение, связывающее между собой все три термических параметра p, v и Т. Данное уравнение называют термодинамическия уравнением состояния идеального газа. Для 1 кг газа уравнение состояния идеального газа имеет вид pv = RT, где р - абсолютное давление, Па; v - удельный объем, м3/кг; Т - абсолютная температура, К; R - постоянная данного газа или газовая постоянная. Дж /(кг∙К). Умножив левую и правую части данного уравнения на массу газа, получим уравнение состояния хля газа массой m: р∙m∙v = m∙R∙Т или р∙V = m∙R∙Т. где V = m∙v - ооьем газа, м3. В системе СИ количество вещества измеряют в молях и киломолях: 1 кмоль = 103 моль. Кмоль газа (вещества) равен количеству газа (вещества), масса которого в килограммах, равна молярной (относительной молекулярной) массе. Молярная масса газа μ — это масса газа (вещества) в килограммах, взятого в количестве 1 кмоль. Например, у азота (N2) 1 кмоль равен 28 кг и молярная масса равна μN2 =28 кг/кмоль. Молярные массы газов представлены в табл. 2.1.2. Масса газа m выраженная через число киломолей. равна m = n∙μ. где m - масса газа, кг; μ - молярная масса, кг/кмоль; n - число киломолей, кмоль. Кроме приведенных выше законов, газы подчиняются и закону Авогадро, который устанавливает, что все газы при одинаковых температурах и давлениях содержат в одинаковых объемах одно и то же количество молекул. Откуда следует, что плотность газа прямо пропорциональна его молярной массе:
или. учитывая соотношение р∙v = 1. получим
откуда следует соотношение
где Vμ - объем киломоля, м3/кмоль. Таблица 2.1.2 Молярные массы газов
Итак, для всех идеальных газов при одинаковых температурах Т и давлениях р объем одного киломоля одинаков. При нормальных условиях (р0 = 760 мм. рт. ст. = 101,3 кПа и Т0=273.15 К) объем 1 кмоля любого газа равен Vμ0 =22.4146 м3/кмоль. Д. И. Менделеев в 1874 г. для μ кг идеального газа (для 1 киломоля) получил универсальное уравнение состояния: р∙μ∙v =μ∙R∙Т или р∙Vμ = Rμ Т, где Vμ = μ∙v — объем 1 кмоля, м3/кмоль: Rμ =μ∙R = 8314.3 Дж/ (кмоль К) — универсальная или молярная газовая постоянная.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 139; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.108.134 (0.011 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||