
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Т. В. Дикова, И. П. Романова, П. С. РомановСтр 1 из 11Следующая ⇒
Т. В. Дикова, И. П. Романова, П. С. Романов
ТЕПЛОТЕХНИКА
Учебное пособие (лабораторный практикум) по дисциплине «Теплотехника»
для направления подготовки 190600.62 (профиль подготовки: «Автомобильный сервис»)
Очная/заочная форма обучения
Коломна 2015 УДК 621.1 (075.8) Рекомендовано к изданию
Д45 советом ГСГУ
Рецензенты: профессор Рязанцев А.И., профессор Коломенского института (филиала) Университета машиностроения, доктор технических наук, доцент Бунаков П.Ю.
Дикова Т.В., Романова И.П., Романов П.С. Д45 Теплотехника: учебное пособие (лабораторный практикум) / Государственный социально-гуманитарный институт; под ред. П. С. Романова. – Коломна: ГСГУ, 2015. – 80 с. ISBN 978-5-98492-246-3
В учебном пособии приведены основные теоретические положения теплотехники и теории тепломассообмена, необходимые для выполнения лабораторных работ. Приведено содержание лабораторных работ, справочные данные и литература для их выполнения. Учебное пособие предназначено для студентов очной и заочной форм обучения высших учебных заведений, обучающихся для направления подготовки 190600.62 «Эксплуатация транспортно-технологических машин и комплексов» профиля подготовки: «Автомобильный сервис».
УДК 621.1 (075.8) ББК 31.3
©Дикова Т.В., Романова И.П.,Романов П.С., 2015 © ГОУ ВО МО «Государственный социально- ISBN 978-5-98492-246-3 гуманитарный университет», 2015 Оглавление
Введение………..………………………………………………………...5 Раздел 1. Методические рекомендации по организации лабораторного практикума ………………………………7 §1.1. Рекомендуемые темы лабораторных работ…………………..7 §1.2. Методические указания по проведению лабораторных работ……………………………………………………………7 §1.3. Структура и порядок оформления отчета……………………8 §1.4. Порядок защиты лабораторных работ……………………….9
§1.5. Рекомендуемая литература для подготовки к лабораторным работам и их защиты………………………..10 Рекомендуемые темы лабораторных работ
Порядок защиты лабораторных работ
В большинстве случаев материал для выставления оценки за лабораторную работу накапливается преподавателем в ходе выполнения ими этих работ, по результатам наблюдения за работой обучаемых. Цель защиты лабораторной работы заключается в оценке не только практических навыков и умений студентов, но и в проверке их теоретических знаний по данному разделу дисциплины, в оценке их умения анализировать результаты исследований и делать на их основе правильные выводы. Для подготовки к защите студенты должны ознакомиться с вопросами по данной работе, самостоятельно найти на них ответы, оформить отчет о работе. Вопросы для подготовки к защите лабораторной работы приводятся в методических указаниях по проведению работы и в данном учебном пособии. Защита, как правило, осуществляется на следующей лабораторной работе. За проведенную работу, оформленный отчет и по результатам опроса преподаватель выставляет дифференцированную оценку, с указанием замечаний.
§1.5. Рекомендуемая литература для подготовки к лабораторным работам и их защиты
а) основная литература 1. Теплотехника / Под ред. М.Г. Шатрова. М.: Академия, 2012. 2. Бурдаков В.П., Дзюбенко Б.В., Меснякин С.Ю., Михайлов Т.В. Термодинамика. – М.: Дрофа, 2009. б) дополнительная 1. Теплотехника: Учеб. для вузов/В.И. Луканин, М.П. Шатров, Г.М. Камфер и др.; Под ред. В.Н. Луканина. — 2-е изд., перераб. — М.: Высш. шк., 2000. — 671 с: ил. 2. Ляшков В. И. Теоретические основы теплотехники: Учеб. пособие. 2-е изд., стер. - М.: Изд-во Машиностроение-1, 2005. - 260 с. 3. Баскаков А.П. Теплотехника. - М.: Энергоатомиздат, 1991. - 244 с. 4. Рабинович О.М. Сборник задач по технической термодинамике. – М.: Машиностроение, 1969. – 376 с.
Раздел 2. Методические указания по выполнению лабораторного практикума Цель работы
Лабораторная работа выполняется на основе теоретических положений теплотехники и термодинамики с использованием табличного процессора Microsoft EXCEL в среде Windows 9*/NT/2000/ХР или с помощью инженерного калькулятора. Цель работы: изучить термодинамическими параметрами состояния системы, основные законы и уравнения состояния идеальных газов; получение умения и навыков: в определении параметров и энергетических составляющих газов и их смесей в различных термодинамических процессах; в применении основных законов термодинамики при производстве инженерных расчетов.
Абсолютная температура Температура характеризует степень нагретости тела. В настоящее время в практике инженерных расчетов широкое распространение получили две температурные шкалы: 1. Термодинамическая шкала температур, которая имеет одну реперную точку - тройную точку воды (вода находится одновременно в трех фазовых состояниях) при t = 0.01 °С (Т= 273.16 К) и р = 610 Па. Температуру измеряют по шкале Кельвина. К. Начало отсчета Т = 0 К = - 273.15 °С. 2. Международная практическая шкала температур (МПШТ) имеет две реперные точки: первая точка - точка таяния льда при t1 = 0°С и р=760 мм рт. ст.; вторая точка - точка кипения воды при t2 = 100 °С и р = 760 мм рт.ст. МПШТ для измерения температуры использует градусы Цельсия, °С. Перевод температуры из термодинамической шкалы температур в практическую шкалу температур и наоборот выполняют по формулам: T = t + 273.15K: t = Т - 273.15°С. Термодинамический параметр — абсолютная температура, выражаемая в Кельвинах. К. Удельный объем Удельный объем равен объему единицы массы вещества
где v - удельный объем, м3/кг; V - объем, м3; m - масса вещества, кг. Плотность равна массе вещества, содержащегося в единице объема
где ρ - плотность вещества, кг/м3: m - масса вещества, кг; V - объем, м3. Соотношение между удельным объемом и плотностью вещества ρv = l. Удельный вес рассчитывают по формуле, Н/м3 γ = g∙ρ. В XIX веке экспериментально были установлены следующие соотношения между термодинамическими параметрами для газов, близких по своим свойствам к идеальному газу: для изобарного процесса р = const, v/T= const — закон Гей-Люссака; для изохорного процесса v = const, p/T = const - закон Шарля; для изотермического процесса Т = const, р/ρ = const или р∙v = const с учетом соотношения р∙v = 1 — закон Бойля - Мариотта. В 1834 году французский ученый Клапейрон объединил эти законы и получил характеристическое уравнение, связывающее между собой все три термических параметра p, v и Т. Данное уравнение называют термодинамическия уравнением состояния идеального газа. Для 1 кг газа уравнение состояния идеального газа имеет вид pv = RT, где р - абсолютное давление, Па; v - удельный объем, м3/кг; Т - абсолютная температура, К; R - постоянная данного газа или газовая постоянная. Дж /(кг∙К). Умножив левую и правую части данного уравнения на массу газа, получим уравнение состояния хля газа массой m: р∙m∙v = m∙R∙Т или р∙V = m∙R∙Т. где V = m∙v - ооьем газа, м3. В системе СИ количество вещества измеряют в молях и киломолях: 1 кмоль = 103 моль.
Кмоль газа (вещества) равен количеству газа (вещества), масса которого в килограммах, равна молярной (относительной молекулярной) массе. Молярная масса газа μ — это масса газа (вещества) в килограммах, взятого в количестве 1 кмоль. Например, у азота (N2) 1 кмоль равен 28 кг и молярная масса равна μN2 =28 кг/кмоль. Молярные массы газов представлены в табл. 2.1.2. Масса газа m выраженная через число киломолей. равна m = n∙μ. где m - масса газа, кг; μ - молярная масса, кг/кмоль; n - число киломолей, кмоль. Кроме приведенных выше законов, газы подчиняются и закону Авогадро, который устанавливает, что все газы при одинаковых температурах и давлениях содержат в одинаковых объемах одно и то же количество молекул. Откуда следует, что плотность газа прямо пропорциональна его молярной массе:
или. учитывая соотношение р∙v = 1. получим
откуда следует соотношение
где Vμ - объем киломоля, м3/кмоль. Таблица 2.1.2 Молярные массы газов
Итак, для всех идеальных газов при одинаковых температурах Т и давлениях р объем одного киломоля одинаков. При нормальных условиях (р0 = 760 мм. рт. ст. = 101,3 кПа и Т0=273.15 К) объем 1 кмоля любого газа равен Vμ0 =22.4146 м3/кмоль. Д. И. Менделеев в 1874 г. для μ кг идеального газа (для 1 киломоля) получил универсальное уравнение состояния: р∙μ∙v =μ∙R∙Т или р∙Vμ = Rμ Т, где Vμ = μ∙v — объем 1 кмоля, м3/кмоль: Rμ =μ∙R = 8314.3 Дж/ (кмоль К) — универсальная или молярная газовая постоянная.
Внутренняя энергия.
Внутренняя энергия системы включает в себя: кинетическую энергию поступательного, вращательного и колебательного движения частиц; потенциальную энергию взаимодействия частиц; энергию электронных оболочек атомов; внутриядерную энергию. В большинстве теплоэнергетических процессов две последние составляющие остаются неизменными. Под внутренней энергией понимают энергию хаотического движения молекул и атомов, включающую энергию поступательного, вращательного и колебательного движений как молекулярного, так и внутримолекулярного, а также потенциальную энергию сил взаимодействия между молекулами. Кинетическая энергия молекул является функцией температуры, значение потенциальной энергии зависит от среднего расстояния между молекулами и, следовательно, от занимаемого газом объема V, т.е. является функцией V. Поэтому внутренняя энергия U есть функция состояния тела.
Для сложной системы она определяется суммой энергий отдельных частей, т.е. обладает свойством аддитивности. Величина u=U/М, называемая удельной внутренней энергией (Дж/кг), представляет собой внутреннюю энергию единицы массы вещества. В дальнейшем для краткости будем называть величину u просто внутренней энергией. Поскольку внутренняя энергия есть функция состояния тела, то она может быть представлена в виде функции двух любых независимых параметров, определяющих это состояние:
Ее изменение в термодинамическом процессе
Внутренняя энергия идеального газа, в котором отсутствуют силы взаимодействия между молекулами, не зависит от объема газа или давления
Для задач технической термодинамики важно не абсолютное значение внутренней энергии, а ее изменение в различных термодинамических процессах. Поэтому начало отсчета внутренней энергии может быть выбрано произвольно. Например, в соответствии с международным соглашением для воды за нуль принимается значение внутренней энергии при температуре 0,01 °С и давление 610,8 Па, а для идеальных газов — при 0 °С вне зависимости от давления.
Работа расширения.
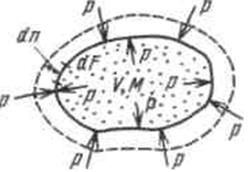
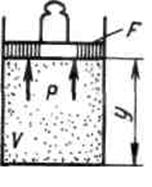
Работа в термодинамике, так же как и в механике, определяется произведением действующей на рабочее тело силы на путь ее действия. Рассмотрим газ массой М и объемом V, заключенный в эластичную оболочку с поверхностью F (рис.2.1.1).
Рис.2.1.1.
Если газу сообщить некоторое количество теплоты, то он будет расширяться, совершая при этом работу против внешнего давления р, оказываемого на него средой. Газ действует на каждый элемент оболочки dF с силой, равной pdF и, перемещая ее по нормали к поверхности на расстояние dn, совершает элементарную работу pdFdn. Общую работу, совершенную в течение бесконечно малого процесса, получим, интегрируя данное выражение по всей поверхности F оболочки: Из рис.2.1 видно, что изменение объема dV выражается в виде интеграла по поверхности: При конечном изменении объема работа против сил внешнего давления, называемая работой расширения, равна
Из (2.1.1) следует, что
если dV>0, то и если же dV<0, то и Отнеся работу расширения к 1 кг массы рабочего тела, получим l = L/M; Величина, представляющая собой удельную работу, совершаемую системой, содержащей 1 кг газа, равна Поскольку в общем случае р - величина переменная, то интегрирование возможно лишь тогда, когда известен закон изменения давления р= р(v). Формулы (2.1.1), (2.1.2) справедливы только для равновесных процессов, при которых давление рабочего тела равно давлению окружающей среды. В термодинамике для исследования равновесных процессов широко используют р,v – диаграмму, в которой осью абсцисс служит удельный объем, а осью ординат — давление. Поскольку состояние термодинамической системы определяется двумя параметрами, то на р,v – диаграмме оно изображается точкой. На рис.2.1.2 точка 1 соответствует начальному состоянию системы, точка 2 - конечному, а линия 12 - процессу расширения рабочего тела от v1 до v2. При бесконечно малом изменении объема площадь заштрихованной вертикальной полоски равна Таким образом, работа изменения объема эквивалентна площади под кривой процесса в диаграмме р, v (рис.2.1.2). Каждому пути перехода системы из состояния 1 в состояние 2 (например, 1-2, 1а2 или 1b2) соответствует своя работа расширения. Следовательно, работа зависит от характера термодинамического процесса, а не является функцией только исходного и конечного состояний системы. С другой стороны,
Рис.2.1.2. Графическое изображение работы в р, v – координатах
Работа всегда связана с перемещением макроскопических тел в пространстве, например перемещением поршня, деформацией оболочки, поэтому она характеризует упорядоченную (макрофизическую) форму передачи энергии от одного тела к другому и является мерой переданной энергии. Поскольку величина
Теплота.
Помимо макрофизической формы передачи энергии — работы существует также и микрофизическая, т.е. осуществляемая на молекулярном уровне форма обмена энергией между системой и окружающей средой. В этом случае энергия может быть передана системе без совершения работы. Мерой количества энергии, переданной микрофизическим путем, служит теплота. Теплота может передаваться либо при непосредственном контакте между телами (теплопроводностью, конвекцией), либо на расстоянии (излучением), причем во всех случаях этот процесс возможен только при наличии разности температур между телами. Как будет показано ниже, элементарное количество теплоты Внутренняя энергия — это свойство самой системы, она характеризует состояние системы. Теплота и работа — это энергетические характеристики процессов механического и теплового взаимодействий системы с окружающей средой. Они характеризуют те количества энергии, которые переданы системе или отданы ею через ее границы в определенном процессе.
Энтальпия.
В термодинамике важную роль играет сумма внутренней энергии системы U и произведения давления системы р на ее объем V, называемая энтальпией и обозначаемая Н:
Так как входящие в нее величины являются функциями состояния, то и сама энтальпия является функцией состояния. Так же как внутренняя энергия, работа и теплота, она измеряется в джоулях (Дж). Энтальпия обладает свойством аддитивности. Величина
называемая удельной энтальпией (h = H/M), представляет собой энтальпию системы, содержащей 1 кг вещества, и измеряется в Дж/кг. Поскольку энтальпия есть функция состояния, то она может быть представлена в виде функции двух любых параметров состояния:
а величина dh является полным дифференциалом. Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями тела и не зависит от характера процесса. Физический смысл энтальпии выясним на следующем примере. Рассмотрим расширенную систему, включающую газ в цилиндре и поршень с грузом общим весом G (рис.2.1.3).
Рис.2.1.3. Система, включающую газ в цилиндре и поршень с грузом общим весом G
Энергия этой системы складывается из внутренней энергии газа и потенциальной энергии поршня с грузом в поле внешних сил: Уравнение Из этого соотношения следует, что если давление системы сохраняется неизменным, т.е. осуществляется изобарный процесс (dp=0), то т.е. теплота, подведенная к системе при постоянном давлении, идет только на изменение энтальпии данной системы. Это выражение очень часто используется в расчетах, так как огромное количество процессов подвода теплоты в теплоэнергетике (в паровых котлах, камерах сгорания газовых турбин и реактивных двигателей, теплообменных аппаратах), а также целый ряд процессов химической технологии и многих других осуществляется при постоянном давлении. Кстати, по этой причине в таблицах термодинамических свойств обычно приводятся значения энтальпии, а не внутренней энергии. Для идеального газа с учетом получим
Так как между энтальпией и внутренней энергией существует связь Например, для воды при t=0,01ºC и р =610,8 Па, u = 0, a h = pv = 0,611 Дж/кг. При расчетах практический интерес представляет изменение энтальпии в конечном процессе:
Энтропия.
Как уже указывалось, величина В математике доказывается, что дифференциальный двучлен всегда можно превратить в полный дифференциал путем умножения (или деления) на интегрирующий множитель (или делитель). Таким интегрирующим делителем для элементарного количества теплоты q является абсолютная температура Т. Покажем это на примере изменения параметров идеального газа в равновесных процессах: где R - газовая постоянная; Выражение Таким образом, аналитически энтропия определяется следующим образом: Формула (2.1.4) справедлива как для идеальных газов, так и для реальных тел. Подобно любой другой функции состояния энтропия может быть представлена в виде функции любых двух параметров состояния:
Значение энтропии для заданного состояния определяется интегрированием уравнения (2.1.4):
где При температурах, близких к абсолютному нулю, все известные вещества находятся в конденсированном состоянии. В. Нернст (1906 г.) экспериментально установил, а М. Планк (1912 г.) окончательно сформулировал следующий принцип: при температуре, стремящейся к абсолютному нулю, энтропия вещества, находящегося в конденсированном состоянии с упорядоченной кристаллической структурой, стремится к нулю, т.е. s0 = 0 при Т = 0 К. Этот закон называют третьим законом термодинамики или тепловой теоремой Нернста. Он позволяет рассчитать абсолютное значение энтропии в отличие от внутренней энергии и энтальпии, которые всегда отсчитываются от произвольного уровня. Однако в технической термодинамике обычно используется не абсолютное значение энтропии, а ее изменение в каком-либо процессе:
поэтому энтропию тоже часто отсчитывают от произвольно выбранного уровня. Получим формулы, позволяющие вычислить изменение энтропии идеального газа. Для этого проинтегрируем уравнение (2.1.3), положив для простоты cv= const: Из уравнения Клапейрона, записанного для состояний 1 и 2, следует:
После подстановки отношений и в выражение (2.4) получим следующие формулы для изменения энтропии идеального газа:
где cP - теплоемкость газа при постоянном давлении. Поскольку энтропия есть функция состояния рабочего тела, уравнениями (2.1.5) - (2.1.6) можно пользоваться вне зависимости от пути перехода рабочего тела между состояниями 1 и 2 и, в частности, от того, равновесный этот переход или нет (см. рис.2.1.4).
Рис. 2.1.4. Графическое изображение теплоты в T, s – координатах
Понятие энтропии позволяет ввести чрезвычайно удобную для термодинамических расчетов Т, s-диаграмму, на которой (как и на p,v - диаграмме) состояние термодинамической системы изображается точкой, а равновесный термодинамический процесс линией (рис.2.1.4). В равновесном процессе
Очевидно, что в Т, s-диаграмме элементарная теплота процесса Формула
Порядок проведения расчетов
Рассмотрим расчет основных термодинамических параметров состояния рабочего тела на основе примеров. Пример 1. Смесь, состоящая из М1 киломолей углекислого газа и М2 киломолей окиси углерода с начальными параметрами р1 = 5 МПа и Т1 = 2000 К, расширяется до конечного объема V2 = εV1. Расширение может осуществляться по изотерме, по адиабате, по политропе с показателем n. Определить газовую постоянную смеси, ее массу и начальный объем, конечные параметры смеси, работу расширения, теплоту процесса, изменение внутренней энергии, энтальпии и энтропии. Дать сводную таблицу результатов и ее анализ. Показать процессы на p-v и T-s диаграммах. Указания. Показатель адиабаты, а, следовательно, изохорную и изобарную теплоемкости принять независящими от температуры. Для расчета необходимо знать молекулярную массу и газовую постоянную смеси газов. Молекулярная масса смеси газов вычисляется как отношение массы смеси (сумма масс компонентов) к числу молей смеси (сумме числа молей компонентов). Необходимые величины для этого расчета имеются в исходных данных к задаче. Газовая постоянная смеси газов вычисляется как отношение универсальной газовой постоянной к молекулярной массе газовой смеси. При определении теплоемкостей воспользоваться формулой для теплоемкости газовой смеси. Показатель адиабаты определить как отношение изобарной и изохорной теплоемкостей газовой смеси. Расчет начального объема, конечных параметров смеси, работы расширения, теплоты процесса, изменения внутренней энергии, энтальпии и энтропии осуществляется с использованием уравнения состояния идеального газа, уравнения первого закона термодинамики, уравнений соответствующих термодинамических процессов (изотермического, адиабатного, политропного). Основные расчетные формулы имеются в данном пособии, а также в рекомендованной для самостоятельного изучения литературе.
Решение. Исходные данные Количества молей компонентов смеси (кмоль): М1=0.1; М2=0.9 Температура газовой смеси (К): T1 =2000 Давление газовой смеси (Па): р1=5∙106 Степень сжатия: ε=20 Показатель политропы: n= 1.12 Молекулярные массы компонентов (кг/кмоль): μ1 = 44 μ2 = 28
Расчёт 1. Расчёт молекулярной массы смеси в кг/кмоль проводим по формуле: 2. Расчёт массы смеси (кг): mсм = М1∙μ1 + М2∙μ2, mсм =29,6. 3. Расчёт газовой постоянной смеси, Дж/(кг К). R=8134/μсм, R=274,797. 4. Определение первоначального объёма смеси (м3): V1 = mсм∙R∙(T1/p1),, V1 =3.254. 5. Расчёт изотермического процесса 5.1. Работа процесса (Дж): Lt= mсм∙(R∙T1∙ln(ε)), Lt=4.873∙107. 5.2. Теплота процесса равна работе процесса (Дж): qt=Lt =4.873∙107. 5.3. Изменение внутренней энергии (Дж): Δut =0. 5.4. Изменение энтальпии (Дж): Δit =0. 5.5. Изменение энтропии (Дж/К): Δst= qt/ T1, Δst =2.437∙104. 6. Расчёт адиабатного процесса. 6.1. Определение показателя адиабаты. 6.1.1. Изобарные и изохорные теплоёмкости компонентов, кДж/(кмоль К) - справочные ср1=37.4 ср2=29.1 cvl =29.1 cv2 = 20.8 6.1.2. Показатель адиабаты 6.2. Работа адиабатного процесса, Дж:
6.3. Теплота адиабатного процесса равно нулю, Дж: qs=0 6.4. Изменение внутренней энергии адиабатного процесса равно работе процесса с обратным знаком, Дж. Δus = -Ls, Δus = -2.896∙107. 6.5. Изменение энтальпии адиабатного процесса, Дж:
6.6. Изменение энтропии в адиабатном процессе равно нулю: Δs=0. 7. Политропный процесс 7.1. Работа политропного процесса (Дж):
7.2. Теплота политропного процесса (Дж) 7.3. Изменение внутренней энергии политропного процесса (Дж): 7.4. Изменение энтальпии политропного процесса: 7.4.1. Изобарная теплоёмкость ср (Дж/(кг К)) и конечная температура Т2 (К) политропного процесса: 7.4.2. Изменение энтальпии (Дж): Δip=mсм∙cp∙(T2-T1), Δip=-1.771∙107. 7.5. Изменение энтропии политропного процесса: 7.5.1. Теплоёмкость политропного процесса сn (Дж/(кг К)):
7.5.2. Изменение энтропии (Дж/К):
Результаты расчётов
Пример 2. Расход газа в поршневом одноступенчатом компрессоре составляет V1 при давлении р1 = 0,1 МПа и температуре t1. При сжатии температура газа повышается на 200 оС. Сжатие происходит по политропе с показателем n. Определить конечное давление, работу сжатия и работу привода компрессора, количество отведенной теплоты, а также теоретическую мощность привода компрессора. Указания. Показатель адиабаты принять постоянной величиной.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 85; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.108.236 (0.183 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 ББК 31.3 редакционно-издательским
ББК 31.3 редакционно-издательским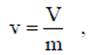
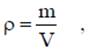
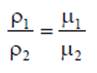
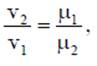
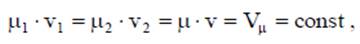
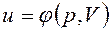 ;
; 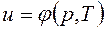 ;
; 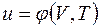 .
.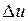 не зависит от характера процесса и определяется только начальным и конечным состояниями тела:
не зависит от характера процесса и определяется только начальным и конечным состояниями тела: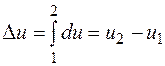 ;
;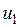 - значение внутренней энергии в начальном состоянии, а
- значение внутренней энергии в начальном состоянии, а 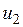 - в конечном. Математически это означает, что бесконечно малое изменение внутренней энергии du есть полный дифференциал и; если выразить внутреннюю энергию в виде функции удельного объема и температуры, то
- в конечном. Математически это означает, что бесконечно малое изменение внутренней энергии du есть полный дифференциал и; если выразить внутреннюю энергию в виде функции удельного объема и температуры, то
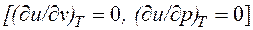 , а определяется только его температурой, поэтому производная от внутренней энергии идеального газа по температуре есть полная производная:
, а определяется только его температурой, поэтому производная от внутренней энергии идеального газа по температуре есть полная производная: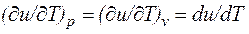
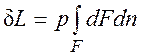 .
.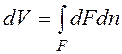 , следовательно
, следовательно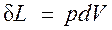 . (2.1.1)
. (2.1.1)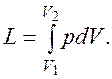
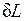 и dV всегда имеют одинаковые знаки:
и dV всегда имеют одинаковые знаки: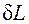 >0, т.е. при расширении работа тела положительна, при этом тело само совершает работу;
>0, т.е. при расширении работа тела положительна, при этом тело само совершает работу;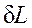 <0, т. е. при сжатии работа тела отрицательна: это означает, что не тело совершает работу, а на его сжатие затрачивается работа извне. Единицей измерения работы в СИ является джоуль (Дж).
<0, т. е. при сжатии работа тела отрицательна: это означает, что не тело совершает работу, а на его сжатие затрачивается работа извне. Единицей измерения работы в СИ является джоуль (Дж).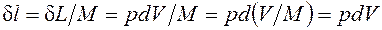 .
. 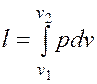 . (2.1.2)
. (2.1.2)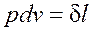 ; следовательно, работа процесса 1-2 изображается площадью, ограниченной кривой процесса, осью абсцисс и крайними ординатами.
; следовательно, работа процесса 1-2 изображается площадью, ограниченной кривой процесса, осью абсцисс и крайними ординатами.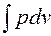 зависит от пути интегрирования и, следовательно, элементарная работа
зависит от пути интегрирования и, следовательно, элементарная работа 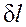 не является полным дифференциалом.
не является полным дифференциалом.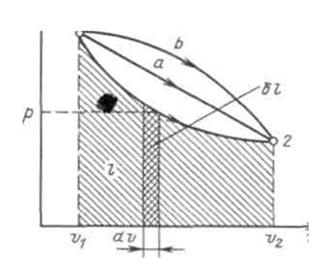
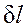 пропорциональна увеличению объема, то в качестве рабочих тел, предназначенных для преобразования тепловой энергии в механическую, целесообразно выбирать такие, которые обладают способностью значительно увеличивать свой объем. Этим качеством обладают газы и пары жидкостей. Поэтому, например, на тепловых электрических станциях рабочим телом служат пары воды, а в двигателях внутреннего сгорания — газообразные продукты сгорания того или иного топлива.
пропорциональна увеличению объема, то в качестве рабочих тел, предназначенных для преобразования тепловой энергии в механическую, целесообразно выбирать такие, которые обладают способностью значительно увеличивать свой объем. Этим качеством обладают газы и пары жидкостей. Поэтому, например, на тепловых электрических станциях рабочим телом служат пары воды, а в двигателях внутреннего сгорания — газообразные продукты сгорания того или иного топлива.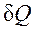 , так же как и L, не является полным дифференциалом в отличие от дифференциала внутренней энергии dU. За этой математической символикой скрыт глубокий физический смысл различия понятий внутренней энергии, теплоты и работы.
, так же как и L, не является полным дифференциалом в отличие от дифференциала внутренней энергии dU. За этой математической символикой скрыт глубокий физический смысл различия понятий внутренней энергии, теплоты и работы.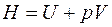 .
.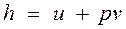 ,
,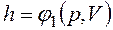 ;
; 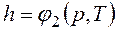 ;
;  ,
,
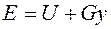 . В условиях равновесия (G = pF) эту функцию можно выразить через параметры газа:
. В условиях равновесия (G = pF) эту функцию можно выразить через параметры газа: 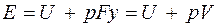 . Получаем, что
. Получаем, что 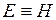 , т.е. энтальпию можно трактовать как энергию расширенной системы.
, т.е. энтальпию можно трактовать как энергию расширенной системы.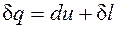 в случае, когда единственным видом работы является работа расширения, с учетом очевидного соотношения
в случае, когда единственным видом работы является работа расширения, с учетом очевидного соотношения 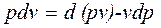 может быть записано в виде
может быть записано в виде 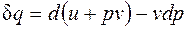 , или
, или  .
.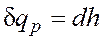 и
и 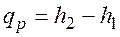 ,
,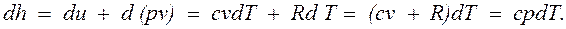
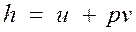 , выбор начала отсчета одной из них не произволен: в точке, принятой за начало отсчета внутренней энергии, h = pv.
, выбор начала отсчета одной из них не произволен: в точке, принятой за начало отсчета внутренней энергии, h = pv.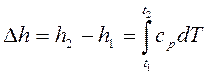 .
.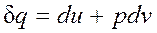 не является полным дифференциалом. Действительно, для того чтобы проинтегрировать правую часть этого выражения, нужно знать зависимость р от v, т.е. процесс, который совершает газ.
не является полным дифференциалом. Действительно, для того чтобы проинтегрировать правую часть этого выражения, нужно знать зависимость р от v, т.е. процесс, который совершает газ.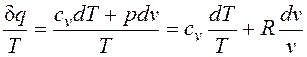 , (2.1.3)
, (2.1.3)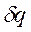 - элементарная теплота процесса; cv - теплоемкость газа при постоянном объеме.
- элементарная теплота процесса; cv - теплоемкость газа при постоянном объеме.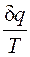 при равновесном изменении состояния газа есть полный дифференциал некоторой функции состояния. Она называется энтропией, обозначается для 1 кг газа через s и измеряется в Дж/(кг∙К). Для произвольного количества газа энтропия, обозначаемая через S, равна S=Ms и измеряется в Дж/К.
при равновесном изменении состояния газа есть полный дифференциал некоторой функции состояния. Она называется энтропией, обозначается для 1 кг газа через s и измеряется в Дж/(кг∙К). Для произвольного количества газа энтропия, обозначаемая через S, равна S=Ms и измеряется в Дж/К.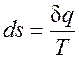 . (2.1.4)
. (2.1.4)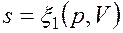 ;
;  ;
; 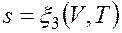 .
.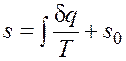
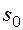 — константа интегрирования.
— константа интегрирования.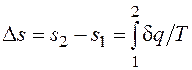 ,
,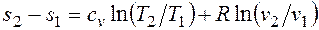 . (2.1.5)
. (2.1.5) .
.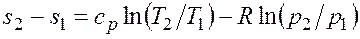 ;
; 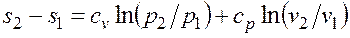 , (2.1.6)
, (2.1.6)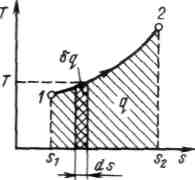
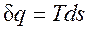 ;
;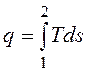 .
.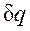 изображается элементарной площадкой с высотой Т и основанием ds, а площадь, ограниченная линией процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса.
изображается элементарной площадкой с высотой Т и основанием ds, а площадь, ограниченная линией процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса.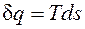 показывает, что ds и
показывает, что ds и 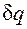 имеют одинаковые знаки, следовательно, по характеру изменения энтропии в равновесном процессе можно судить о том, в каком направлении происходит теплообмен. При подводе теплоты к телу (
имеют одинаковые знаки, следовательно, по характеру изменения энтропии в равновесном процессе можно судить о том, в каком направлении происходит теплообмен. При подводе теплоты к телу (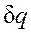 >0) его энтропия возрастает (ds>0), а при отводе теплоты (
>0) его энтропия возрастает (ds>0), а при отводе теплоты (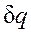 <0) — убывает (ds<0).
<0) — убывает (ds<0).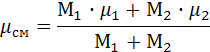 , μсм = 29,6.
, μсм = 29,6.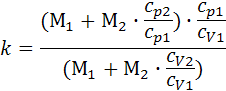 , k = 1.384.
, k = 1.384.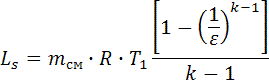 , Ls=2.896∙107.
, Ls=2.896∙107.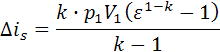 , Δis=-4.008∙107.
, Δis=-4.008∙107.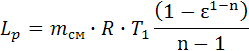 , Lp = 4.094∙107.
, Lp = 4.094∙107.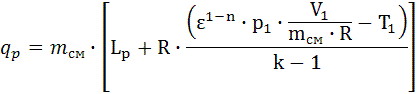 , qp=1.199∙109.
, qp=1.199∙109.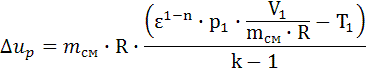 , Δup =-1,28∙107.
, Δup =-1,28∙107.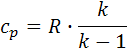 ,
, 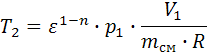
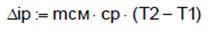 ,
,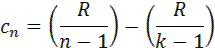 .
.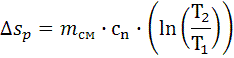 , Δsр=-1.675∙104
, Δsр=-1.675∙104


