Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Критерии оценки оросительной воды по ирригационному коэффициентуСодержание книги
Поиск на нашем сайте ний — при минерализации до 9 г/л при хорошей дренирован-ности почв. ЕЯ jj. В. Скрепчинскаи и др. (-1977) считают, что для большинства растений пригодна вода с минерализацией 2—5 г/л, а для солеустойчивых культур на легких почвах—до 1-U— 12 г/л. Устойчиво токсичной считается вода при концентрации солей 15—20 г/л. В. А. Ковда (1973), обобщив отечественный и зарубежный опыт, рекомендует следующие нормы использования минерализованных вод па фоне промывного режима ц профилактических промывок (табл. 0.2.3). Т а б л ii ц а 6.2.3 Условия применения минерализованных вод для орошения (По В. А. Ковда)
Способность йоды осолонповывать почвы зависит главным образом от содержания в пей натрия. Дело в том, что кальций обладает хорошими каогулнрующими свойствами (при преобладающем положении в поглощенном комплексе почв), способствует улучшению структуры почвы и делает ее водопрочной. Натрий, наоборот, разрушает структуру и ухудшает водно-физические свойства. Поэтому если ионы натрия значительно преобладают в оросительной воде над двухвалентными Са2+ и Mg24, то возможно взаимодействие N'a* с поглощенным комплексом почвы, что приводит к увеличению слитности, плотности, коркообразованию и бесструктурности почв, т. е. к потере почвой ее главных свойств, способствующих высокой продуктивности. Способность оросительной воды к осолонцеванию почв может быть оценена по критерию осолонцевания, предложенному И. Н. Лнтиповым-Каратаевым и Г. М. Кадером (1961).. гСа2++гМе2+ ~ rNa+ -<0.238C.. где С — сухой остаток, г/л. Если это соотношение выполняется, осолонцевацие будет происходить. 54 Лаборатория засоленных почв США предлагает эту способность оросительной воды оценивать по коэффициенту потенциального поглощения натрия (натриевое адсорбционное отношение) SAR: ЧЛ1>= _______^__/ VO,5{rCa2++rMg20' Считается, что при $-4Я<1() опасность осолонцевання ночи малая, при 10—18'—средняя, при 18—26 — высокая и при 26 — очень высокая. Почти все остальные методы основаны па отношении одновалентных катионов (натрия) к двухвалентным (кальцию и магнию), при этом критерии оценок иесколько-разнятся. что, видимо, объясняется природными условиями, где эти методы испытывались. Например, А. М. Можейко и Г. К. Воротник (1958) для Украины получили предельное значение этого гМ^+гСа2-" коэффициента равным 0,5, т. е. если —--------—-—- >U,o,. rNa+ осолонцёваниё происходить не будет. М. Ф. Буданов (1965) считает, что вода не приведет к осолонцеванию, если лЫа+ —------------------ <0,7 и т. д. rCa2+-f-rMn-2i- Интересны предложения венгерских ученых (1973) оценивать воду по магниевой опасности. Дело в том, что магнии, занимая промежуточное положение между кальцием и na'i-рнем, подавлен ими. Однако, когда содержание натрия в воде незначительно, а магний преобладает над кальцием, он способен вытеснять из поглощенного основания почвы структурообразующий кальций, занять преобладающее положение-и -ухудшить свойства почвы аналогично натрию. Магниевая rMg2+ ., - опасность оценивается соотношением Кмы—~ — <">э rCa2- + rMg2 + (магниевый коэффициент). Иной подход к оценке пригодности воды для орошения с учетом ее токсичности и способности к осолопцсваппю пред-. лагают Ю. Г. Богомолов и др. (1980). В основу опенки они кладут содержание нормальной и двууглекислой соды, определяемое как: а) (гНСОа-+гСО2- } — (rCa2++rMg2'-). Если полученное значение окажется <1,25 мг-экв/л, вода считается" пригодной для орошения; при содержании общей 55 соды в пределах 1,25—2,5 мг-экв/л — ограниченно пригодной, есл-и >2,5 мг-экв/л, то применять воду для орошения нельзя. б) rCO^-—(rCa2--+rMg2+). Этот показатель содержания нормальной соды имеет более строгие ограничения. Так, при значении <0,3 мг-экв/л вода пригодна для орошения; 0,3—0,6 мг-экв/л — условно пригодна; >0,6 мг-экв/л-—не пригодна. Следует отметить, что при отсутствии в воде ионов СО3~ содержание двууглекислой соды следует рассчитывать по кальцию, не участвующему в образовании гипса (см. состав гипотетических солей, гл. 4.2). Эти же авторы считают предел токсичности хлора (С1~) в оросительной воде равным 1,5 г/л, имея в виду ион хлора, соответствующий натриевой соли. Степень влияния оросительной воды на почву зависит, главным образом, от соотношения содержащихся в ней и в воде натрия,магния и кальция. Пр.и преобладании кальция п поглощенном комплексе почвы она долго «сопротивляется» осолонцеванию (буферные свойства почвы). Попытка учесть эти свойства почв сделана лабораторией засоленных почв США, предложившей способность оросительной воды к осолонцеванию оценивать с помощью «выверенного^ адсорбционного соотношения натрия, учитывающего резервы кальция в почве, SAR *. Оно определяется как 5/iА1*-------"Na-^ ___^r1 + (84 H)] V(0,5(rCa2+ + rMg2+) здесь рНс—величина, представляющая собой активную концентрацию ионов, участвующих в обмене, и учитывающая резервы кальция в почве. Она подсчитывается по формуле: pH^pK2+pKo)+p(Ca2---+Mg2')+pAIK. Абсолютные значения величин, входящих в формулу, берут из табл. 6.2.4, где (рК2+рКо) определяется по суммарному содержанию катионов rNa+-f Mg24 -fCa2*, p (Ca2+-f Mg2+) — в зависимости от суммарного содержания двухвалентных катионов, rMg2++rCa2-r и рА1к — в зависимости от суммы (rCo32~-f-rHCO3-). При уточненном адсорбционном отношении натрия (SAR *)<.6 осолонцевания почв не ожидается, 56 при- 5Л#*=*6—9 возможно накопление солей в почве, а при 5ЛЯ*>9 — возможность осолонцевания вероятна. Т а б л И ц а 6.2.4 Данные для расчета рНе при определении SAX * Н-а основе отечественного и зарубежного опыта орошения разных культур минерализованными водами и методов оценки 57
качества орошаемой воды ВНИИГиМ (С; Я. Сойфер,!982) рекомендует обобщенную классификацию оросительных • под
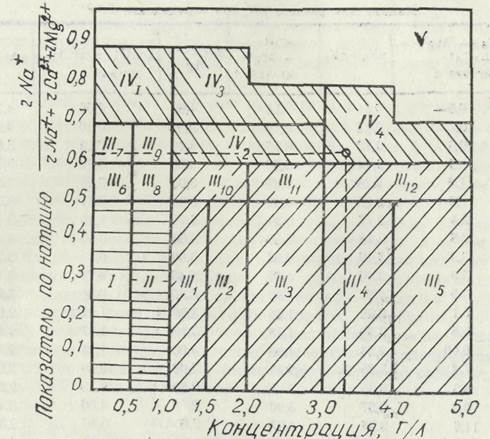
Рис. 6.2.1. Классификация оросительных вол яо-степенй опасности осолонцсвании почв по степени осолонцевания почв (рис. 6.2.1). Основой этой классификации является натриевый показатель Кка — rNa + =------------------------— и общая минерализация (г/л). Б клас- rNa++rMg2++rCa2* сификации выделено пять классов воды (римские цифры) и группы (арабские цифры) по относительному содержании» натрия (табл. 6.2.5). Качество оросительной воды не ограничивается рассмотренными показателями. В ней могут содержаться токсичные для растений микрокомпоненты, например, бор (В), необходимый для их роста и развития. При определенных концен* 58 трациях он может быть ядовитым. Токсичность химических компонентой зависит и значительной степени от солеустоичп- :'.-.. Таблица 6.2.5 Характеристика классов и групп оросительных код (По С Я. СойсЬеп)
воети растений, глубины залегания грунтовых.вод и природных условий. В прцл. 1 (табл. 1, 2, 3, 4) приведены нормы пригодности оросительной воды по всем показателям (ВНИИГиМ, 1983). Для облегчения выбора источника орошения и с точки зрения охраны -водных ресурсов (в том числе экономного расходования воды) большое значение имеет улучшение качества оросительной воды, производимое путем простого разбавления соленой воды пресной, добавления мелиорантов (например, для увеличения доли кальция добавляют по 75—350 г гипса па 1 м-3 воды, для уменьшения доли карбонатов и бикарбонатов (СО32~ и НС03") —серную кислоту и другие окислители,-например, азотную кислоту по 0,2 мл/л). Добавление кальциевой селитры Ca(NO3)2-4H2O снижает рП воды if отношение rNa+- /rMg2++rCa2+. Мелиоранты традиционно вносятся в почву. Однако больший эффект дает улучшение качества воды. В заключение подчеркнем, что описаны не все методы оценки воды для.-орошения,.а -у приведенных нет четко очерченных критериев применения. Их нужно, считать приближен-то- ными. В каждом конкретном случае необходим постоянный контроль и уточнение норм. Поэтому для оценки качества оросительной воды не исключается использование «устаревших норм» (например, по ирригационному мввффшшенту Стэблера). 6.3. Агрессивное действие воды на бетон Агрессивность воды по отношению к бетону обусловлена действием некоторых химических ее компонентов. Это приводит к перерасходу значительных средств на защиту и ремонт бетонных и железобетонных.конструкций, особенно гидротехнических и водохозяйственных. По химическому воздействию агрессивность воды подразделяют на пять видов — углекислую, выщелачивающую, об-щекислотную, магнезиальную и сульфатную, которые и обусловливают три вида коррозии бетона: I — выщелачивание растворимых компонентов бетона (\г-лекислотная и выщелачивающая); II — образование растворимых соединений, не обладающих вяжущими свойствами, в результате обменные реакций между компонентами цементного камня и воды (выщелачивающая, общекислотная, магнезиальная); III — образование и накопление в бетоне малорастворимых солей, сопровождающиеся их увеличением в объеме (сульфатная). Любая агрессия может проявляться слабо и очень сильно — это зависит от времени контакта воды с бетонной.конструкцией, от плотности бетона, толщины бетонной конструкции и от типа цемента, что необходимо учитывать при оценке агрессивности воды. Угле кислотная агрессивность воды проявляется в разрушении бетона за счет растворения кальцита СаС03, входящего в состав цементного камня, под действием агрессивной углекислоты, содержащейся в воде (см. гл. 2). Обычно ее определяют специальным анализом. Когда такой анализ не произведен, делают это расчетом. Содержание (концентрация) агрессивной углекислоты в воде (мг/л) может быть определено по следующей формуле: [со2].„= ^+^*+Щ&&+ЙйЦ _.гШд- £ f \ где е — эквивалентная масса свободной углекислоты, р.аввая 22 мг/мг-экз; А — коэффициент, учитывающий долю равновесной углекислоты в общей концентрации С02 и определяемый по формуле: л= КЕ-Са^ ____ КгПРсаСО, -ГО^{Г+5,9б где Кь Kg — константы первой и второй ступеней диссоциации угольной кислоты (табл. 6.3.1); ПРсаСо,— произведение растворимости СаСОз (табл. 6.3.2); ц — ионная сила раствора (воды), определяемая как ц-- ^,+2Мг3 ш_3| где 2>i, £г2, 2>3 — суммы мг-экв одновалентных (i>i), дзух-(2>2) и трехвалентных (2г3) ионов, обнаруженных в 1 л исследуемой воды; Са24 - концентрация кальция в воде, мг/л; (С02)о — общее содержание свободной углекислоты в воде, которая также определяется по формуле: /гг, л 44гЩп (СО2)о=«------- KrlQPH-nw гЩ0 — общая щелочность воды, определяется как /-Що = /-НС03- +2гСО-2мг-экв/л. Определив содержание в иоде агрессивной углекислоты, сравнивают его с нормативным (прил. 2, табл. 5). Выщелачивающая агрессивность воды проявляется при столь малом содержании угольной кислоты, при котором еще не достигнуто карбонатное равновесие, соответствующее произведению растворимости СаСО3, поэтому часть его перево дится в раствор даже при отсутствии агрессивной кислоты Выщелачивающая агрессия оценивается по нормам, приведенным в прил. 2 (табл. 3). Общекислотная агрессия определяется по рН воды. При низком рН усиливается растворение СаСО3 и, следовательно, цемент теряет вяжущие свойства. Считается, что при рН<5 вода весьма опасна для бетона. Общекислотная агрессин оценивается, по нормам, приведенным в прил. 2 (табл. 3). Магнезиальная агрессия заключается в том, что при значительном содержании магния в воде, в частности MyCla, on Т а б,'1 и ц.1 6.3.1 Значение констант первой и второй ступени диссоциации угольной кислоты и их отрицательные логарифмы
Т а б л п ц а 6.3.2 Значения произведения растворимости карбоната кальция
ПРСасо/ю-эй,022 8,152 8,282 8,406 8,518 8,625 8,738 8,370 8,092 Рпрсасо, 9'51 7>05 5'22 3'93 З'06 2>37 1.83 1,35 -1,002 вступает в обменную реакцию с кристаллическим гидратом окиси кальция бетона. В результате образуется гидрат окиси магния и хорошо растворимый хлорид кальция: Ca(OH)2+MgCl2->CaCl2+Mg(OH)2. Магнезиальная агрессия оценивается по содержанию ионов магния в воде {прил. 2, табл. 3). Особое место занимает сульфатная агрессия, заключающаяся в том, что сульфат-ионы реагируют с гидратом окиси кальция, не связанного с силикатам.и цемента. В результате образуются сульфаты кальция, которые, кристаллизуясь, за- Г- С\ нимают в 2,5 раза больший объем,'чем Са(ОН)2, бетон растрескивается и крошится. Реакция может проходить по схеме: Ca(OH)2+Na2S04+2H2O^CaSO.I.2H20 + 2i\aOH. nine Сульфатная агрессия проявляется также и в образовании двойной сернокислой соли алюминия и кальция (соль Деволя, или цементная бацилла). Этот процесс особенно интенсивен в гипсовых водах. Реакция идет по схеме: 4CaO-Al2Os-12H20+3CaSO4;2H20+O-> ->3CaO-Al2(V3CaSO4+Ca(OH)2+17rl\0. Сульфатная агрессия наиболее сильно проявляется при периодическом смачивании,и высыхании бетона из-за изменения уровня воды у сооружения. В таких условиях в трещинах бетона может происходить кристаллизация солей, разрастание их очагов и образование более крупных трещин. Содержание с\льфатов в воде не должно превышать норм, приведенных в табл. 4 прил. 2. Кроме разрушения цементного камня бетонного сооружения, некоторые компоненты, содержащиеся в воде, вызывают коррозию арматуры, что ведет к сильному ослаблению железобетонных сооружений, особенно с предварительно напряженной арматурой. В этом отношении опасно высокое содержание хлоридов, агрессивность которых усиливается в присутствии сульфатов (SO;j~). Степень агрессивного воздействия хлоридов, содержащихся в воде, на арматуру оценивается по нормам, приведенным в табл. 3 прил. 2. При совместном содержании в воде ионов хлора (С1~) и сульфатов ($0|~~) количество сульфатов пересчитывается на хлориды и суммируется с содержанием хлоридов. Таким образом, величина «хлоридов» (С1~)' для сравнения с нормами, табл. 4 прил. 2, определится как (Cl-)' = Cl-+0,25SOr-3. Кроме рассмотренных видов агрессии коррозия бетонных п железобетонных конструкций может происходить в воде и водных растворах, содержащих сложные комплексы химических соединений. К таким агрессивным средам относятся подземные и поверхностные воды высокой концентрации, а также жидкие технологические растворы. В этих случаях при опенке агрессивности по отдельным приведенным показателям во- 63 да может оказаться не агрессивной, но по общему содержанию активных соединений (сульфаты, хлориды, нитраты, ам-монийные соли, едкие щелочи) она может оцениваться как сильноагрессивная среда. Поэтому во всех случаях оценки агрессивности воды—среды рассматривают все виды коррозийного воздействия (табл. 4 црил. 2) и выбирают защитные меры по наиболее неблагоприятному виду. 6.4. Оценка коррозийного действия воды на металл Коррозия стенок паровых.котлов, стальных труб происходит в результате замещения железа водородом и образования железистых соединений, если в воде присутствуют свободный кислород, углекислота и сероводород. Она усиливается в присутствии соединений магния, марганца, сернистого желе за, органического вещества (масла, жиры). Оценивать коррозирующую способность воды можно по ее рН, который во многом определяется присутствием разных форм углекислоты. В нейтральной воде углекислотная система должна быть в равновесии. Такая вода называется стабильной, то есть не способной переводить в раствор карбонаты и другие соединения кальция, а также выводить их в осадок. В природных водах, однако, утлекислотная система часто отклоняется от равновесного состояния. Оценивают это отклонение (стабильность воды) в результате сравнения измеренного рН с рассчитанным, соответствующим равновесному состоянию карбонатов в данной воде. Эта концентрация водородных ионов называется «рН равновесного насыщения воды.карбонатом кальция» и обозначается рНс. Величина рНс определяется по следующей схеме: pHc=pK2-pnPCaco3-Ig(Ca2+)-lg(rlU0)+2,5lV~h7,6, где рК,2 — отрицательный логарифм второй ступени диссоциации угольной кислоты (табл. 6.3.1); рПРсасо3— отрицательный логарифм произведения растворимости СаСОз (табл. 6.3.2); Са2+ — содержание кальция в исследуемой воде, мг/л; гЩ0 — общая щелочность воды, мг-экв/л: ц. --ионная сила раствора (см. 6.3). Стабильность воды оценивается индексом насыщения / (индекс Ланжелье) / = рН-рНс. 64 Если / = 0 — вода стабильна. При /<0 — вода агрессивна и коррозионноопасна. При />0 — вода нестабильна и может образовывать корку из карбонатов кальция на стенках труб. Следует отметить, что этим способом можно определить Л'Ишь те свойства воды, которые зависят от наличия в пей агрессивной углекислоты. Однако с его помощью можно оценить способность воды к закупорке труб.карбонатом кальция, образованию корки на трубах, к уничтожению защитной пленки (корки) па стенках труб, отсутствие которой усиливает коррозию за счет других коррозионных агентов. По этой методике ведут технологические расчеты стабилизации воды. ПРИМЕР ОБРАБОТКИ АНАЛИЗА И ОЦЕНКИ КАЧЕСТВА ВОДЫ Заданы результаты химического анализа воды из скважины № 2038, пробуренной в Алтайском* крае (табл. 7.1). Т а б л и ц а 71 Данные химического анализа воды из скважины № 2038
Требуется: выразить данный химический анализ в миллиграмм-эквивалентной и процент-эквивалентной формах; определить общую минерализацию, сухой остаток, состав солей и жесткость; выразить данный анализ воды графическим способом (прямоугольников и циклограмм) и используя формулу Кур-лова; классифицировать исследуемую воду по О. А. Алекину (класс, группа, тип) и дать символ воды; определить пригодность воды для целей водоснабжения и орошения; определить агрессивность воды по отношению к бетону, стабильность (коррозионную способность). 7.1. Выражение результатов химического анализа воды Результаты химического анализа воды из скважины №2038 даны в ионной форме. Переведем их в миллиграмм-эквивалентную форму путем деления количества каждого компонента на его валентную массу (Э). При этом сумму катионоь Na + + K+ пересчитываем по эквивалентной массе \та, т. к. содержание калия в воде незначительно по сравнению с Na и в результатах анализа он не выделен. Например, из табл. 7.1 устанавливаем, что содержание Na + -f-K+ составляет 768 мг/л, a SO^~=-618 мг/л. Эквивалентная масса №т-|-Кг будет определяться как частное or деления молекулярной массы натрия (MMNa) на его валентность (BNaJ. MMNa 22,992 ^Na = - =22,992 мт, В nb 1 тогда содержание Na + -f-K+ в мг-экв/л будет равно Na++K+ 768,0 гЫа++гК+ = — - =33,41 мг-экв/л. Эма 22,992 Аналогично для S0^j~ имеем: MMSO4 96,066 jsq,— —------- = — ~ —=48, Обо мг (молекулярная bsd, масса SOJ- определена как 32,066 + 4-16 = 96,066). Содержание SO^~ в мг-экв/л будет равно .SO - S°42 =-HM = 12,86 мг-экв/л. '3so" 48'033 Таким же образом пересчитываем другие компоненты и проверяем правильность произведенного анализа воды. При правильно выполненном анализе воды сумма найденных эквивалентов катионов должна равняться сумме эквивалентов анионов. В нашем примере: /•Na++rK = 33,41 мг-экв/л гС\~ =37,2 мг-экв/л rMg2+ -12,5 мг-экв/л /-50;-= 12,86 мг-экв/л гСа2+ =9,13 мг-экв/л rHCOj-^4,93 мг-экв/л 2гКат =55,04 мг-экв/л 2гАн = 54,99 мг-экв/л, 66 Абсолютная ошибка составляет Д/ = 2гКат-2гАн = 55,04—54,99 = 0,05 мг-экв/л. Процент ошибки *= -^--100=-^ - ЮО-0,09 %. По- _,гАн 54,99 скольку процент ошибки не превышает 3, считаем что знали-; выполнен удовлетворительно. Для удобства последующих расчетов уравниваем количество миллиграмм-эквивалентов катионов и анионов путем вы-^;ггания абсолютного значения ошибки из rNa + + rK+ "Исправленное значение (rNa+^rK+J в эквивалентной форме бУ'ет равно (rNa ++rK;) =33,41-0,05 = 33,36 мг-экв/л. Значение Na + + K+ в ионной форме получим следующим образом; NV4-K+ = (гЫа++гК+)-ЭКа =33,36-22,992 = 766,98 мг/л. Результаты пересчета данных анализа заносим р табл. 7.1.1. _____________________________ Т а -1 л и ц а 7.1,1, Для вычисления процент-эквивалентов принимаем сумму миллиграмм-эквивалентов катионов и анионов за 100 % 'каждого в отдельности и определяем, сколько процентов составляют эквиваленты каждого компонента. Например, r(NaW). ^±m.ш= ЗМЁ 2гКат 54,99 Аналогично производим пересчет анионов и катионов, а результаты заносим в табл. 7.1.1 (графы 4, 8). 5* 67
7.2. Определение общей минерализации и сухого остатка Общая минерализация (М, г/л) определяется как суммарное содержание анионов и катионов, выраженных в ионной форме: М = 1Кат+2Лн = 1101,98+2238,0 = 3339,98 мг/л-3,34. Сухой остаток (С, г/л) определяем как: НСО, ЧП1 С = М------ г, —— =3339,98——' =3339,98—150,5 = 2 2 3189,48 мг/л = 3,19 г/л. Таким образом, общая концентрация солей в воде (общля минерализация) составляет 3,34 г/л, а при выпаривании остаток солей должен составить 3,19 г/л. 7.3. Состав солей Используем схему составления гипотетических солей (см. гл. 5.1) и количественное выражение катионов и анионов в миллиграмм-эквивалентной форме (табл. 7.1.1, графы 3, 7}. Так.как в рассматриваемой воде не обнаружено ионов SiO2s~ НРО4~ и СОз~, начнем оставлять соли с третьего блока схемы, т. е. гСа2+ соединяем последовательно с rSO^~ и /Т1СО^~. Получим соли: rCaSO4 = 9,13 при остатке аниона rSO^~ = 3,73. гСа (НСО3) =0, т. к. кальций исчерпан при получении гСа5О4-гНСО~ соединяем с rMg. rMg(HC03h =4,93 при остатке Mg = 7,57. В четвертом блоке соль NaHCO3 не образуется, т. к. все анионы НСО3~ использованы полностью. Поэтому катионы Г'Ыа+ соединяем с остатком rSO4 = 3,73. Получим /•Na2S04 = 3,73, при остатке rNa = 29,63, a rSO4 = 0. Далее по схеме rMgS04 = 0, так как все анионы rSO^" заняты в вышеполученных солях. rNaCI = 29,63 (по остатку rNa = 29,63). Остаток иона хлора составит 7,57 мг-экв/л. rMgCl2 = 7,57. Таким образом, все оставшиеся анионы хлора гС\~ = 7,о7 компенсируются катионами rMg2+ = 7,57. В результате получены соли: rS04 = 9,13 мг-экв/л rNaCl = 29,63 мг-экв/л rMg(HCO3)2 = 4,93 мг-экв/л rMgCl = 7.57 мг-экв/л rNaeSO4 = 3,73 мг-экв/л 2гСол = 54,99 мг-экв/л. 68 Так как сумма солей, выраженная в эквивалентной форме (2гСол), равна сумме эквивалентов анионов и катионов, соли составлены правильно. Переведем полученные соли в ионную форму. При этом воспользуемся значениями их эквивалентной массы: Са5О4=гСа§О4-Эсв501=9ДЗ-68,073=621,51 мг/л Mg{HC03)2=rMg(HC03)2-3Mg(HCos)s =4,93-73,179=360,77 мг/д Na2SO4 = rNa2SO4-3NaiSo4=3,73-71,024 = 264,92 мг/л NaCI = nNaCl-3Naci= 29,63-58,448= 1731,81 мг/л MgClE = rMgCl2-3MgCb = 7,57-47,617 = 360,47 мг/л 2Сол = 3339,48 мг/л Полученный результат 2Сол незначительно отличается от общей минерализации (<1 %), поэтому расчет можно считать удовлетворительным. 7.4. Жесткость воды Общая жесткость воды определяется как сумма Са и Mg, находящихся в воде. Общая жесткость в мг-экв/л гЖо^ = rMg2+-frCa2+-12,50+9,13-21,63 мг-экв; в немецких градусах Ж0° - 2,8 тЖо = 2,8 -21,63 -60,6 Н°. Карбонатная жесткость представлена только солями Mg(HCO3)2- гЖк=4,93 мг-экв/л или Жк°-4,93-2,8= 13,8 Ы°. Соли MgC03 в составе воды нет. Устранимая жесткость в данном случае равна карбонатной, а постоянная определяется как: ^Жп~''Жо--''Жу— = 21,63—4,93=16,70 мг-экв/л или Ж° =60,6-13,8 = 46,8 №. 7.5. Классификация воды по О. А. Алекину, графическое и аналитическое выражения анализа воды Используя данные анализа воды, выраженные в эквивалент-процентной форме (табл. 7.1.1, графы 4, 8) и классификационную схему О. А. Алекина (рис. 5.1.1), приходим к выводу, что данная вода относится к классу хлоридных, т. к. в ее составе преобладает анион хлора (гС1"~ = 67,7 %. что больше rSO^-^23,4 % и гНСО~ = 8,9 %). Группа воды натриевая, т. к..катионов натрия больше, чем других (rNa —60,7 % >• >rMg = 22,7 %>rCa = 16,6 %). Тип воды III, что определяется соотношением: rHCO3+rSO4<rCa-|-rMg, т. е. 8,9+23,4< 16,6+22,7 или 32,3 %<39,3 %.
Итак, по классификации О. А. Алекина, вода относится к хлоридно-патриевой III типа. Символ воды Clfj* —3,34. По общей минерализации (классификация Ж- С. Садыко-ва) вода относится к солоноватым, т. к. минерализация ее находится в пределах 3,0—5,0 г/л. Аналитическое выражение химического состава воды запишем в виде формулы солевого состава (формула Курло-ва), округлив значения процент-эквивалентов до целых чисел. М3,з4 С|б*50'зНСО[_ TiepH7i5. Na61Mg23Ca16 Графическое изображение рассматриваемого химического состава воды выполнено на рисунках 5.2.1, 5.2.2, 5.2.3. Следует отметить, что при изображении анализов с помощью циклограммы или прямоугольников на картах и разрезах для обозначения катионов и анионов следует пользоваться цветом. При этом принято обозначать: С1~ - красным цветом, SO;;- -желтым, СОз~ и НСО3" — голубым, Са2+ —бесцветным, Mg2+— коричневым, Na+--зеленым. Изображения химического состава в виде графиков-треугольников для одиночного анализа не используем. 7.6. Оценка качества воды для хозяйственно-питьевого водоснабжения Оценку качества воды произведем путем сравнения концентрации отдельных компонентов1 химического состава и хи- Таблица 7.6.1 Оценка пригодности воды для хозяйственно-питьевых целей «Это замечательное химическое соединение Н2О, без которого нет жизни, нет счастья, нет богатства, нет ничего на Земле...». Академик А. Е. Ферсман. Путешествие в Среднюю Азию, 1928 г.
70
мических свойств с требованиями ГОСТ 2874-82 (прил. 1, табл. 1). Данные сравнения сведем в табл. 7.6.1.
Таким образом, вода не отвечает требованиям ГОСТа по всем показателям, кроме рН, и не может быть рекомендована для хозяйственно-питьевых целей без улучшения ее качества. 7.7. Оценка качества воды для целей орошения По общей концентрации солей пригодность воды для орошения оненим по рекомендации акад. В. А. Ковда {табл. 6.2.3). При минерализации исследуемой воды 3,34 г/л применение ее для орошения предусматривает устройство дренажа с отводом до 50—60 % от объема оросительной нормы при соблюдении промывного режима. Способность воды к осолопцевапию оцениваем по нескольким показателям. По критерию осолонцевания И. //. Антшюва-Карагач-ви rCa2+ + rMg-2+ rCa2++rMg2+ 9,13+12,5 ----------------.-----(),zoo L-.--------—•------- =-------------- :- rNa + rNa^ 33.36 = 2-i^ = 0,65. 33,36 0,238 С = 0,238-3,18 = 0,756. Ввиду тога, что (),65<0,75б, осо-лонцевание почв будет происходить. По ирригационному коэффициенту. По табл. 6.2.2 [выбираем формулу для определения Ка. Поскольку rNa^OCl", т. е 33,36<37,20, 288 288 288 К,, —-------= -----------— ------- — 1,зо. 5гС1- 5-37,2 185.5 Сравнивая полученное значение с данными табл. 6.2.2, можно сделать вывод, что данная вода неудовлетворительна по качеству и при орошении требуется устройство искусственною дренажа. По величине «выверенного» адсорбционного соотношение натрия лЫа + , ._, Л SAR *=.—^-^^ ------ l + (8,4— pHc). VO,5(rCa2- + Mg2+). рН (.определим но данным табл. 6.2.4 по формуле pHe={pK2-fpKo)+p<Ca2++Mg2 +)+pAlK при rNa ++rMg2- + rCa2+ = 54,99, (рК2+рК0) =2,49, 71 при rMg2+ + rCa2+ = 9,13+12,5 = 21,63, p (Ca^ + Mg2") -2,0, при гСО324+ЖСО3- = 0+4,93-4,93, рА1к = 2,3. При полученных значениях составляющих рНс = 2,49+2,04- +2,3-6,79 .5Ла*:=^=33'36 ..[1 + (8,4-6.79)1= „J33'36.[1 + 1.61] = 1/0,5(9,13+12,5) У0,5- 21,63 _аЕ,.2,61=Ш = 26,47. УЮ,815 3,29 Так как полученные значения SAR * более 9 (см. гл. 0), оси-лонцевание почв при орошении данной водой будет происходить. По классификации С. Я. Сойфер данная вода при минг /•Na + рализации 3,34 и kns= - — = 0,61 относится rNa- + rMg2++rCa2+ к IV классу, 4-й группе (см. рис. 6.2.1 и табл. 6.2.5). Воду следует считать условно пригодной, требующей при орошении улучшения ее качества химмелиорацией, разбавлением др. По магнезиальной опасности rMg 2+ 12.5 12.5 ^Q58 rMg2++rCa2+ 12,5+9,13 21,63 гМ£2+ ввиду того, что----------------- = 0,58>0,5, магниевая ипас- rMg2++rCa2+ ность существует. В целом по оценке воды для орошения следует заключить, что вода имеет неудовлетворительное качество. Орошение ею возможно только при улучшении ее качества, т. к. она имеет высокую концентрацию солей натриевого состава и способна вызвать осолонцевание почв.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2019-05-20; просмотров: 262; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.018 с.) |