
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
N реальн. сист. N идеальн. сист.
niS – это избыток числа молей i-го компонента в реальной системе (первый член уравнения) по сравнению с идеализированной (второй член уравнения). На практике для описания состава поверхностного слоя пользуются величиной избыточной концентрации Гi Гi = niS / s, (моль/м2), (5.4) Гi называют ещё абсолютной адсорбцией i-го компонента. Таким же образом через избытки определяются все термодинамические функции поверхностного слоя:
Uреальн. сист. U идеализ. сист. т.е. U = Ua + Ub + US , (5.6) если в системе всего a фаз и s поверхностных слоев, то общий запас внутренней энергии системы: U = S Ua + S US, (5.7) a S
GS = G – (Ga + Gb) и т.д. (5.8)
Определяемые т.о. поверхностные избытки не зависят от толщины поверхностного слоя d, а зависят от положения поверхности SS¢. Оба метода в настоящее время используются каждый из них имеет свои достоинства и недостатки (в первом положительно то, что картина реальна, и вычисляется толщина слоя, а отрицательно то, что математическое описание довольно сложно; во втором положительно то, что не надо вычислять d, а отрицательно то, что физическая картина не реальна).
5.2. Фундаментальные уравнения Гиббса для гетерогенных систем. Термодинамическое определение поверхностного натяжения. Для любой объемной фазы фундаментальные уравнения Гиббса нам известны (из I и II законов термодинамики): dUa = Ta dSa - Pa dVa + S mia dn ia, (5.9) dGa = -Sa dTa + Va dPa + S mia dn ia, (5.10) (аналогично и для других функций: Н, F) Состояние поверхностного слоя выражается такими же уравнениями (если из U вычесть Ua и Ub): dUS = TS dSS + σ ds + S miS dn iS, (5.11) dGS = -SS dTS + σ ds + S miS dn iS, (5.12) здесь (-PdV – работа, совершаемая над системой, и аналогично для поверхностного слоя σds – работа создания поверхности раздела (она положительна)). Общее выражение для изменения энергии в любой гетерогенной системе с учетом всех объемных фаз и всех поверхностных слоев: dU = S Ta dSa - S P dVa + SS mia dn ia + S TS dSS + S σ ds + SS miS dn iS, (5.13) a a a i S S S i dG = -S Sa dTa + SVa dPa + SS mia dn ia - S SS dTS + S σ ds + SS miS dn iS, (5.14) a a a i S S S i В состоянии равновесия Ta = TS и mia = miS. Уравнения (5.13) и (5.14) - общие фундаментальные уравнения Гиббса для гетерогенной системы. В обычной термодинамике слагаемыми, относящимися к поверхности, пренебрегают. Так же можно записать для F и H.
При S, V и ni = const из (5.13): σ = (¶U/¶s)S, V, n i, (5.15) При Т, Р и ni = const из (3.14): σ = (¶G/¶s)T, Р, n i, (5.16) Аналогично можно записать для F и H, т.е.: σ = (¶G/¶s)T, Р, n i ; σ= (¶U/¶s)S, V, n i; σ = (¶F/¶s)T, V, n i; σ = (¶H/¶s)S, P, n i, (5.17) Т.о. σ - есть частная производная от любого термодинамического потенциала по площади межфазной поверхности при постоянных соответсвующих параметрах. На практике чаще встречаются условия Р, Т = const, поэтому записывают чаще через G – энергию Гиббса. Примечание: Заметим, что термодинамическое определение σ аналогично определению m, только σ характеризует межфазную поверхность, а m - растворенное вещество. Обе величины – это частные производные от термодинамических потенциалов, но в одном случае – по площади, в другом – по числу молей. Изменение энергии Гиббса межфазной поверхности G можно записать через удельную поверхностную энергию GS: G = GS ´ s; dG = d (GS ´s) = GS ´ ds + s ´ dGS, т.к. dG = σ ds, то σ = dG/ds или σ = ¶G/¶s = GS + s (¶GS/¶s), (5.18) Поверхность индивидуальных веществ имеет постоянный состав и является эквипотенциальной, поэтому ¶GS/¶s = 0 и σ = GS т.е. для них σ является в то же время удельной поверхностной энергией Гиббса. Для растворов ¶GS/¶s ¹ 0, т.к. меняется состав поверхностного слоя и GS зависит от удельной поверхности, поэтому σ ¹ GS (по ур-ю 5.18). 5.3. Уравнение Гиббса-Гельмгольца для внутренней полной удельной поверхностной энергии. Запишем объединенное уравнение I и II законов термодинамики для внутренней энергии единицы поверхности: DUS = DGS + TDSS, (5.19) В соответствии со II началом термодинамики: DSS = QS/T, (5.20) QS – теплота образования единицы поверхности в обратимом процессе. Т.к. для индивидуального вещества DGS = σ, то из (5.19) и (5.20), DUS = σ + QS, (5.21) т.е. внутренняя энергия поверхности складывается из энергии Гиббса и теплоты образования поверхности. Для многих веществ вклад энтропийной составляющей (TDSS) значителен, теплота образования поверхности составляет около половины поверхностной энергии в уравнениях (5.19) и (5.21). При образовании поверхности индивидуального вещества теплота всегда поглощается, т.е. QS > Q, поэтому удельная внутренняя энергия поверхности больше поверхностной энергии Гиббса на величину теплоты образования единицы поверхности. Её обычно называют полной поверхностной энергией.
Для объединенного уравнения I и II начал термодинамики dG = -S dT + σ ds + S mi dn i, при постоянстве всех параметров кроме Т dG = -S dT; ® S = - (¶GS/¶T)P = ¶QS/¶T, (5.22) из уравнения (5.19): DUS = DGS - T(¶DGS/¶T)P, (5.23) заменив DGS = σ, получим DUS = σ - T(¶σ/¶T)P (5.24) Уравнение (5.24) – уравнение Гиббса-Гельмгольца. Оно связывает полную поверхностную энергию (DUS) с энергией Гиббса (поверхностным натяжением). Анализ этого уравнения позволяет предсказать температурные зависимости энергетических параметров поверхностного слоя.
5.4. Температурные зависимости энергетических параметров поверхностного слоя. Для индивидуальных веществ теплота образования единицы поверхности QS > 0, следовательно из уравнения (5.22): (¶GS/¶T)P = (¶σ/¶T) P < 0, т.е. температурный коэффициент поверхностного натяжения ¶σ/¶T отрицателен, т.е. с ростом температуры σ уменьшается. Для большинства неполярных жидкостей зависимость σ от t° линейна: σt = σ0 – a DT, (5.25) где а = - ¶σ/¶T, σ0 – поверхностное натяжение при стандартной t°; DT – разность между данной температурой и стандартной; а – константа, равная температурному коэффициенту σ с обратным знаком. Для многих других веществ эта зависимость тоже близка к линейной, т.к. а слабо зависит от t°. Зная а, по формуле (5.25) определяют полную внутреннюю энергию той или иной межфазной поверхности. Более точно температурная зависимость σ от t° описывается полуэмпирическими зависимостями. Продифференцируем уравнение Гиббса-Гельмгольца по t°: DUS = σ - T(¶σ/¶T)P ¶DUS/¶T = ¶σ/¶T - ¶σ/¶T - T(¶2σ/¶T2), (5.26) ¶DUS/¶T = - T(¶2σ/¶T2) т.к. для большинства жидкостей ¶σ/¶T практически постоянно, то ¶2σ/¶T2 = 0, поэтому ¶DUS/¶T = 0, т.е. полная внутренняя энергия поверхности DUS не зависит от t°. Из уравнения (5.21) видно, что т.к. DUS не зависит от t°, а σ уменьшается с ростом t°, то QS – теплота образования поверхности с ростом t° возрастает. Графически эти зависимости изобразятся так:
DUS
рис. 5.2. Температурные зависимости энергетических параметров поверхности ЛЕКЦИЯ 6
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 213; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.1.158 (0.021 с.) |
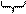
 внутренняя энергия US = U – (Ua + Ub), (5.5)
внутренняя энергия US = U – (Ua + Ub), (5.5)
 Ткр - t°, при которой поверхность раздела исчезает.
Ткр - t°, при которой поверхность раздела исчезает.
 QS
QS σ
σ Ткр t
Ткр t


