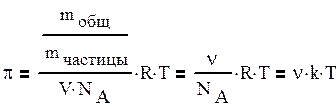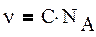Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярно-кинетические свойства дисперсных систем
К молекулярно-кинетическим свойствам коллоидных систем относят: 1. броуновское движение; 2. диффузию; 3. осмос. 1. Броуновское движение.
В 1828 г. английский ботаник Р.Броун обнаружил новое явление – тепловое движение частиц в коллоидных растворах, - названное броуновским движением. Наблюдая водную суспензию цветочной пыльцы под микроскопом, Броун установил, что интенсивность движения частиц не зависит от времени, освещенности, сотрясений, но значительно возрастает с ростом температуры и уменьшается с ростом вязкости раствора и массы частиц. Обнаруженное свойство оказалось присуще всем суспензиям. Попытки объяснить броуновское движение с позиций электростатического взаимодействия или конвекции не выдержали экспериментальной проверки. В 1888 г. Гуи, а в 1900 г. Экснер высказали предположение о молекулярно-кинетической природе броуновского движения. Открытие броуновского движения сыграло огромную роль в развитии материалистического мировоззрения в естествознании. До начала 20 века не было экспериментально установлено наличие атомов и молекул, хотя молекулярно-кинетическая теория уже существовала. Некоторые ученые (Вильгельм Оствальд) ставили под сомнение существование атомов и молекул как объективной реальности. Поэтому предположение о молекулярно-кинетической природе броуновского движения вызвало огромный интерес ряда выдающихся ученых, т.к. имело огромное теоретическое значение. В 1905-1906 г.г. Эйнштейн и Смолуховский разработали статистическую теорию броуновского движения на основе молекулярно-кинетических представлений. Исходным положением теории явилось предположение о хаотичности движения, т.е. о равной вероятности его в любом направлении. Молекулы среды, находящиеся в тепловом движении, наносят удары по коллоидной частицы с разных сторон. Если частица велика (≥ 5 мкм), то удары с разных сторон скомпенсированы, поэтому броуновское движение не наблюдается совсем или наблюдаются колебания частицы. В случае малых частиц удары нескомпенсированы, что вызывает хаотичное, импульсивное движение частицы в различных направлениях (поступательное или вращательное).Число импульсов достигает 10 в секунду. Поэтому траекторию движения частицы зафиксировать невозможно. Регистрируют проекцию траектории на плоскость.
Для количественной характеристики броуновского движения Эйнштейн и Смолуховский ввели понятие о среднем сдвиге ∆ частицы за время t. Это отрезок прямой от проекции начальной точки движения частицы в данный момент t на ось х в плоскости горизонтальной проекции, наблюдаемой в микроскопе. Для количественных расчетов необходимо, как правило, зарегистрировать движение частицы в определенном направлении х. При этом пользуются средним квадратичным сдвигом:
∆ n – число проекций, взятых для расчета. Понятие о среднем сдвиге введено Эйнштейном и Смолуховским, которые на основании статистических законов установили взаимосвязь между средним сдвигом частицы за время τ в данном направлении и коэффициентом диффузии D. 2. Диффузия. Уравнение Эйнштейна. Диффузия – это самопроизвольное выравнивание концентрации молекул, ионов или коллоидных частиц, приводящее к установлению одинакового значения химического потенциала каждого компонента во всех элементах объема. Диффузия – самопроизвольный необратимый процесс. Перенос массы в результате диффузии описывается первым законом Фика (1855 г.): (1) dm = -D dC S dτ
D = [см²/с] – коэффициент диффузии (численно равен количеству вещества, диффундирующего через единицу площади в единицу времени при градиенте концентрации = 1).
NA B B
где R – универсальная газовая постоянная, Т – абсолютная температура, k – константа Больцмана, (1,38 10¯²³ Дж/К). NA - число Авогадро, В – коэффициент трения. Для сферических частиц В = 6πηr, где η - вязкость
NA 6πηr Коэффициент диффузии прямо пропорционален абсолютной температуре Т, и обратно пропорционален вязкости среды и радиусу частиц. Так как размеры коллоидных частиц велики по сравнению с размерами молекул, то коэффициент диффузии в коллоидных растворах мал.
Для обычных молекул и ионов D ≈ 10-5, а для коллоидных частиц 10-7 – 10-9 см²/с. Диффузия в твердых телах происходит очень медленно. (Dтв. ~10-20 – 10-6 см²/с при t° 500-1000°C.) Поэтому в природе в кристаллах некоторых минералов (граната, плагиоклаза), grad C сохранился в течение миллионов лет. Коэффициент диффузии коллоидных частиц может быть измерен экспериментально. Это используют для определения радиуса коллоидных частиц. Из (4) находим: r = kt / 6πηD Экспериментальные методы определения коэффициента диффузии основаны на том, что раствор диффундирующего вещества приводят в контакт с растворителем так, чтобы в начале между ними была четкая граница раздела. Затем определяют наступившее в результате диффузии распределение концентрации растворенного вещества в системе. Определение концентрации производят либо методом отбора проб, либо с помощью оптических измерений. Коэффициент диффузии рассчитывают по уравнению (1). 3. Уравнение Эйнштейна (1905) – Смолуховского (1906). Устанавливают взаимосвязь между средним сдвигом частицы за время τ в данном направлении ∆ и коэффициентом диффузии D. ∆ = f(D). Возьмем трубку с коллоидным раствором поперечным сечением S см². С1 > С2, поэтому диффузия идет слева направо. Выделим 2 слоя раствора 1 и 2 с концентрацией С1 и С2 толщиной ∆.
∆← М ∆→
 
С1 С2
 
N∆
Вследствие хаотичности броуновского движения перенос частиц равновероятен вправо и влево, т.е. половина частиц вправо, половина влево. Масса вещества, перенесенного за время τ через плоскость MN вправо: (1) m1 = C1∆S / 2, а влево m2 = C2∆S / 2. В результате количество продиффуидировавшего вещества через границу MN слева направо: (2) m = m1 - m2 = 1/2 ∆S (C1 – C2)
Но т.к. (3) C1 – C2 = - dC, то (С1 – С2) = - ∆ dC (4)
Подставим (4) в (2):
dx Уравнение Фика: m = - DS τ dC (6)
Откуда D τ = 1/2 ∆² или D = ∆² / 2 τ или ∆² = √2 D τ (7) Откуда следует, что смещение пропорционально √ из времени. Подставим в (7) уравнение Эйнштейна: D = kT / 6πηr и получим:
NA6πηr 3 πηr (8) Уравнение Эйнштейна - Смолуховского Из уравнения (8) следует, что частицы перемещаются тем быстрее, чем > t°, < η и r частиц. Экспериментальная проверка подтверждает правильность уравнения Эйнштейна – Смолуховского. Сведберг в 1909 г. подтвердил его справедливость для лиозолей золота; Зеддиг (1908) – подтвердил связь ∆ с t°; Перрен (1910) определил число Авогадро, применив уравнение Эйнштейна – Смолуховского (6,8 10²³), проведя опыты с суспензией гуммигута (смола из высушенного сока каучуконосов). Де Бройль в 1909 г. экспериментально доказал справедливость закона Эйнштейна – Смолуховского для аэрозолей. Он измерил скорость движения частиц табачного дыма в горизонтальном электрическом поле и средний сдвиг при Броуновском движении. Справедливость закона Эйнштейна- Смолуховского для коллоидных систем приводит к фундаментальному выводу о том, что для ультрамикрогетерогенных систем справедливы все законы молекулярно-кинетической теории, которым подчиняются молекулярные системы. А именно:
1.По уравнению (8) можно рассчитать скорость движения частицы и ее энергию, если частица участвует в броуновском движении. (E = mV² / 2 = 3 / 2 kT). 2. Для ультрамикрогетерогенных аэрозолей справедлив обобщенный газовый закон: pV = n/N RT (10) где n – общее число частиц, N – число частиц, на которые диспергирован 1 моль вещества дисперсной фазы аэрозоля. Из (10) следует, что при уменьшении размеров частиц до молекулярных число частиц N = числу Авогадро и уравнение (10) принимает вид уравнения Менделеева – Клапейрона. 3.Специфика применения правила фаз Гиббса. Если размер коллоидных частиц очень мал (ультрамикрогетерогенные системы), то к системе применимо правило фаз Гиббса без учета дисперсности: F = K – Ф +2
По мере увеличения размеров частиц гетерогенность все сильнее влияет на свойства систем дисперсность становится существенным термодинамическим параметром системы. Для дисперсных систем правило фаз Гиббса записывают в виде: F = K – Ф +3
Однако следует помнить, что оба соотношения эквивалентны, т.к. соответственно меняется и число фаз. Например: Например: для простых бинарных систем при учете гетерогенности
Ф = 2, без учета Ф = 1.
Т.о. промежуточное ультрамикрогетерогенных систем проявляется в том, что с одной стороны они подчиняются законам молекулярно-кинетическим (т.е. ведут себя как истинные растворы), с другой стороны могут проявлять и многофазность, т.к. является системами гетерогенными. Частичная масса Мd показывает во сколько раз масса частицы > 1/16 массы атома кислорода.
4.Применимость уравнения Вант-Гоффа (π = С RT) к коллоидным растворам. Чем выше дисперсность, тем ближе система к истинному раствору, тем меньше дисперсность, тем система ближе к истинному гетерогенно-дисперсному состоянию. Применимость к золям молекулярно-кинетических законов позволяет рассматривать их как истинные растворы. Для истинных растворов осмотическое давление:
(11) Осмотическое давление разбавленного коллоидного раствора описывается тем же уравнением, но через частичную концентрацию:
(12)
Из (12) видно, что Пколл.р-ров << Пист.р-ров, т.к. при одной и той же массе растворенного вещества число частиц в истинном растворе << чем в коллоидном. Уравнение (12) применяется для определения r коллоидных частиц и их агрегирования.
Таким образом, молекулярно-кинетические свойства коллоидных растворов не имеют качественных отличий от молекулярно-кинетических свойств истинных растворов. Слабое проявление осмоса и диффузии обусловлено сравнительно большими размерами частиц и сравнительно малым их количеством по сравнению с истинными растворами.
|
|||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 258; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.156.46 (0.026 с.) |
 ∆ =√ ∆1² + ∆2² + ∆3²…
∆ =√ ∆1² + ∆2² + ∆3²… n
n dx
dx


 Уравнение Эйнштейна.
Уравнение Эйнштейна.





 ∆ dx dx
∆ dx dx m = -1/2 ∆²SdC (5)
m = -1/2 ∆²SdC (5) dx
dx
 ∆ = √RT 2 τ = √ kT τ
∆ = √RT 2 τ = √ kT τ