
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Самопроизвольное диспергирование
Термодинамически устойчивые коллоидные системы, полученные в результате самопроизвольного диспергирования, по предложению П.А. Ребиндера, называют лиофильными. Название отражает существование значительных взаимодействий между дисперсной фазой и дисперсионной средой. Изменение свободной энергии в процессе самопроизвольного диспергирования на основании II начала термодинамики: ΔF = ΔU + Δs ∙ σ1,2 – TΔS (2.7) ΔU ≈ 0, σ1,2 – сгущение свободной энергии в межфазном слое, Δs – площадь межфазной поверхности. Условие самопроизвольного диспергирования определяется неравенством: Δs · σ1,2 – TΔS ≤ 0 (2.8) Первое слагаемое – это возрастание свободной энергии при диспергировании, второе – убыль свободной энергии вследствие распределения дисперсной фазы в объеме. Самодиспергирование происходит тогда, когда второй член преобладает. Это бывает возможно при малых величинах σ1,2. В этом случае увеличение плотности свободной энергии σ1,2 (или иначе межфазное поверхностное натяжение) сравнимо по величине или даже меньше, чем σкр – критическое значение межфазного поверхностного натяжения, при котором возможно самопроизвольное диспергирование. Для коллоидных систем σкр ≈ 0,01 эрг/см2. Самопроизвольное диспергирование заканчивается при достижении определенных размеров коллоидных частиц. До молекулярных размеров процесс идти не может вследствие нерастворимости вещества коллоидных частиц в дисперсионной среде. Таким образом, устанавливается термодинамическое равновесие, характеризующееся определенным распределением частиц по размерам. 2) Конденсационные методы Методами конденсации можно получить частицы любого размера в зависимости от условий, в том числе и высокодисперсные (10-6 – 10-7 см). Механизм процесса конденсации. Считается, что конденсирование есть процесс кристаллизации, а образовавшиеся коллоидные частицы представляют собой мельчайшие кристаллики. Образование кристаллических коллоидных частиц имеет две стадии: 1) возникновение зародышей (центров кристаллизации) в пересыщенном растворе, 2) рост зародышей малорастворимого соединения. Стадия1. Пересыщение в растворе может возникнуть либо в результате химической реакции, либо при уменьшении растворимости за счет снижения температуры или замены растворителя.
Вначале считалось, что образование зародышей кристаллов происходит самопроизвольно, без участия каких-либо посторонних частиц в растворе. Т.е. молекулы или ионы в пересыщенном растворе, соединяясь друг с другом в кристаллическом порядке, образуют зародыш новой фазы, который затем растет. Скорость образования зародыша прямо пропорциональна избытку вещества в пересыщенном растворе (Сп–Сн) и обратно пропорциональна концентрации насыщенного раствора (Сн): v 1 = k Чем больше пересыщение, тем больше образуется зародышей и тем они мельче. Т.е. при создании значительных пересыщений возможно получение более высокодисперсных коллоидных систем. Однако, вскоре было экспериментально установлено, что выпадение кристаллов из пересыщенных растворов в значительной степени зависит от чистоты раствора, т.е. от наличия в растворе посторонних взвешенных частиц. В растворах, тщательно очищенных от примесей инородных твердых частиц, даже при значительном пересыщении раствора, кристаллы не образуются в течение долгого времени. И наоборот, введение в пересыщенный раствор чужеродных частиц, примесей или кристаллов растворенного вещества сразу же вызывает кристаллизацию. Это наблюдение привело ученых к выводу о том, что образование центров кристаллизации в пересыщенных растворах происходит на уже имеющихся в системе поверхностях раздела. Теория образования зародышей новой фазы предложена в 1878 г Гиббсом, и в 20-е годы развивалась Фольмером. Согласно современным представлениям о зародышеобразовании, растворимость малых частиц дисперсной фазы больше, чем у крупных частиц (закон У. Томсона). Т.е. увеличение дисперсности твердой фазы повышает ее растворимость в окружающей среде. Поэтому раствор, насыщенный относительно крупных кристаллов, не является насыщенным относительно мелких кристаллов того же вещества. В таких условиях, когда раствор не насыщен относительно мелких зародышей, они не могут вызвать кристаллизацию. Поэтому для образования новой фазы нужны значительные пересыщения.
Для создания новой поверхности раздела фаз необходима затрата энергии. Поэтому образование зародышей сопровождается увеличением свободной энергии, а, следовательно, этот процесс несамопроизвольный. Когда зародыши достигнут определенных размеров, становится возможным их рост, при этом происходит переход из метастабильного состояния в стабильное, что сопровождается уменьшением свободной энергии системы. Этот процесс – самопроизвольный. Иначе происходит образование кристаллической фазы, если в системе присутствуют чужеродные зародыши или введены кристаллики, полученные заранее. Наличие в системе межфазных поверхностей облегчает образование новой фазы. При этом, вводя определенное количество чужеродных зародышей, можно регулировать дисперсность получаемых золей. Стадия 2. Рост кристаллов представляет собой сложный многостадийный процесс: 1) стадия диффузии ионов или молекул, образующих кристаллическую решетку частицы, из раствора к поверхности растущего зародыша, 2) диффузия иона или молекулы по поверхности растущей грани к месту встраивания в решетку кристалла, 3) адсорбция ионов или молекул на поверхности. Для получения устойчивых золей необходимы условия, в которых v 1 – скорость образования зародышей – велика, а v 2 – скорость роста кристалликов – мала. Только в этом случае образуется множество мелких кристалликов, соответствующих коллоидным размерам. В результате химической реакции, приводящей к образованию малорастворимых веществ, при малых концентрациях реагирующих веществ получаются золи; размеры коллоидных частиц малы, т.к. скорость кристаллизации в разбавленных растворах очень мала, поэтому образуется большое число мелких зародышей, в результате чего пересыщение раствора исчезает. В очень концентрированных растворах, в результате химической реакции, образующиеся малорастворимые соединения выпадают в виде гелей. В этих условиях образуется много зародышей, и скорость их роста тоже велика. Происходит параллельно два процесса – рост зародышей и образование новых зародышей. Поэтому в условиях высоких концентраций образуются полидисперсные системы. При средних концентрациях образуются осадки. Скорости зародышеобразования и роста кристаллов примерно одинаковы. Скорость образования и роста зародышей можно регулировать добавкой некоторых веществ в раствор. Рост зародышей прекращается, если ввести KI или KBr, которые адсорбируются на гранях кристаллов, препятствуя росту. Таким образом можно получить мелкодисперсную золь. K3Fe(CN)6 и K4Fe(CN)6 предотвращают или замедляют образование зародышей. Если в такую систему ввести чужеродные кристаллы, начинается их рост. Иногда в процессе конденсации образуются коллоидные частицы аморфной структуры. Это особенно характерно для быстрого осаждения при значительных пересыщениях. Впоследствии частицы приобретают кристаллическую структуру в результате вторичной перестройки. Новейшие исследования Каргина и Берестневой показали, что образование некоторых коллоидных систем начинается со стадии образования аморфных частиц. Далее внутри аморфной частицы создаются кристаллики, что сопровождается уменьшением свободной энергии системы. Кристаллизованные частицы, распадаясь, образуют дисперсную фазу. Таким образом, возможны различные механизмы образования золей.
Все конденсационные методы можно подразделить на физические и химические. К физическим относятся: 1) конденсация из паров (образование тумана при понижении температуры), 2) метод замены растворителя (например, сера в спиртоводном растворе). Растворимость серы в спирте намного больше, чем в воде. Если насыщенный раствор серы в спирте влить в большой объем воды, то раствор серы оказывается пересыщенным, происходит агрегирование частиц серы и образование дисперсной фазы. Так получают золи серы, фосфора, канифоли, мышьяка и многих органических веществ. Химические методы: вещество, образующее дисперсную фазу, появляется в результате химической реакции (реакции окисления, гидролиза, диссоциации). Пример: Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
II. 2. Очистка коллоидных систем Лиозоли часто содержат низкомолекулярные примеси. Например, в разобранном случае – образование золя ВаSO4 – такой примесью является NaCl. Чужеродные электролиты нарушают устойчивость золей, поэтому возникает необходимость их очистки. Простейшим методом очистки золей является диализ. Диализатор представляет собой сосуд из полупроницаемого материала, в который заливают диализуемую жидкость. Сосуд опускают в воду. Происходит переход в воду электролита из сосуда. В качестве полупроницаемой мембраны используется либо коллодий (раствор нитрата целлюлозы), либо целлофан, либо пергамент (в зависимости от природы отмываемого электролита). Электродиализ Диализ идет за счет движения ионов в электрическом поле через мембрану из коллоидного раствора в воду, которая протекает в боковых камерах. Ультрафильтрация Продавливание жидкости через полупроницаемую мембрану. Это диализ под давлением, или обратный осмос. Мембрана пропускает только молекулы растворителя и иногда ионы. Ультрафильтрация широко применяется в лабораторной практике, медицине, промышленности. Применяют для очистки воды, органических растворителей, жидкого топлива и масел; разделяют сложные смеси белков, выделяют ферменты, витамины, вирусы, стерилизуют жидкости фармацевтического и медицинского назначения. Используют при анализе загрязнений воздушных бассейнов и природных водоемов промышленными и бытовыми отходами.
|
|||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 670; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.166.7 (0.012 с.) |
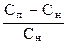 (2.9)
(2.9)


