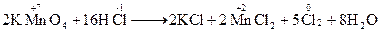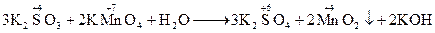Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Типи окисно-відновних реакцій: міжмолекулярні, внутрішньомолекулярні та реакції диспропорціювання.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Міжмолекулярн і окисно-відновні реакції: елемент-окисник і елемент-відновник знаходяться в різних речовинах; обмін електронами відбувається між різними атомами чи молекулами. Приклади:
* Реакції між речовинами, що містять атоми одного й того ж самого елементу але в різних ступенях окиснення, теж є міжмолекулярними Внутрішньомолекулярні окисно-відновні реакції:елемент-окисник і елемент-відновник знаходяться в одній і тій жемолекулі. Приклади:
* Внутрішньомолекулярні реакції протікають, як правило, при термічномурозкладанніречовин, що містять окисник і відновник. Реакція диспропорціювання: один і той же елемент в одній і тій же молекулі одночасно підвищує і знижує ступінь окиснення. Приклади:
Методелектронного балансу. В процесі окисно-відновної реакції атоми одного елементу (чи елементів) віддають електрони, а атоми іншого елементу (чи елементів) їх приймають; при цьому кількість відданих електронів обов’язково дорівнює кількості прийнятих електронів (баланс електронів). Такої рівності досягають шляхом підбору таких коефіцієнтів у рівнянні реакції для відновника і окислювача, при яких кількість електронів, відданих відновником, дорівнювала би кількості електронів, прийнятих окисником. Електронний баланс – метод знаходження коефіцієнтів у рівняннях окисно-відновних реакцій, у якому розглядається обмін електронами між атомами елементів, що змінюють свій ступінь окиснення. Складання рівнянь здійснюється в декілька стадій: 1) записують схему реакції (при цьому формули вихідних речовин поміщають зліва від стрілки – покажчика напрямку процесу, формули речовин-продуктів реакції – справа): KMnO4 + HCl ® KCl + MnCl2 + Cl2 + H2O 2) встановлюють ступені окиснення елементів і відмічають ті елементи, що змінюють свій ступінь окиснення в ході реакції:
3) для кожного елемента, що змінює свій ступінь окиснення, складають рівняння напівпроцесу окиснення чи відновлення:
2 4) встановлюють коефіцієнти, необхідні для балансу електронів:
5) проставляють ці коефіцієнти перед формулами речовин, що містять відповідні елементи до і після реакції: 2 6) підбирають коефіцієнти для всіх інших молекул речовин з розрахунку, що кількості атомів різних елементів в правій і лівій частині рівняння повинні бути рівними; перевіряють правильність підбору коефіцієнтів:
Методелектронно-іонного балансу (метод напівреакцій) – метод підбору коефіцієнтів, у якомурозглядається обмін електронами між іонами в розчині з урахуванням характеру середовища. Складання рівнянь здійснюється в декілька стадій: 1) записують схему перебігу реакції в розчині в іонному вигляді та зазначають іони, які зазнають зміни в ході реакції: KMnO4+HCl → KCl+MnCl2+Cl2+H2O K++ MnO4 –+H++ Cl– → K++Cl–+ Mn2+ +2Cl–+ Cl2 +H2O 2) складають схеми іонних напівреакцій за участю реально існуючих в розчині іонів і молекул, урівнюючи при цьому кількість атомів кожного елементу в лівій і правій частині напівреакції (для зв'язування атомів О використовують H+ (при цьому утворюється H2O) або H2O (при цьому утворюється OH–); для введення атомів О використовують H2O (при цьому утворюється Н+) та OH– (при цьому утворюється H2O):
1) урівнюють загальне число зарядів в лівій і правій частині кожної напівреакції (додаючи або віднімаючи необхідну кількість електронів) та підбирають такі коефіцієнти для кожної напівреакції, щоб число електронів, відданих відновником дорівнювало числу електронів, прийнятих окисником (баланс електронів):
2) записують сумарне скорочене іонне рівняння, складаючи ліві і праві частини напівреакцій з врахуванням коефіцієнтів: 10Cl–+2MnО4–+16H+ ® 5Cl20+2Mn2++8H2O 3) записують повне іонне рівняння, додаючи відповідно до лівої та правої частини рівняння іони, що не зазнали змін в ході реакції: 2К ++10Cl–+2MnО4–+16H++ 6Cl – ® 6Cl – +5Cl20+2Mn2++8H2O+ 2К+ 4) записують рівняння реакції в молекулярному вигляді:
В залежності від середовища окисно-відновна реакція протікає з утворенням різних продуктів окиснення і відновлення. Так, при взаємодії перманганату калію KMnO4 з відновником утворяться різні продукти відновлення в залежності від реакції середовища:
· у кислому середовищі:
––––––––––––––––––––––––––––––––––––––––––––––––––– 2MnO4- + 16H+ + 5SO32- + 5H2O ® 2Mn2+ + 8H2O + 5SO42- + 10H+ після відповідних скорочень маємо 2MnO4- + 6H+ + 5SO32- ® 2Mn2+ + 3H2O + 5SO42-
Фіолетовий розчин (KMnO4) знебарвлюється.
· у нейтральному середовищі:
––––––––––––––––––––––––––––––––––––––––––––––––––– 2MnO4-+ 4H2O + 3SO32- + 6OH- ® 2MnO2 + 8OH- + 3SO42- + 3H2O після відповідних скорочень маємо 2MnO4-+ H2O + 3SO32- ® 2MnO2 + 2OH- + 3SO42-
Фіолетовий розчин (KMnO4) знебарвлюється і спостерігається випадання бурого осаду.
· в лужному середовищі:
––––––––––––––––––––––––––––––––––––– SO32- + 2OH- + 2MnO4- ® SO42- + H2O + 2MnO42-
Фіолетовий розчин (KMnO4) перетворюється в зеленуватий (K2MnO4). Розрахункові задачі:
1. Електроліз розчину K2SO4 проводили при силі струму 5 А протягом 3 годин. Складіть електронні рівняння процесів, які проходять на електродах, визначте об’єм речовин, які виділяються на електродах. 2. Складіть електродні рівняння процесів, що проходять на електродах при електролізі розчинів AlCl3, NiSO4. В обох випадках анод вугільний. 3. При електролізі розчину CuSO4 на аноді виділилося 168 см3 кисню, виміряного при н.у. Скільки грам міді виділилося на катоді? 4. Електроліз розчину аргентум нітрату проводили при силі струму 2 А, протягом 4 годин. Скільки грамів срібла виділилося на катоді? 5. Скільки грамів води розклалося протягом 5 годин при електролізі розчину Na2SO4 при силі струму 7 А? 6. Електроліз розчину сульфату деякого металу проводили при силі струму 6 А протягом 45 хвилин, в результаті чого на катоді виділилося 5,49 г металу. Визначте молярну масу еквіваленту металу. 7. Складіть електронні рівняння процесів, що проходять на електродах при електролізі розчину КОН, розплаву КОН. 8. Електроліз розчину цинк сульфату проводили протягом 5 годин, в результаті чого виділилося 6 л кисню, виміряного при н.у. Визначте силу струму. 9. Складіть електронні рівняння процесів, що проходять на електродах при електролізі розчину Al2(SO4)3 у випадку вугільного аноду; у випадку алюмінієвого аноду. 10. Які речовини і в якій кількості виділяться на вугільних електродах при електролізі розчину NaI протягом 2,5 годин, якщо сила струму рівна 6 А. 11. При електролізі розчину AgNO3 маса срібного аноду зменшилася на 5,4 г. Скільки кулонів (1 Кл = 1А·с) електрики витрачено на цей процес? 12. Які речовини і в якій кількості виділяються на вугільних електродах при електролізі розчину KBr протягом 1 год.35 хв. При силі струму 15 А. 13. Складіть електронні рівняння процесів, що проходять при електролізі CuCl2, якщо анод мідний; якщо анод вугільний. 14. На електроліз розчину CаCl2 витрачено 10722,2 Кл електрики. Визначте масу речовини, яка виділяється на вугільних електродах. 15. Складіть електронні рівняння процесів, що проходять при електролізі розчину КCl; розплаву КCl. 16. Скільки часу потрібно проводити електроліз розчину електроліту при силі струму 5 А, якщо на катоді виділяється 0,1 г-екв речовини? Скільки виділиться речовини на аноді? 17. При електролізі розчинів MgSO4 і ZnCl2, з’єднаних послідовно з джерелом струму, на одному із катодів виділилося 0,25 г водню. Скільки грамів речовини виділиться на другому катоді; на анодах. 18. Чому буде рівна сила струму, якщо при електролізі розчину MgCl2 протягом 30 хв. на катоді виділилося 8,4 л водню, виміряного при н.у. Визначте масу речовини, що виділяється на аноді. 19. Скільки грамів Н2SO4 утворюється біля аноду при електролізі розчину Na2SO4, якщо на аноді виділяється 1,12 л кисню, виміряного при н.у.? Визначте масу речовини, що виділяється на катоді. 20. Визначте силу струму, знаючи, що при електролізі розчину КОН протягом 1 год. 15 хв. 20 с на аноді виділилося 6,4 г кисню. Яка речовина і в якій кількості виділяється на катоді? 21. При силі струму 2 А протягом 40 хв. на катоді виділилося 4,542 г деякого металу. Визначте електрохімічний еквівалент цього металу. 22. Яку масу алюмінію можна одержати при електролізі розплаву Al2O3, якщо протягом 1 год. пропускати струм силою 20000 А (при виході по струму 85%). 23. Запишіть схему електролізу водного розчину кальцій йодиду на вугільних електродах. Вкажіть молекулярну масу речовини, яка виділяється на аноді. 24. Визначте силу струму, яка необхідна для процесу електролізу розплаву магній хлориду протягом 10 год. (при виході по струму 85%), щоб одержати 0,5 кг металічного магнію? 25. Методом електронного балансу урівняйте окисно-відновні реакції, визначте окисник і відновник: 1. КMnO4 + Na2SO3+ KOH→ K2MnO4 + Na2SO4 + H2O 2. КMnO4 + Na2SO3+ H2O→ MnO2 + Na2SO4 + KOH 3. Cl2 + Na2S + H2O → HCl + Na2SO4 4. S + KOH →K2S + K2SO3 + H2O 5. КMnO4 + HCl → MnCl2 + KCl + Cl2 + H2O 6. Cl2 + I2 + H2O → HCl + HIO3 7. H2O + As2S3 + HNO3 ® H3AsO4 + H2SO4 + NO 8. NH4NO3 ® N2O + H2O 9. Cu + H2SO4 ® CuSO4 + SO2 + H2O 10. Cl2 + NaOH ® NaCl + NaClO + H2O 11. P + KOH + H2O ® PH3 + KH2PO2 12. Rb + H2O ® RbOH + H2 13. HClO3 ® ClO2 + HClO4 14. Cl2 + H2S + H2O ® H2SO4 + HCl 15. FeSO4 + KMnO4 + H2SO4 ® Fe2(SO4)3 + MnSO4 + K2SO4 + H2O 16. H2O2 + KMnO4 + H2SO4 ® O2 + K2SO4 + MnSO4 + H2O 17. K2Cr2O7 + H2S + H2SO4 ® S + Cr2(SO4)3 + K2SO4 + H2O 18.C + H2SO4 ® CO2 + SO2 + H2O 19. Zn + HNO3 ® Zn(NO3)2 + N2 + H2O 20. KClO3 + FeSO4 + H2SO4 ® KCl + Fe2(SO4)3 + H2O
Лабораторна робота № 4
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 460; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.19.123 (0.007 с.) |


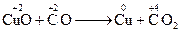


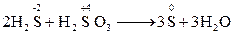 *
*

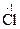









 + 5ē ®
+ 5ē ® 
 2
2