Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Імуноглобуліни різних класівСодержание книги
Поиск на нашем сайте
1. Загальна характеристика. Імуноглобуліни з’явились 400 млн. років тому у круглоротих риб одночасно з виникненням у цього класу тварин організованої лімфоїдної тканини та вилочкової залози. Першими з’явились IgM. У акул є лише цей клас антитіл. Через 200 млн. років у дводишних риб відбувся поділ імуноглобулінів на класи. Підкласи з’явились на більш пізніх етапах еволюції. Біологічна доцільність такої диференціації поки що не з’ясована. Мабуть, вона спрямована на підвищення спеціалізації і протективної ролі антитіл. Механізм клітинного імунітету та неспецифічні фактори резистентності достатньо надійно забезпечують протираковий та антиінфекційний захист нижчих тварин. Виникнення системи гуморальної відповіді у риб та її подальше удосконалення у земноводних, птахів та ссавців, можливо, було зумовлено необхідністю підвищення ефективності антиінфекційного захисту або ускладненням гормональних та ферментних систем. Гуморальний імунітет, можливо, сприяє підвищенню гомогенності структури молекул гормонів та інших біологічно активних речовин, що знаходяться у крові та тканинній рідині, і досягненню високої специфічності їх дії при низькій концентрації активної речовини. Цей процес може здійснюватися шляхом елімінації молекул із зміненою конформацією за допомогою антитіл. З такого припущення витікає, що у індивідів з дефіцитом гуморального імунітету повинні частіше зустрічатися порушення механізмів гуморальної регуляції діяльності систем та органів. Як відомо, за фізико-хімічною структурою, антигенністю та біологічною функцією імуноглобуліни поділяють на 5 основних класів: IgM, IgG, IgA, IgD, IgE. Імуноглобулінам кожного класу характерні специфічні фізико-хімічні та біологічні властивості. Є антитіла однакової специфічності, що належать до різних класів, в той же час антитіла, що належать до одного класу можуть мати різну специфічність. У здорових людей кількість імуноглобулінів одного класу не залежить від кількості імуноглобулінів інших класів і залишається досить сталою протягом тривалого часу. Активність антитіл різних класів неоднозначна в різних серологічних реакціях. Функціональні відмінності антитіл зумовлені специфікою структури молекул імуноглобулінів. Наприклад, для видалення з кровотоку 50% введених чужорідних еритроцитів або паличок тифу молекул IgG потрібно у сотні разів більше, ніж IgM. IgG володіють високою нейтралізуючою активністю по відношенню до вірусів та токсинів, а IgM – по відношенню до бактерій та крупних вірусів. Низька токсиконейтралізуюча активність IgM, можливо, зумовлена їх слабким афінітетом у зв’язку з відсутністю можливості утворювати чисельні зв’язки з невеликими молекулами антигенів. IgM утворюються при проникненні в організм корпускулярних антигенів. Відповідь реалізується швидко, однак імунологічна пам’ять у клонів клітин, що синтезують IgM, зберігається слабо або зовсім відсутня, і тому синтез IgM при повторному введенні цього антигена здійснюється за первинним типом імунної відповіді. Оскільки коефіцієнт ідентичності гама- та мю- ланцюгів за амінокислотними залишками менший 40%, то за розрахунками частоти мутацій у постійних ланцюгах імуноглобулінів вони виникли від загального ланцюга-попередника, приблизно 200 млн. років тому. У підкласах гама-ланцюгів більше 90% амінокислотних залишків однакові. Це говорить про те, що вони виникли від загального ланцюга відносно недавно – 20-30 млн. років тому. Ще не вияснені механізми, які привели до появи антитіл та їх різних класів і підкласів. Наступний, більш високий етап імунологічної реактивності, - утворення молекул IgG. Цей клас імуноглобулінів синтезується протягом більш тривалого часу після антигенного стимулу і зв’язує уже не тільки корпускулярні, але й розчинні антигени. Афінність IgG зростає в тисячі та десятки тисяч разів. Наявність пам’яті по відношенню до антитіл цього класу дозволяє організму, у випадку необхідності, різко збільшити їх продукцію протягом короткого періоду часу, тобто уже є можливість зберігати імунітет протягом тривалого часу і забезпечувати більш високу його якість. Поява IgA могла бути зумовлена специфікою умов стимулювання антитілогенезу в слизових оболонках порожнин, що сполучаються із зовнішнім середовищем. Їх призначення, головним чином, створення місцевого імунітету і регуляція видового складу мікрофлори кишок та верхніх дихальних шляхів. У ембріона людини клітини, що містять рецептори IgM, IgG та IgA з’являються на 14-15 тижні. В сироватці плода IgM не виявляються. Як правило, основна маса синтезованих антитіл належить до класу G. В ряді випадків це співвідношення порушується. Нерідко при цирозі печінки різко підвищується рівень IgA. При макроглобулінемії вміст IgM може дорівнювати та навіть переважати вміст IgG. Специфіка фізико-хімічних і біологічних властивостей імуноглобулінів, що належать до різних класів, підвищує спеціалізацію та надійність функціонування систем гуморального адаптивного імунітету. Вивчення динаміки утворення та функції антитіл окремих класів сприяє розкриттю механізмів формування інфекційного процесу, протипухлинного імунітету та алергічної реактивності.
Імуноглобуліни класу М Система IgM найбільш рання як у філогенетичному, так і в онтогенетичному відношенні. У плода і новонародженого синтезуються в основному IgM. Імунна відповідь на введення багатьох антигенів починається з вироблення IgM, а до деяких антигенів утворюються переважно антитіла класу IgM. Основним джерелом IgM у мишей, а, можливо, і у всіх ссавців, є селезінка. Синтез IgM у кроликів у значній мірі пов’язаний з функцією червоподібного відростка. Клітини, що виробляють IgM, можуть у відповідь на одні антигени синтезувати цей клас імуноглобулінів постійно, а у відповідь на інші – через деякий час припиняють їх продукцію або переключаються на синтез IgG. Від вмісту IgM значною мірою залежить бактерицидна активність людської сироватки. У жінок у віці 20-50 років вміст IgM в сироватці крові вищий, ніж у чоловіків, відповідно вища і бактерицидна здатність сироватки крові. В процесі гіперімунізації бактерицидна активність сироватки крові знижується. Однак IgM володіють високою аглютинуючою та бактерицидною активністю не до усіх мікробів. Антитіла IgG проти коклюшної палички в 1,5-125 разів активніші, ніж IgM в реакції аглютинації і в 100 разів – за бактерицидною та протективною дією. IgM володіють вираженими гемолітичними властивостями. Для утворення отвору в клітинній мембрані еритроциту при імунному лізисі необхідно 2-3 молекули IgM, а молекул IgG – 2-3 тисячі (табл 5). Молекула IgM включає п’ять субодиниць, з’єднаних дисульфідними зв’язками між важкими ланцюгами. Кожна з цих субодиниць має молекулярну масу 180 000. Якщо часточок антигена мало, то усі п’ять ніжок антитіла, вигинаючись, прикріплюються до однієї часточки антигена, і молекула набуває форми круглого столу або форму павука з п’ятьма гнучкими ніжками. Таблиця 5 Фізико-хімічні та біологічні властивості імуноглобулінів різних класів
Примітка: + - наявність ознаки; - - відсутність ознаки;? – немає даних.
Імуноглобуліни класу G IgG є основним класом антитіл і складають біля 70% усіх імуноглобулінів. Основна маса антитоксинів і протимікробних антитіл належить до IgG. Значна кількість IgG синтезується у відповідь на вторинний антигенний стимул. У процесі реалізації імунної відповіді відбувається переключення синтезу IgM на IgG. IgG термостабільні. Вони витримують нагрівання при температурі 750 протягом 30 хвилин, тоді як IgM при цьому повністю руйнуються. IgG здатні нейтралізувати віруси, бактерії, токсини, здійснюють опсонізуючу дію на бактерії, викликають реакцію аглютинації, зв’язування комплементу та преципітації in vitro. Нейтралізуюча здатність IgG, що утворюються на пізніх стадіях імунної відповіді, по відношенню до токсинів у сотні разів вища, ніж нейтралізуюча здатність IgM. Важливою особливістю IgG є їх більш висока, порівняно з IgM, активність по відношенню до гаптенів. IgG – єдиний імуноглобулін, який проходить через плаценту, він може викликати у новонародженого пасивну шкірну анафілаксію. Антитіла, що переходять від матері через плаценту, мають вагоме значення для захисту організму дитини від деяких мікробів та їх токсинів: дифтерії, поліомієліту, правцю, кору. Знаходячись в агрегованому стані внаслідок з’єднання зі специфічними антитілами або неспецифічних впливів, IgG фіксує комплемент. В процесі агрегації в молекулі IgG відбуваються конформаційні зміни, в результаті чого комплементозв’язуючий центр молекули стає доступним для рецепторних груп комплементу або збільшується його спорідненість з цими рецепторними групами (табл. 5). Серед IgG виявлено 4 підкласи, що відрізняються за структурою важких ланцюгів: a, b, c, d, (G1, G2, G3, G4). Підкласи мають різні біологічні властивості. IgG1 складає 70-77%, G2 – 23%, G3 – 8-9%, G4 – 2-3% від загальної кількості. IgG1, IgG2, IgG3 відрізняються між собою за будовою 4-7 пептидів в первинній структурі молекули, а IgG4 – за 13-18 пептидами. G1 та G3 за опсонізуючим впливом у 100 разів ефективніші, ніж G2 і G4. Ступінь спорідненості підкласів IgG до комплемента зменшується в послідовності G3>G1>G2>G4. IgG в надлишковій кількості блокують макрофаги і стимулюють Т-лімфоцити-супресори. Ці властивості IgG появляються як при гуморальному, так і клітинному імунітеті, а також при алергії та розвитку пухлин. Опромінення мишей летальними дозами значно прискорює розпад IgG і не впливає на розпад IgM та IgA. Звідси випливає, що механізми процесів катаболізму імуноглобулінів класу G, М та А різні. Синтез IgM у неімунізованих та нормальних тварин за часом співпадає, а синтез IgG у неімунізованих тварин відстає. Отже, стимуляція лімфоїдної тканини мікробними антигенами є важливою умовою синтезу IgG. В організмі на один і той же антиген одночасно синтезуються антитіла різних класів. Однак, можливий також вибірковий синтез антитіл, що належать до певного типу або підкласу поліпептидних ланцюгів. Антитіла людини проти тейхоєвої кислоти належать до підкласу IgG2, антитіла до фактора VIII згортання крові – до IgG4, до дифтерійного та правцевого токсину – до IgG1, а холодові аглютиніни в основному містять капа-ланцюги. Антитіла проти Rh-антигена переважно належать до підкласу IgG1. Імуноглобуліни класу А За структурою розрізняють три типи імуноглобулінів класу А: 1) Сироваткові IgA, мають мономерну структуру молекули і складають 86% IgA, що містяться у сироватці. 2) Сироваткові димерні IgA, в складі молекул яких є ще додатковий J-ланцюг, за допомогою якого два мономери з’єднуються між собою. 3) Секреторні IgA, молекули яких складаються із декількох, частіше двох, мономерних молекул IgA, з’єднаних між собою за допомогою J-ланцюга і секреторного фрагмента (S-фрагмент). Структура секреторного IgA наступна. Дві молекули мономерного IgA повернені одна до одної СООН-фрагментами і з’єднані між собою за допомогою вставленого між ними J-ланцюга. S-фрагмент обвиває кінцеві ділянки ланцюгів Fc-фрагментів, переходячи з однієї молекули на другу (рис. 3). Секреторний IgA складає близько 1% усіх сироваткових IgA, але складає основну масу імуноглобулінів, що виділяються на поверхню слизових оболонок і містяться в слині, кишковому соку та інших секретах.
Рис. 3. Структура молекули секреторного IgA. L – легкі ланцюги; H – важкі ланцюги; -S- - дисульфідні зв’язки; J – J-ланцюг; Sc – секреторний фрагмент.
Молекулярні формули мономерного, димерного сироваткового і димерного секреторного IgA відповідно такі: IgA, (IgA)2+J, (IgA)2+J+S. Молекулу IgA, як і молекули імуноглобулінів інших класів, а також J-ланцюг виробляють плазмоцити, а S-компонент – епітеліальні клітини слизових оболонок, потім він приєднується до димерної молекули в момент проходження її через епітелій. ММ димера 380 000, S-компонент представляє собою глікопротеїд з ММ 58 000. ММ білкового J-ланцюга 23 000 – 26 000. Він приєднаний до важкого ланцюга за допомогою дисульфідних зв’язків. S-фрагмент стабілізує конформацію молекули і захищає її від руйнування протеолітичними ферментами слини та кишок. Сироватковий мономер IgA синтезують плазмоцити кісткового мозку, лімфатичних вузлів та селезінки, димерний сироватковий IgA – плазмоцити секреторних залоз, а секреторний IgA – плазмоцити слизових оболонок верхніх дихальних шляхів, статевого апарату та кишок. Діти народжуються без IgA, оскільки цей імуноглобулін, як і IgM, не проходить через плаценту. Завдяки цій обставині несумісність матері та плоду за еритроцитарними антигенами зустрічається рідше. Якби через плаценту проходили не лише IgG, але й материнські еритроцитарні IgA та IgM, то імунологічна несумісність матері та плоду зустрічалася б частіше і протікала більш важко, оскільки IgM і IgA мають більшу гемолітичну активність. Серед IgA виділяють два підкласи – IgA1 i IgA2. В молекулі IgA немає дисульфідних зв’язків між H- та L-ланцюгами, але він є між L-ланцюгами (рис. 4).
 
Афінність IgA вища, ніж IgG, що містяться у ті же сироватці. IgA складають близько 15-20% усіх сироваткових імуноглобулінів. Нестача IgA зустрічається у однієї з 500-700 здорових людей. У хворих з дефіцитом IgA при нормальному рівні IgG i IgM в сироватці крові часто виявляються антитіла до IgA, а також до колагену. Є спостереження про взаємозв’язок дефіциту IgA зі схильністю до аутоімунних захворювань. В осіб зі зниженою кількістю IgA часто спостерігається катар верхніх дихальних шляхів. При ревматоїдному артриті та мієломах вміст IgA підвищений. Вміст IgA в сироватці крові годувальниць підвищується у 5 разів. У гнотобіонтів сироваткові IgA відсутні, в той час як секреторні синтезуються. 4.1. Секреторний IgA. Секреторні IgA виявляються у шматочках слизової оболонки слинних залоз, носа, рота, піхви, прямої кишки, канальців нирок, сечового міхура як у здорових, так і у хворих різними захворюваннями. Продукція секреторних IgA регулюється незалежно від сироваткових IgА. Дослідження показали, що основним імуноглобуліном секретів є секреторний IgA, що утворюється при місцевій імунізації, хоча в секретах містяться й імуноглобуліни інших класів. Співвідношення IgA та імуноглобулінів інших класів в секретах складає 3:1 – 5:1, але воно може коливатися в значних межах. Секреторні IgA мають антивірусну активність за відсутності комплементу і служать першим антивірусним бар’єром. Віруснейтралізуюча здатність IgA на слизовій оболонці може проявлятися при відсутності антитіл проти вірусів у сироватці крові. Локальна резистентність до зараження вірусом поліомієліту створюється окремо лише на слизовій оболонці кишок або носовій частині глотки. Таким чином, важливою особливістю секреторної системи IgA є її незалежність від IgA сироваткової системи. Резистентність до респіраторних вірусів залежить від титру секреторних антитіл, що утворюються локально у тій області, через яку збудник проникає в організм, і практично не залежить від титрів сироваткових антитіл. Більш надійно захищені від експериментального зараження вірусом грипу ті особи, у яких в нормі в секреті з носа містяться більш високі титри специфічних IgA. В дослідженнях ніхто з добровольців з високими титрами специфічних IgA в секреті з носа не захворів при зараженні вірусом грипу, в той час як у осіб з низькими титрами антитіл розвинулась інфекція. Нейтралізуюча активність секрету не залежала від титрів сироваткових антитіл. Прийнято вважати, що при грипі існує пряма залежність між стійкістю до зараження і титрами антитіл в сироватці крові. Однак, якщо аналізувати захворюваність в епідемічний період, така залежність не спостерігається. Ступінь захищеності слизових оболонок верхніх дихальних шляхів корелює з титрами антитіл, що утворюються місцево. Резистентність слизових оболонок до патогенних мікробів значною мірою залежить як від вихідного рівня специфічних секреторних антитіл в секреті з носа, так і від їх рівня, досягнутого в результаті імунізації або інфекції. Вплив секреторних IgA на мікроорганізми. Біологічна доцільність місцевого імунітету, очевидно, полягає саме в тому, щоб створити швидкий захист від нових штамів, що з’являються на слизовій оболонці. В зв’язку з цим великий інтерес представляє механізм відносно швидкої елімінації клонів імунокомпетентних клітин, який створює можливість адаптації до нових штамів. Секреторна система імуноглобулінів класу А є захистом проти респіраторних інфекцій, респіраторних алергій, аутоімунних захворювань та новоутворень. Вона впливає на процеси адсорбції мікробних клітин, чим протидіє проникненню патогенних мікробів у тканини. Вона захищає як Т-, так і В-систему імунокомпетентних клітин від гіперстимуляції антигенами мікробів, які за відсутності IgA більш інтенсивно стимулюють утворення IgE, що викликають алергічні захворювання. Дослідження секреторних імуноглобулінів у хворих може сприяти встановленню діагнозу. Секреторні IgA з молозива можна застосовувати з лікувальною метою. Імуноглобуліни класу Е Початком вивчення IgE були класичні досліди по перенесенню негайної гіперчутливості введенням сироватки крові хворих атопічними захворюваннями здоровим реципієнтам, що дозволило більш надійно виявити антиген, який сенсибілізував організм. Цей метод протягом багатьох років застосовується як діагностичний тест при полінозах. Здоровому реципієнту внутрішкірно вводять сироватку хворого, а через добу в цю ж ділянку вводять алерген. В позитивних випадках з’являються негайні шкірні реакції, зумовлені наявністю в сироватці антитіл, які отримали назву реагінів. За деякими властивостями з реагінами схожі блокуючіантитіла, які утворюються в сироватці крові хворих, лікованих парентеральними ін’єкціями пилкових алергенів. Ці антитіла, на відміну від реагінів, не викликають сенсибілізації шкіри до гомологічного алергену. Блокуючі антитіла термостабільні, проходять через плаценту, не фіксують комплемент, не утворюють преципітатів з алергеном, однак нейтралізують його активність (табл. 5 ), що виявляється при внутрішкірному введенні блокуючих антитіл в суміші з гомологічним алергеном. На відміну від реагінів, блокуючі антитіла не фіксуються клітинами тканин. Ці відмінності залежать від шляхів проникнення та доз алергенів, що поступають в організм природним шляхом. При десенсибілізуючому лікуванні утворюються блокуючі антитіла, а не реагіни. Синтезуються IgE в основному в лімфоїдній тканині легенів та травного каналу. За фізико-хімічними властивостями IgE є глікопротеїдом з ММ 200 000. Рівень IgE у здорових людей коливається в значних межах – від повної відсутності до значного підвищення проти середніх показників. Концентрація IgE підвищується до періоду статевої зрілості, а потім поступово знижується. В сироватці здорової людини міститься 0,0002 г/л IgE. Підвищення рівня IgE в сироватці крові спостерігається при бронхіальній астмі, екземі, контактному дерматиті, полінозах, а також в сироватці хворих в початковий період десенсибілізуючої терапії. Клітини, що синтезують IgE, у приматів містяться в найбільшій кількості в лімфоїдній тканині травного та дихального апарату: в піднебінних мигдалинах, аденоїдах, лімфатичних вузлах грудної та черевної порожнини, в слизовій оболонці носа, стравоходу та бронхів. Їх відносно мало в селезінці та підшкірних накопиченнях лімфоїдних клітин. Кількість клітин, що синтезують IgE, збільшується після рецидивів інфекційного процесу. Для атопічних захворювань характерне підвищення IgE при низькому вмісті IgA.
Імуноглобуліни класу D Концентрація IgD в сироватці крові непостійна, але зазвичай не перевищує 1%. ММ IgD складає 180 000 – 200 000. Молекула IgD, як і молекули імуноглобулінів інших класів, складається зі зв’язаних дисульфідними містками двох легких та двох важких поліпептидних ланцюгів. IgD не фіксує комплемент (табл. 5). Рівень IgD підвищується при мієломних хворобах, хронічних запальних процесах. Швидкість синтезу IgD при мієломній хворобі може підвищуватися в сотні разів. Кількість IgD на поверхні лімфоцитів у піднебінних мигдалинах в дітей значно більша, ніж на поверхні лімфоцитів крові. Серед IgD виявляються аутоантитіла проти тканини щитовидної залози та антинуклеарні антитіла, з чого випливає, що вони можуть мати відношення до розвитку аутоімунних захворювань. IgD з’являються в онтогенезі значно пізніше, ніж інші імуноглобуліни. Це стало приводом для припущень про те, що IgD лімфоїдних клітин перешкоджають виникненню толерантності. IgD не виявляють у 10% здорових людей, в той же час у окремих індивідів вміст IgD може сягати 0,4 г/л при нормі 0,2 г/л.
Питання для самоконтролю 1. Біологічна доцільність поділу імуноглобулінів на класи і підкласи. 2. Спеціалізація різних класів імуноглобулінів. 3. Будова молекул, біологічні властивості імуноглобулінів класу М. 4. Будова молекул, біологічні властивості імуноглобулінів класу G. 5. Будова молекул, біологічні властивості імуноглобулінів класу А. 6. Характеристика підкласів та типів імуноглобулінів класу А. 7. Характеристика секреторної системи імуноглобулінів класу А. 8. Будова молекул, біологічні властивості імуноглобулінів класу Е. 9. Будова молекул, біологічні властивості імуноглобулінів класу D.
РЕАКЦІЯ АНТИГЕН-АНТИТІЛО
Феномени та сили взаємодії Імунний процес запускається в результаті отримання імунокомпетентною клітиною енергії від антигена. При з’єднанні з антигеном, клітина зі специфічним рецептором, отримуючи від молекули антигена енергію, переходить у збуджений стан. Додаткова енергія викликає у клітині перебудови, що передаються її нащадкам, які і синтезують імуноглобуліни з певною електронною конфігурацією, що забезпечує їх здатність специфічно взаємодіяти з детермінантами антигена. Цей процес базується на поглинанні і виділенні електромагнітного випромінювання специфічних частот. Лише молекули антигена і антитіл, що відрізняються за енергією зовнішніх орбіт їх електронів, можуть взаємодіяти специфічно. При реакції антиген-антитіло відбувається аглютинація, преципітація, лізис і опсонізація антигена. Остання сприяє фагоцитозу його часточок, а також фіксації комплемента сироватки крові комплексом антиген-антитіло. Антитіла, покриваючи чужорідні часточки, утворюють на їх поверхні шар білка товщиною до 3 нм, який ізолює часточку і ніби мітить її для процесів фагоцитозу. Відповідно кожному із згаданих феноменів, за проявами яких in vitro виявляються антитіла в сироватці, їх називають аглютинінами, лізинами, преципітинами, опсонінами і комплементозв’язуючими. Взаємодія антитіл з рецептором клітини служить подразником, що активує певну її функцію: звільнення біологічно активних речовин або фагоцитоз з’єднаного з антитілом антигена. Антиген і антитіло реагують як цілі молекули; кулеподібна форма молекул антигенів і з’єднаних з ними антитіл зберігається. Після з’єднання антигенів і антитіл в їх молекулах не відбувається глибока перебудова структури, така як виділення ферментів, деградація або денатурація молекул. Не змінюється також і їх серологічна специфічність. Зміни, які все ж відбуваються, зворотні, як зворотний і сам зв’язок, а виділені з комплексу антиген-антитіло як антигени, так і антитіла не відрізняються від нативних за здатністю реагувати з відповідними компонентами і in vitro індукувати імунологічні реакції. Взаємодія антиген-антитіло відбувається у дві фази. У першій фазі двовалентні молекули антитіл та полівалентні молекули антигенів об’єднуються в імунні комплекси епітопом антигена і паратопом антитіла, що є висококомплементарними за структурою та зарядом. У рідкісних випадках, коли структура епітопів різних антигенів близька, взаємодія антиген-антитіло має неспецифічний характер. На першому етапі взаємодії основними зв’язуючими силами є кулонівські, а після зближення епітопа та паратопа на відстань меншу 1 нм вирішальну роль у формуванні комплексу відіграють Ван-дер-Ваальсові сили. У другій фазі у повних антитіл відбувається неспецифічне об’єднання (за рахунок водневих, гідрофобних та інших зв’язків) імунних комплексів у видимі неозброєним оком преципітати або аглютинати. У неповних антитіл неспецифічна фаза відсутня. У зв’язку з тим, що притягання антитіл і антигенів зумовлене силами, які діють лише на дуже близькій відстані, відповідність взаємодіючих поверхонь антигена і антитіла повинна бути достатньо точною і досягається розміщенням амінокислот в момент їх синтезу. Всі вищеперераховані сили є слабкими, але при комбінації їх дії, вони забезпечують досить міцний зв’язок і втримують агрегат. Зв’язок між антигеном і антитілами, незважаючи на значну міцність, оборотний. Дисоціацію комплексу антиген-антитіло на складові частини можна отримати руйнуванням однієї його частини за допомогою ферментів або просто розчиненням зв’язаного антигену. Так, при розчиненні нейтральної суміші токсин-антитоксин ізотонічним розчином натрію хлориду у 100 разів отримана рідина набуває токсичних властивостей. Комплекс токсин-антитоксин може дисоціювати в організмі, що призводить до інтоксикації. Дисоціацію комплексу антиген-антитіло можна підсилити шляхом впливу речовинами і факторами, які сприяють розриву нековалентних зв’язків: підвищенням температури, додаванням солей, амідів, кислот, лугів, а також надлишком повного антигену або гаптену. Ці методи застосовують для отримання очищених антитіл. Сформовані макроагрегати представляють собою сітку, що складається з часточок антигенів і антитіл. У залежності від співвідношення цих часточок сітка може бути густою або рідкою (рис.5).
Рис. 5. Схема взаємодії антитіла з антигеном. а – повне взаємне насичення усіх валентностей антигенів і антитіл; b – будова комплексу антиген-антитіло при надлишковому вмісті антитіл; c – будова комплексу антиген-антитіло при надлишковому вмісті антигена; d – великий надлишок антигенів.
Молекули антитіл і більшості антигенів об’ємні, у зв’язку з чим висловлюють припущення, що їх комплементарні структури мають багато точок взаємного зв’язку. Оскільки антигени полівалентні, а антитіла двовалентні, вони можуть реагувати, знаходячись в суміші у будь-яких співвідношеннях. Реакція протікає найбільш інтенсивно при еквівалентному співвідношенні в розчині часточок антигенів і антитіл. Антигени і антитіла утворюють конгломерати, що випадають в осад при еквівалентному їх співвідношенні, коли всі їх валентності насичені і утворюють сітку. Зв’язки, які виникають при надлишку як антигенів, так і антитіл, не забезпечують формування крупних агрегатів, що випадають в осад (рис. 5). Неповні антитіла, що мають лише одну валентність, макроагрегатів не утворюють. З’єднання антигена з антитілом проявляється in vivo та in vitro в залежності від таких фізико-хімічних властивостей антигена, як розміри часточок, фізичний стан, кількість валентностей, а також від класу і виду антитіл – повні, неповні та умов досліду – консистенція середовища, рН, концентрація солей, температура. Для того, щоб розчинні антигени, наділені середньою молекулярною масою, могли осаджуватися імунними сироватками, їх молекула повинна мати мінімум 5-15 детермінант. Але кількість детермінант може бути й іншою, в залежності від структури антигенних молекул і типу хімічної детермінанти. Розміри гаптенів і антигенів впливають на інтенсивність реакції зі специфічною імунною сироваткою. Ландштейнер показав, що анілінові похідні янтарної, адинілової і пробкової кислот, що мають відповідно малі, середні та великі розміри, при взаємодії зі специфічною сироваткою, дають реакції відповідно слабкого, середнього і високого ступеню інтенсивності. При з’єднанні антигенів та антитіл в рідкому середовищі утворені комплекси та їх прояви будуть різними в залежності від властивостей і якостей реагуючих компонентів. Повні антитіла і повні антигени, з’єднуючись, утворюють крупні агрегати, які здатні випадати в осад (рис. 6).
Рис. 6. З’єднання антигенів з антитілами. 1 – високомолекулярний носій; 2 – детермінантні групи; 3 – антитіло; 4 – специфічні рецептори. А – повні антигени; В – повні антитіла; С – макроагрегат. Утворений макроагрегат випадає в осад.
Неповні антитіла виявляються в пробі Кумбса або методом флуоресценції (рис. 7).
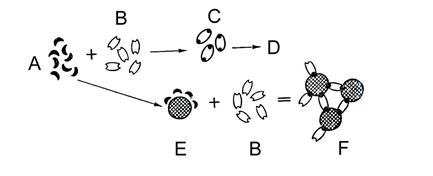
Рис. 7. З’єднання повних антигенів з неповними (блокуючими) антитілами. А – повний антиген; В – неповне антитіло; С – макроагрегат не утворюється; D – антиглобулінове антитіло; E – флуоресцентне антиглобулінове антитіло; F – макроагрегат (тест Кумбса позитивний); G – антиген, що став флуоресцентним. Макроагрегат не утворюється, але антитіла можна виявити за допомогою методу Кумбса. Неповні антигени блокують повні антитіла і не викликають утворення макроагрегатів, але можуть їх утворювати, адсорбуючись на макромолекулярних носіях (рис. 8).
Рис. 8. З’єднання неповних антигенів з повними антитілами. A – неповний антиген; B – повне антитіло; C-D – макроагрегат не утворюється. Більше не можуть з’єднуватися з повними антигенами; Е – адсорбуються або фіксуються на повному носії; F – макроагрегат. В поєднанні з носієм неповний антиген можна виявити в реакціях аглютинації, преципітації і зв’язування комплементу.
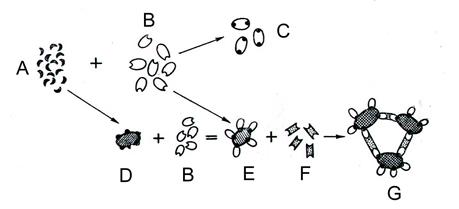
При адсорбції гаптенів на еритроцитах з наступною інкубацією їх в сироватці зі специфічними до гаптенів неповними антитілами і додаванням антиглобулінової сироватки, неповні антитіла виявляються за реакціями гемаглютинації (рис. 9).
Рис. 9. З’єднання неповних антигенів з неповними антитілами. A – неповний антиген; B – неповне анитіло; C – не утворюється макроагрегат; D – адсорбований або фіксований носієм; E – приєднання неповних антитіл до адсорбованих носієм антигенів; F – антиглобулінова сироватка; G – макроагрегат. Після з’єднання з носієм неповний антиген можна виявити з використанням як повних, так і неповних антитіл. Для реакції антиген-антитіло оптимальні рН 6,4 - 8,6; іонна сила 0,5 - 0,1; температура +37°С. За таким же типом антигени взаємодіють із антигенрозпізнаючими рецепторами Т- і В-лімфоцитів.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 587; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.123.41 (0.012 с.) |