Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Белки. Их функции в организме:белки как лекарственные вещества.Стр 1 из 14Следующая ⇒
Белки.Их функции в организме:белки как лекарственные вещества. Белками называются высо-комолекулярные природные соединения, построенные из a-аминокислот. Функции: каталитическая..В живых организмах каталитическими свойствами обладают только белки. Опорную и защитную функцию, составляя основное вещество хрящей, костей и кожи. Кроме того, белки являют-ся существенными составными частями всех клеточных и внутриклеточных структур, т.е. несут структурную функцию.
Белок (актомиозин) мышц обеспечивает в организме сократительную функцию
Растворимые белки поддерживают в организме коллоидно-осмотическое давление и кислотно-щелочное равновесие.
В виде антител белки являются специфическими защитными веществами против патогенных (болезнетворных) организмов и их продуктов. Белки выполняют транспортную функцию(к примеру, гемоглобин транспорти-рует газы крови). белки в виде гормонов участвуют в регуляции функций организма. В лечебной практике в используются продукты неполного гидролиза белков и свободные аминокислоты.Так, гид-ролизаты белков вводят в кровоток при заболеваниях, сопровождающихся по-терями белка. Аминокислоту метионин используют при заболеваниях печени, почек, при отравлениях тяжелыми металлами, а глутаминовую кислоту – при заболеваниях центральной нервной системы, эпилепсии и заболеваниях сер-дечно-сосудистой системы.
Химическое строение белков. . Выделяют четыре уровня структурной организации белка:первичную, вторич-ную, третичную, и четвертичную Последовательность расположения определенного числа аминокислотных остатков в полипептидной цепи белковой молекулы называется первичной структурой белка. Первичная структура белковой молекулы определяется сильными ковалентными пептидными связями, а также небольшим числом ди-сульфидных связей. Аминокислотная последовательность является специфи-ческой характеристикой данного белка, все его молекулы в этом отношении идентичны. Под вторичной структурой понимают пространственную регулярную конфигурацию полипептидной цепи в виде альфа-спирали или бета-струк-туры. Вторичная структура определяется упорядоченным расположением цепи за счет образования водородных связей между CO- и NН-группами пептидных связей данной полипептидной цепи или между цепями.
Образование таких водородных связей может обусловливать ряд конфор-маций (видоизменений) полипептида. Эти конформации подразделяются на два больших класса: спиральные структуры и структуры типа складчатого слоя.
Структура типа складчатого слоя характерна для фибриллярных белков, которые, как правило, нерастворимы в полярных растворителях Структуры типа складчатого слоя(бета-структуры) обусловлены образо-ванием водородных связей между полипептидными цепями, в отличие от спи-рали, где водородные связи имеются лишь в пределах одной и той же поли-пептидной цепи Дальнейшее усложнение структуры белка связано с пространственной упаковкой чередующихся спиральных и линейных участков полипептидной цепи в компактное тело, что получило название третичной структурой белка. третичная структура показывает, как полипептидная цепь Третичная структура определяется автоматически аминокислотной после-довательностью в полипептидной цепи и размером,формой и полярностью радикалов аминокислотных остатков.Свернутая целиком или частично в спираль,расположена в пространстве. Взаимное пространственное расположение субъединиц, связанных неко-валентными связями в единой белковой молекуле, и представляющих единое образование в структурном и функциональном отношении, называется четвер- тичной структурой белка. Крупные молекулы белков состоят, как правило, из субьединиц со сравнительно небольшим молекулярным весом.Белковые мо-лекулы, составленные из субъединиц, принято называть мультимерами (оли-гомерами), а сами субъединицы протомерами2.(гемоглобин) Формула ра стительных и животных тканях.
H2N CHCOOH
CH2 CH2-OH
Гомосерин
Аминокислоты – бесцветные кристаллические вещества, плавящиеся с разложением при высоких температурах(выше 250°С). Легко растворимы в большинстве своем в воде и не растворимы в эфире и. дрорганических рас-творителях.
Аминокислоты содержат одновременно две группы, способные к иониза-ции: карбоксильную, обладающую кислотными свойствами, и аминогруппу, обладающую основными свойствами, т.е. аминокислоты являются амфотер-ными электролитами. В сильнокислых растворах аминокислоты присутствуют в виде положительно заряженных ионов, а в щелочных растворах – в виде от-рицательных ионов.
Формула
В зависимости от значения рН среды любая аминокислота может обладать то положительным, то отрицательным зарядом.
Все получаемые из белков аминокислоты, за исключением глицина, опти-чески активны, так как они содержат в α-положении асимметрический атом углерода. Из 18 оптически деятельных белковых аминокислот10 характери-зуются правым /+/ и 8 - левым /-/ вращением плоскости поляризованного луча, но они все относятся кL-ряду. Конфигурацию L- и D-аминокислот можно представить в следующем виде:
радикалы аминокислот способны к разнообразным взаимодейст-виям. Радикалы аминокислот вступают в реакции: 1. Солеобразования. 2. Окислительио-восстановительные реакции. 3. Реакции ацилирования 4. Этерификации 5. Амидирования 6. Фосфорилирования.
5.КЛАССИФИКАФИЯ ПРОТЕИННОГЕННЫХ АМИНОКИСЛОТ.(С НЕПОЛЯРНЫМИ РАДИКАЛАМИ) этот класс входят четыре алифатические аминокислоты(аланин, валин, лейцин, изолейцин), две ароматические аминокислоты (фенилаланил, трипто-фан), одна серусодержащая аминокислота(метионин) и одна иминокислота (пролин). Общим свойством этих аминокислот является их более низкая рас-творимость в воде, по сравнению с полярными аминокислотами. R-группами (радикалами)
В этот класс входят две основные аминокислоты– лизин и аргинин и сла-боосновная аминокислота – гистидин, несущие при рН 7 суммарный положи-тельный заряд.
Общая характеристика Под биологическим окислением понимают совокупность множества разнообразных окислительно-восстановительных реакций, совершающихся в биологических объектах под влиянием ферментов.
Процессы биологического окисления являются основным источником энергии в организме. При решении вопроса, какое соединение из участников реакции является окислителем, а какое восстановителем, необходимо знать способность восстановителя отдавать электроны окислителю, что выражается величиной окислительно-восстановительного потенциала (стандартного восстановительного потенциала, редокс-потенциала). Редокс-потенциал определяется путём измере-ния электродвижущей силы (э.д.с.) в вольтах, возникающий в полуэлементе, в котором восстановитель и окислитель, присутствующие в 1,0 М концентраци-ях при 25ºC и при рН 7,0, находятся в равновесии с электродом, способным обратимо принимать электроны от восстановителя. В качестве стандарта принят редокс-потенциал реакции Н 2Н+ + 2 е¯, который при давлении газообразного водорода в 1 атмосферу (760 мм рт. ст.), при 1,0 М концентрации ионов Н+ (что соответствует рН=0) и при 25ºC условно принят за нуль. В условиях физиологического значения рН, т.е. при рН=7,0 редокс-потенциал водородного электрода (системы Н2 – 2Н+) равен -0,42 воль-та. Системы с более отрицательным редокс-потенциалом,чем в системе
Н2 2Н+ + 2 е- обладают большей, чем водород, способностью отдавать элек-троны, а у систем с более положительным редокс-потенциалом эта способ-ность менее выражена, чем у водорода. Наибольший положительный редокс-потенциал имеется в системе НO – 1/2O. Именно этим обстоятельством следует объяснить, что Н2О обладает очень слабой способностью отдавать элек-троны, тогда как молекулярный кислород характеризуется очень высоким сродством к электронам, превышающим такую у важнейших биологических акцепторов-переносчиков электронов НАД, НАДФ, ФМН, ФАД, цитохромы, участвующих в окислительно-восстановительных процессах в организме.
Величина редокс -потенциалов биологических окислительно-восстановительных систем обусловливает направление переноса электронов от системы Н – 2Н+ к системе Н О – 1/2О. Знание редокс-потенциалов различных биологических окислительно-восстановительных систем позволяет предсказывать направление потока электронов от одной системы к другой системе при ферментативном превращении веществ в процессе биологического окисления. Окисление, сопряженное с производством в организме энергии, почти во всех без исключения клетках проходит три стадии. На первой стадии имеет место окислительное образование ацетил-коэнзима А из первичных субстратов биологического окисления– глюкозы, жирных кислот, аминокислот и др. На второй стадии происходит расщепление ацетил-коэнзима А в лимоннокислом цикле. При этом в результате дегидрирования субстратов высвобождаются атомы водорода, восстанавливающие пиридинзависимые и флавинза-висимые дегидрогеназы с образованием НАД.Н2, НАДФ.Н2, ФАД.Н2. Кроме того, анаэробно путем декарбоксилирования субстратов образуется СО2. Третья стадия включает окисление НАД.Н2, НАДФ.Н2 и ФАД.Н2, т.е. пе-ренос протонов и электронов на кислород с образованием воды и энергии в дыхательной цепи, состоящей из системы окислительно-восстановительных ферментов. Следовательно, процесс биологического окисления можно представить как процесс дегидрирования с последующей передачей протонов и электронов через ряд промежуточных передатчиков на кислород с образованием воды. На первой стадии биологического окисления образование - ацетил коэнзима А происходит различными путями в зависимости от вида первичных субстратов. Например, глюкоза путем гликолиза распадается до пировино-градной кислоты, а последняя – до ацетил-коэнзима А путем последующего окислительного декарбоксилирования пировиноградной кислоты; жирные ки-слоты превращаются в ацетил-коэнзим А путем β-окисления и т..дЭти специфичные пути соответствуют II стадии катаболизма и рассматриваются в соответствующих разделах обмена веществ(обмена углеводов, обмена жиров и др.).
Вторая стадия окисления, связанная с превращением ацетил-коэнзима-А в лимоннокислом цикле, в результате которого образуется НАД.Н, НАДФ.Н и ФАД.Н2, и третья стадия окисления, включающая окисление образовавшихся в лимоннокислом цикле восстановленных пиридинпротеидов и флавопротеидов (т.е. НАД.Н2, НАДФ.Н2, ФАД.Н2) в дыхательной цепи являются унифициро-ванным общим участком биологического окисления,независимо от того, ка-ким путем и от какого первичного субстрата образовался ацетил-коэнзим.-А Эти стадии биологического окисления соответствуютIII стадии катаболизма. Это так называемые центральные пути метаболизма (амфиболические пути). 30) Механизм окислительного декарбоксилирования пировиноградной кисло-ты сложен и состоит из нескольких фаз (пяти фаз или этапов). Первая фаза указанного комплексного процесса состоит в декарбоксилировании пировино-градной кислоты при участии тиаминпирофосфата в качестве кофермента пи-руватдекарбоксилазы: формулы Образовавшийся оксиэтилтиаминпирофосфат далее распадается с отщеп-лением и одновременным окислением оксиэтильного радикала при участии фермента липоилредуктазы – ацетилтрансферазы (иное название – дигидроли-поилтрансацетилаза), несущего в качестве простетической группы остаток ли-поевой кислоты. формулы Возникший при распаде оксиэтилтиаминпирофосфата ацетильный ради-кал присоединяется сначала к липоевой кислоте с образованием ацетилгидро-липоевой кислоты (вторая фаза), а затем передается на коэнзим-А с образова-нием ацетилкоэнзима-А и дигидролипоевой кислоты(третья фаза). Далее при посредстве третьего компонента мультиэнзимного комплекса дигидролипоил-дегидрогоназы, содержащего в качестве простетической группы ФАД, дигид-ролипоевая кислота переходит в липоевую кислоту, а ФАД восстанавливается (четвертая фаза). формулы 31) Лимоннокислый цикл протекает в митохондриях клеток.Вступая в ли-моннокислый цикл, образовавшийся в результате окислительного декарбокси-лирования пировиноградной кислоты или иным путем(β-окисление жирных кислот) ацетилкоэнзим-А конденсируется со щавелево-уксусной кислотой, ко-торая всегда есть в клеточном содержимом. Образуется лимонная кислота и высвобождается коэнзим-А. формулы Дыхательная цепь ферментов Транспорт протонов и электронов от восстановленных субстратов к -ки слороду в процессе тканевого дыхания осуществляется с помощью ряда окис-лительно-восстановительных ферментных систем (редокс-систем). Различают три главных вида оксидоредуктаз – окислительно-восстановительных фермен-тов:
1) пиридинзависимые дегидрогеназы (пиридинферменты, пиридин-протеиды или ПП), коферментом которых служат НАД или НАДФ; 2) флавинзависимые дегидрогеназы (флавопротеиды или ФП), у которых простетической группой служат ФМН или ФАД; 3) цитохромы, содержащие в качестве простетической группы гем. Функция переносчиков водорода выполняется динуклеотидами(НАД) благодаря тому, что они могут существовать в окисленной и восстановленной формах. Все пиридинпротеиды являются анаэробными дегидрогеназами,т.е. они передают атомы водорода на ближайший в окислительной цепи другой фер-мент, но не на кислород. Цитохромную систему образуют несколько оксидоредуктаз,имеющих в качестве простетических групп железопорфирины. Соединяясь с белками, железопорфирины разных типов дают начало группе хромопротеидов, объединяемых под общим названием цитохромы. Каждый индивидуальный цитохром обозначается строчной латинской буквой а, в, с, и т.д. с соответствующим порядковым индексом (например: а, а3; с, с1, и т.д.), а класс цитохрома – прописной латинской буквой А, В, С и т.д. Принад-лежность цитохрома к определенному классу определяется строением просте-тической группы (железопорфирина), а окончательная индивидуальность– строением апофермента (белка).
В митохондриях клеток высших животных и растений идентифицировано пять различных цитохромов: в, с1, с, а, а3. В эндоплазматической сети обнару- жены еще цитохромы – в5 и Р450. Митохондриальная дыхательная цепь включает следующие компоненты: 1) флавопротеид (ФП), содержащий в качестве простетической группы (кофермента) ФМН; 2) кофермент Q (или убихинон); 3) железосерные белки, содержащие негеминовое железо; 4) цитохромы в, с1, с, а, а3.
46. печени и жировой ткани и в ряде др. тканей (почки, мышцы), а также в тканях высших растений происходит активный биосинтез липидов(триацилг-лицеринов, фосфолипидов и др.). Триацилглицерины, играющие роль запас-ных липидов, синтезируются в почках и печени: после фосфорилирования за счет АТФ глицерина в α-фосфоглицерин две молекулы ацил-КоА реагируют с -по следним, образуя фосфатидную кислоту, которая далее дефосфорилируется, а затем ацилируется за счет третьей молекула ацил-КоА, что приводит к образо-ванию триацилглицерина. В жировой (α-фосфоглицерин) образуется из ме-таболита гликолиза ткани, мышцах, где активность глицеро-киназы очень низкая, α-глицерофосфат фосфодиоксиацетона путем восстановления НАД-зависи-мой глицерофосфат-дегидрогеназой. Этот путь имеет место и в печени, наряду
с вышеуказанным. Наряду с синтезом триацилглицеринов в тканях происходит синтез фос-фолипидов, при этом их начальные пути совпадают.В зависимости от того, способен ли организм синтезировать холин или нет,непосредственным пред-шественником фосфолипидов может быть фосфатидная кислотаили диацилг-лицерин. Фосфатидная кислота служит главным предшественником фосфоли-пидов в организмах, способных синтезировать холин. Она реагирует с цити-динтрифосфатом (ЦТФ) с образованием цитидиндифосфатдиацилглицерина. Цитидиндифосфофатдиацилглицерин служит общим предшественником всех глицерофосфолипидов (фосфоглицеридов). Цитидиндифосфатдиацилгли-церин далее может взаимодействовать с серином,инозитом или глицерофос-фатом, образуя соответственно серинфосфатид(фосфатидилсерин), инозит-фосфолипид (фосфатидилинозит) и З-фосфатидилглицерол-1-фосфат. Серин-фосфатид декарбоксилируется в коламинфосфолипид(фосфатидилэтанола-мин), из которого в результате метилирования при участииS-аденозилметио-нина образуется холинфосфатид (фосфатидилхолин).
Формулы стр 225-227
47 В число стеринов входит холестерол. Стериды, вступая на путь распада, гидролизуются на жирную кислоту и стерол. Эта реакция катализируется холестеролэстеразой,действующей на сложные эфиры многих стеролов (а не только холестерола).
Формула стр.227
Основные звенья механизма биосинтеза стеролов в настоящее время выяснены благодаря применению метода меченых атомов. Рассмотрим основные этапы этого синтеза на примере биосинтеза хо-лестерола (холестерина), многие стадии синтеза которого стали известны бла-годаря исследованиям Блох, Линена, Поляка, Конфорта, А.Н. Климова и др.
Ферментативный синтез холестерина насчитывает более35 реакций. В синтезе холестерина можно выделить3 основные стадии: 1) образование из ацетата мевалоновой кислоты; 2) образование сквалена из мевалоновой кисло-ты и 3) циклизация сквалена в холестерин.
48. Синтез холестерина осуществляется из ацетил-КоА в качестве исходного вещества, главным образом, в печени с участием ферментов эндоплазматиче-ского ретикулума и гиалоплазмы. Две молекулы ацетата в форме ацетил-КоА конденсируются с образованием ацетоацетил-КоА.
Затем при последующей конденсации ацетоацетил-КоА с 3-й молекулой ацетил-КоА при участии гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтаза) образуется β-гидрокси-β-метилглутарил-КоА:
Далее β-гидрокси-β-метилглутарил-КоА под действием регуляторного фермента НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза) в результате восстановления одной из карбоксильных групп и отщепления HS-KoA превращается в мевалоновую кислоту:
Далее мевалоновая кислота превращается в сквален,потом вхолестерол и наконец вхолестерид.
Формулы стр 229
49.Нарушение обмена липидов
Патология липидного обмена может происходить на различных уровнях и наиболее часто выражается в нарушении всасывания жиров, перехода жира из крови в ткани, нарушении внутриклеточного обмена липидов. Это приводит к развитию гиперлипемии, кетозу, тканевым липидозам (атеросклерозу, желчно-каменной болезни и т.д.). Нарушение внутриклеточного обмена жиров чаще всего бывает в виде накопления в организме так называемых ацетоновых или кетоновых тел (кетоза): ацетоуксусной кислоты, β-гидроксимасляной кислоты и ацетона. Кетоновые тела образуются в печени в митохондриях гепатоцитов. Прежние представления о том, что кетоновые тела являются промежуточными продуктами β-окисления жирных кислот, оказались ошибочными.Кетоновые тела синтезируются из ацетил-КоА и начальные этапы этого синтеза сходны с биосинтезом холестерина.
Формулы стр 232-233
Возможный второй путь синтеза кетоновых тел, связанный с образовани-ем ацетоуксусной кислоты в результате отщепления Ко-А от ацетоацетил-КоА в реакции, катализируемой ацетоацетил-КоА-гидролазой (деацилазой), не имеет существенного значения, так как активность деацилазы низкая. Ацетон образуется, как полагают, путем спонтанного декарбоксилирования ацетоук-сусной кислоты и, по-видимому, не имеет определенного физиологического значения. Ацетоуксусной и β-гидроксимасляной кислотам в последнее время придается большое значение как энергетических источников для мышц, мозга, почек, предотвращающих чрезмерную мобилизацию жирных кислот из жиро-вых депо.
В крови здоровых людей содержание ацетоновых тел обычно не превы-шает 1 мг%. С мочой ацетоновых тел в норме выводится за сутки около 40 мг. Однако при голодании, как полном, так и при исключении из пищи только уг-леводов, и, особенно, при таком эндокринном заболевании как диабет, связан-ном с поражением β-клеток поджелудочной железы,вырабатывающих инсу-лин, развивается кетонемия и кетонурия, т.е. повышенное содержание кетоно вых тел в крови до 400 мг% (или до 10-20 ммоль/л) и в моче до 10-50-100 г за сутки.
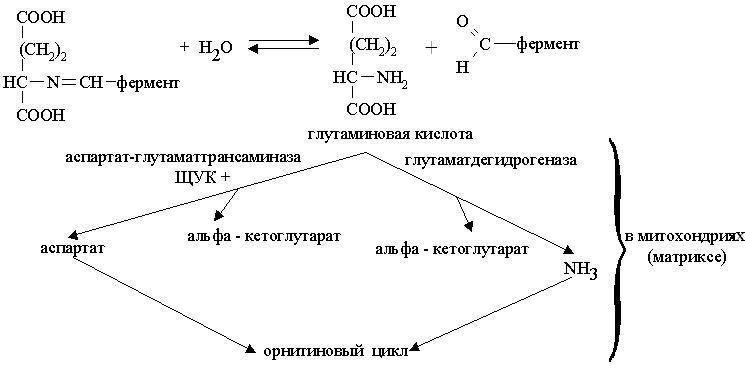
Формула Катаболизм аминокислот у млекопитающих происходит главным образом в печени и несколько слабее в почках.
Формула Формула Общий итог переаминирования различных аминокислот состоит в том, что все их аминогруппы собираются в общий фонд в виде одной аминокисло-ты, обычно в виде глутаминовой кислоты. У некоторых организмов первона-чально такой аминокислотой может быть аланин или аспарагиновая кислота, однако, в дальнейшем, происходит перенос аминогрупп с этих аминокислот на α-кетоглутаровую кислоту с образованием глутаминовой кислоты.Следова-тельно, независимо от первого этапа переаминирования,конечным акцепто-ром аминогрупп большинства аминокислот служит α-кетоглутаровая кислота, которая превращается в глутаминовую кислоту.
Реакция переаминирования многостадийна. В качестве кофермента (про-стетической группы) аминотрансфераз (трансаминаз), катализирующих эту ре-акцию, служит пиридоксальфосфат, являющийся производным витамина В6.
На первой стадии ферментативного катализа простетическая группа фер-мента взаимодействует с аминокислотой,подвергающейся переаминирова-нию. Соединение идет по аминогруппе кислоты и альдегидной группе пири-доксальфермента.
Формула
На второй стадии катализа идет таутомерная перегруппировка в образо-вавшемся комплексе:
Формула В результате последующего гидролиза происходит образование и осво-бождение кетокислоты и пиридоксальаминофермента: Формула
Далее пиридоксальаминофермент образует фермент-субстратный -ком плекс с α-кетоглутаровой кислотой:
Формула Далее происходит в комплексе таутомерное превращение:
Формула Полученное соединение гидролизуется и возникает глутаминовая кисло-
та:
Образовавшаяся глутаминовая кислота подвергается дезаминированию по вышеописанной схеме с превращением в α-кетоглутаровую кислоту и весь процесс может возобновиться снов Формула Для образования одной молекулы карбамилфосфата в этой реакции тре-буется две молекулы АТФ. Карбамилфосфат – макроэргическое соединение. Карбаминовая группировка от карбамилфосфата переносится под влияни-ем орнитинкарбамилтрансферазы на орнитин (на его d-аминогруппу), который всегда присутствует в организме. В итоге образуется цитруллин: Формула Образующийся цитруллин вступает в ферментативную реакцию конден-сации с аспарагиновой кислотой в присутствии АТФ с образованием аргини-ноянтарной кислоты. Реакция катализируется аргининосукцинатсинтетазой Формула Аргининоянтарная кислота ферментативным путем (при участии фермен-та аргининосукциназы или иначе– аргининосукцинатлиазы) расщепляется на аргинин и фумаровую кислоту: Формула Заключительной реакцией является гидролиз аргинина на орнитин и мо-чевину под влиянием фермента аргиназы:
Высвободившийся орнитин вновь вступает в реакцию с новой молекулой карбамилфосфата и все перечисленные реакции повторяются.
54)Реакция по карбоксильной группе и радикалу аминокислот. Ответ: амины проявляют свое физиологическое воздействие при весьма малых концентрациях, поэтому их образование в большой концен-трации могло бы представить угрозу для нормальной жизнедеятельности.Од-нако в животных тканях имеются активные аминоксидазы(моно- и диаминок-сидазы), которые окисляют амины в соответствующие альдегиды. Последние окисляются в жирные кислоты и распадаются далее до конечных продуктов путем β-окисления. Схематично это можно представить следующим образом: Формула
Образующиеся аммиак и перекись водорода обезвреживаются. Моноами-нооксидаза – ФАД-зависимый фермент – преимущественно локализуется в митохондриях. Этот фермент играет большую роль в организме, регулируя об-разование и распад биогенных аминов. При патологических состояниях может наблюдаться как недостаточное образование аминов, так и чрезмерная их про-дукция. В медицинской практике в этой связи применяют ингибиторы моно-аминоксидазы (ипраниазид, гармин, паргилин) в качестве лечебных средств при депрессивных состояниях, шизофрении и др., а для торможения образова-ния чрезмерных количеств биогенных аминов используют ингибиторы декар-боксилаз ароматических аминокислот. В частности, применяют α-метилдофа (альдомет), введение которого способствует снижению кровяного давления.
Второй характерной реакцией по карбоксильной группеаминокислот яв-ляется образование аминоациладенилатов при участии специфического фер-мента (аминоацил-тРНК-синтетазы) и АТФ. Значение этой реакции сущест-венно в механизме биосинтеза белка. Образование аминоациладенилата акти-вирует аминокислоту перед вступлением последней в пептидную связь при биосинтезе белка на рибосомах.
Формула С аминоациладенилатов аминокислоты передаются на транспортную РНК, образуя аминоацил-тРНК, которая уже непосредственно используется при синтезе полипептидных цепочек.
Помимо реакций по аминной и карбоксильной группе известны превра-щения аминокислот, связанные с реакциями по радикалу, т.е. по той части ее молекулы, которая не принимает участия в формировании хребта полипептид-ной цепи.
Важнейшими типами превращений аминокислот, протекающими с видо-изменением радикалов, являются окислительно-восстановительные реакции, β-декарбоксилирование, деметилирование и переметилирование, комбиниро-ванные реакции, которые ведут к переходу одних аминокислот в другие, что усиливает возможности синтеза различных аминокислот. В качестве примера окислительных реакций можно привести окисление фенилаланина в тирозин: Формула Окислительно-восстановительные процессы легко протекают по серусо-держащим радикалам цистеина и цистина,благодаря чему происходит их взаимопревращение:
Формула При полном окислении тиоловой группы цистеина последний переходит в цистеиновую кислоту, которая декарбоксилируясь переходит в таурин.
Формула Последний с желчными кислотами образует парные желчные кислоты (таурохолевую, тауродезоксихолевую), которые принимают участие в процес-се всасывания жирных кислот.
При β-декарбоксилировании аспарагиновой кислоты возникает аланин. формула
В начале из аммиака и углекислоты при участии АТФ и фермента фос-фотрансферазы – карбаматкиназы (ее также называют карбамилфосфатсинте-тазой) синтезируется карбамилфосфат. Коферментом карбамилфосфатсинтета-зы является биотин. В настоящее время считают, что аммиак поступает в орнитиновый цикл в виде свободного аммиака, образуясь в процессе окислительного дезаминиро-вания глутаминовой кислоты в митохондриях. Полагают также, что аммиак частично может поставляться глутамином, который расщепляется в печени глутаминазой с образованием свободного аммиака.Необходимым активато-ром реакции образования карбамилфосфата являетсяN-ацетилглутаминовая кислота, выступающая как кофактор ферментной системы образования карба-милфосфата:
Формула Для образования одной молекулы карбамилфосфата в этой реакции тре-буется две молекулы АТФ. Карбамилфосфат – макроэргическое соединение. Карбаминовая группировка от карбамилфосфата переносится под влияни-ем орнитинкарбамилтрансферазы на орнитин (на его d-аминогруппу), который всегда присутствует в организме. В итоге образуется цитруллин:
Формула Образующийся цитруллин вступает в ферментативную реакцию конден-сации с аспарагиновой кислотой в присутствии АТФ с образованием аргини-ноянтарной кислоты. Реакция катализируется аргининосукцинатсинтетазой:
Формула Аргининоянтарная кислота ферментативным путем (при участии фермен-та аргининосукциназы или иначе– аргининосукцинатлиазы) расщепляется на аргинин и фумаровую кислоту:
формул а Заключительной реакцией является гидролиз аргинина на орнитин и мо-чевину под влиянием фермента аргиназы:
Формула Высвободившийся орнитин вновь вступает в реакцию с новой молекулой карбамилфосфата и все перечисленные реакции повторяются. Простагландины.Гормоны ЖКТ Простагландины являются гидроксилироованными продуктами превращения в организме полиненасыщенных жирных кислот.Молекулы простагландинов включают 20 атомов углерода и циклопентановое кольцо
Формула Простагландины оказывают локальный эффект в той ткани, в которой они синтезируются и подвергаются различным ферментативным превращениям, приводящим к потере биологической активности. В частности, пр-ны, метаболизируясь, подвергаются окислению, восстановлению, гидроксилированию. Существует мнение о широком участии простагландинов в фундаментальных физиологических процессах и опосредовании ими действия самых различных биологически активных эндо- и экзогенных веществ (в том числе гормонов), а также о возможном их влиянии на развитие и течение различных патологических процессов (воспаления, боли, аллергии и т.д.). В регуляторных процессах простагландины выступают в роли медиаторов или модуляторов или регуляторов отдельных биохимических реакций
Физиологическое действие на организм простагландинов различно. Некоторые простагландины стимулируют сокращения матки,вызывают родовые схватки, прерывают беременность, ингибируют свертывание крови, подавляют желудочную секрецию и выделение соляной кислоты и пепсина, стимулируют сокращения кишечника, понижают кровяное давление, что получило применение в практической медицине. Гормоны ЖКТ. В желудочно-кишечном тракте выделяется много веществ, принимающих участие в пищеварении. Часть из них переносится кровью к тканям-мишеням и поэтому может рассматриваться как гормоны. 80)
Путем конъюгации у человека метаболизируются салицилаты, алкалоиды опия, барбитураты, амидопирин, глюкокортикоиды и другие препараты. Присоединение эндогенных соединений происходит к функциональной группе лекарственных веществ или его метаболита, что приводит к повышению его полярности и растворимости в воде и снижению липидорастворимости и токсичности. В
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 193; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.19.56.45 (0.144 с.) |

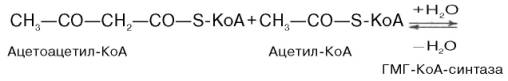



 а.
а.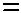
 формула
формула