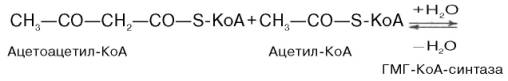Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Оксигеназное и свободнорадикальное окисление
Перенос протонов и электронов по митохондриальной дыхательной цепи на кислород, сопряженный с фосфорилированием, приводящий к образованию АТФ, который катализируется оксидазами (дегидрогеназами), не исчерпывает все реакции биологического окисления. Наряду с оксидазами в тканях содер-жатся также ферменты, катализирующие окислительные реакции, в которых атомы кислорода включаются непосредственно в молекулу субстрата. Следует иметь в виду, что наряду с антиоксидантными ферментами в организме функционирует система антиоксидантов (глутатион, аскорбат, токоферол, полифе-нолы), также ограничивающие пероксидное окисление липидов,выступая в качестве «ловушек» свободных радикалов. При срыве системы антиоксидант-ной защиты (например, при низком поступлении с пищей антиоксидантов, по-вреждении антиоксидантных ферментов при облучении и др.) свободноради-кальное окисление в тканях развивается лавинообразно. Развивается синдром пероксидации, заключающийся в повреждении клеточных мембран, ингибиро-вании многих ферментов, нарушении клеточного деления, накоплении инерт-ных (балластных) продуктов перекисной денатурации липидов и белков.В этой связи ряд антиоксидантов, таких как аскорбиновая кислота, токоферол, рутин, синтетический препарат ионол(дибунол) и др. используются как ле-чебные препараты при целом ряде патологических состояний,сопровождае-мых усилением перекисного окисления. 35) Всосавшиеся в кишечнике моносахариды (главным образом глюкоза) че-рез капилляры кишечных ворсинок попадают в кровеносную систему и с то-ком крови через воротную вену доставляются прежде всего в печень. В период всасывания концентрация глюкозы в крови брыжеечных и -во ротной вен резко возрастает, в то время как ее содержание в крови общего круга кровообращения существенно не изменяется.Это происходит потому, что печень «захватывает» почти всю глюкозу и большую часть других моно-сахаридов, всосавшихся из кишечника. Глюкоза, поступившая в клетки пече-ни, быстро подвергается реакции фосфорилирования;фосфорилированное производное глюкозы, в зависимости от существующих условий, может быть использовано для синтеза гликогена или для дальнейшего расщепления тем или иным путем. Синтезированный гликоген откладывается в печеночных клетках. Часть глюкозы, прошедшая в неизмененном виде через печень, а так-же глюкоза, образуемая в печени при расщеплении гликогена в процессе фос-форолиза, поступает в большой круг кровообращения и разносится с током крови по всему телу. Из крови все ткани черпают глюкозу, покрывая за счет ее окисления свои энергетические потребности. Небольшая часть глюкозы может откладываться в виде гликогена в мышцах.
43Липо́лиз — процесс расщепления жиров на составляющие их жирные кислоты под действием липазы. Липолиз протекает в митохондриях, куда жирные кислоты доставляются с помощью переносчика — карнитина.В процессе липолиза происходят циклические превращения молекул жирных кислот с отщеплением от них двухуглеродных производных KoA (CH3—CO—SKoA) (β-окисление жирных кислот) или одноуглеродных производных KoA (α-окисление жирных кислот); протекание одного цикла окисления жирной кислоты, сопровождается синтезом по одной молекуле ФАДН и НАДН. Фермент триглицеридлипаза расщепляет триглицериды на диглицериды и жирные кислоты, на следующей стадии активны диглицеридлипаза и моноглицеридлипаза. В результате работы этих ферментов образуются конечные продукты липолиза — глицерин и жирные кислоты. Липолиз является важнейшим энергетическим процессом в клетке, который обеспечивает синтез самого большого количества АТФ. Например, при окислении одной молекулы пальмитата (CH3(CH2)14COOH), образуется 131 молекула АТФ, две из которых используются для активации пальмитата.
Высшие жирные кислоты окисляются преимущественно путем β-окисления. т.е. путем повторяющегося дегидрирования в β-положении с образованием β-кетокислоты. В этом случае окисление предельных высших жирных кислот осуществляется ступенчато путем отщепления от их молекул двухуглеродных фрагментов. Конечным продуктом распада жирных кислот с четным числом углеродных атомов является уксусная кислота.
44 Липо́лиз — процесс расщепления жиров на составляющие их жирные кислоты под действием липазы. Липолиз протекает в митохондриях, куда жирные кислоты доставляются с помощью переносчика — карнитина. В процессе липолиза происходят циклические превращения молекул жирных кислот с отщеплением от них двухуглеродных производных KoA (CH3—CO—SKoA) (β-окисление жирных кислот) или одноуглеродных производных KoA (α-окисление жирных кислот); протекание одного цикла окисления жирной кислоты, сопровождается синтезом по одной молекуле ФАДН и НАДН.
Фермент триглицеридлипаза расщепляет триглицериды на диглицериды и жирные кислоты, на следующей стадии активны диглицеридлипаза и моноглицеридлипаза. В результате работы этих ферментов образуются конечные продукты липолиза — глицерин и жирные кислоты. Липолиз является важнейшим энергетическим процессом в клетке, который обеспечивает синтез самого большого количества АТФ. Например, при окислении одной молекулы пальмитата (CH3(CH2)14COOH), образуется 131 молекула АТФ, две из которых используются для активации пальмитата. Высшие жирные кислоты окисляются преимущественно путем β-окисления. т.е. путем повторяющегося дегидрирования в β-положении с образованием β-кетокислоты. В этом случае окисление предельных высших жирных кислот осуществляется ступенчато путем отщепления от их молекул двухуглеродных фрагментов. Конечным продуктом распада жирных кислот с нечетным числом углеродных атомов является пропионовая кислота. Окисление идет по пути β-окисления до тех пор, пока не останется трехуглеродный фрагмент – пропионил-КоА; затем идет преобразование его по метилмалониловому пути в сукцинил-КоА, который поступает в лимоннокислый цикл.
Цитидиндифосфат-диацилглицерин
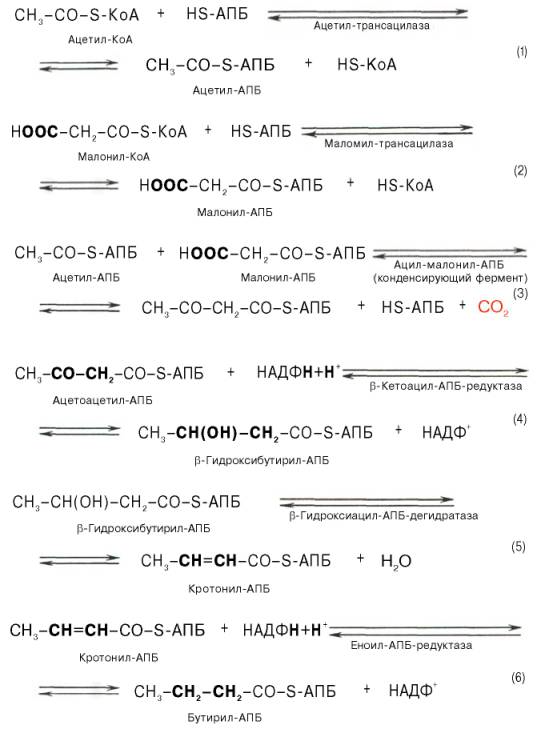
45 Первой реакцией биосинтеза жирных кислот является карбоксилирование ацетил-КоА, для чего требуются бикарбонат, АТФ, ионы марганца. Катализирует эту реакцию фермент ацетил-КоА-кар-боксилаза. Фермент содержит в качестве простетической группы биотин. Реакция протекает в два этапа: I – карбоксилирование биотина с участием АТФ и II – перенос карбоксильной группы на ацетил-КоА, в результате чего образуется малонил-КоА. Малонил-КоА представляет собой первый специфический продукт биосинтеза жирных кислот. В присутствии соответствующей ферментной системы малонил-КоА быстро превращается в жирные кислоты. Последовательность реакций, происходящих при синтезе жирных кислот Далее цикл реакций повторяется. По сравнению с β-окислением биосинтез жирных кислот имеет ряд характерных особенностей: синтез жирных кислот в основном осуществляется в цитозоле клетки, а окисление – в митохондриях; участие в процессе биосинтеза жирных кислот малонил-КоА, который образуется путем связывания СО2 (в присутствии биотин-фермента и АТФ) с ацетил-КоА; на всех этапах синтеза жирных кислот принимает участие ацилпереносящий белок (HS-АПБ); необходимость для синтеза жирных кислот кофермента НАДФН.
46. печени и жировой ткани и в ряде др. тканей (почки, мышцы), а также в тканях высших растений происходит активный биосинтез липидов(триацилг-лицеринов, фосфолипидов и др.). Триацилглицерины, играющие роль запас-ных липидов, синтезируются в почках и печени: после фосфорилирования за счет АТФ глицерина в α-фосфоглицерин две молекулы ацил-КоА реагируют с -по следним, образуя фосфатидную кислоту, которая далее дефосфорилируется, а затем ацилируется за счет третьей молекула ацил-КоА, что приводит к образо-ванию триацилглицерина. В жировой (α-фосфоглицерин) образуется из ме-таболита гликолиза ткани, мышцах, где активность глицеро-киназы очень низкая, α-глицерофосфат фосфодиоксиацетона путем восстановления НАД-зависи-мой глицерофосфат-дегидрогеназой. Этот путь имеет место и в печени, наряду
с вышеуказанным. Наряду с синтезом триацилглицеринов в тканях происходит синтез фос-фолипидов, при этом их начальные пути совпадают.В зависимости от того, способен ли организм синтезировать холин или нет,непосредственным пред-шественником фосфолипидов может быть фосфатидная кислотаили диацилг-лицерин. Фосфатидная кислота служит главным предшественником фосфоли-пидов в организмах, способных синтезировать холин. Она реагирует с цити-динтрифосфатом (ЦТФ) с образованием цитидиндифосфатдиацилглицерина. Цитидиндифосфофатдиацилглицерин служит общим предшественником всех глицерофосфолипидов (фосфоглицеридов). Цитидиндифосфатдиацилгли-церин далее может взаимодействовать с серином,инозитом или глицерофос-фатом, образуя соответственно серинфосфатид(фосфатидилсерин), инозит-фосфолипид (фосфатидилинозит) и З-фосфатидилглицерол-1-фосфат. Серин-фосфатид декарбоксилируется в коламинфосфолипид(фосфатидилэтанола-мин), из которого в результате метилирования при участииS-аденозилметио-нина образуется холинфосфатид (фосфатидилхолин).
Формулы стр 225-227
47 В число стеринов входит холестерол. Стериды, вступая на путь распада, гидролизуются на жирную кислоту и стерол. Эта реакция катализируется холестеролэстеразой,действующей на сложные эфиры многих стеролов (а не только холестерола).
Формула стр.227
Основные звенья механизма биосинтеза стеролов в настоящее время выяснены благодаря применению метода меченых атомов. Рассмотрим основные этапы этого синтеза на примере биосинтеза хо-лестерола (холестерина), многие стадии синтеза которого стали известны бла-годаря исследованиям Блох, Линена, Поляка, Конфорта, А.Н. Климова и др.
Ферментативный синтез холестерина насчитывает более35 реакций. В синтезе холестерина можно выделить3 основные стадии: 1) образование из ацетата мевалоновой кислоты; 2) образование сквалена из мевалоновой кисло-ты и 3) циклизация сквалена в холестерин.
48. Синтез холестерина осуществляется из ацетил-КоА в качестве исходного вещества, главным образом, в печени с участием ферментов эндоплазматиче-ского ретикулума и гиалоплазмы. Две молекулы ацетата в форме ацетил-КоА конденсируются с образованием ацетоацетил-КоА.
Затем при последующей конденсации ацетоацетил-КоА с 3-й молекулой ацетил-КоА при участии гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтаза) образуется β-гидрокси-β-метилглутарил-КоА:
Далее β-гидрокси-β-метилглутарил-КоА под действием регуляторного фермента НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза) в результате восстановления одной из карбоксильных групп и отщепления HS-KoA превращается в мевалоновую кислоту:
Далее мевалоновая кислота превращается в сквален,потом вхолестерол и наконец вхолестерид.
Формулы стр 229
49.Нарушение обмена липидов
Патология липидного обмена может происходить на различных уровнях и наиболее часто выражается в нарушении всасывания жиров, перехода жира из крови в ткани, нарушении внутриклеточного обмена липидов. Это приводит к развитию гиперлипемии, кетозу, тканевым липидозам (атеросклерозу, желчно-каменной болезни и т.д.). Нарушение внутриклеточного обмена жиров чаще всего бывает в виде накопления в организме так называемых ацетоновых или кетоновых тел (кетоза): ацетоуксусной кислоты, β-гидроксимасляной кислоты и ацетона. Кетоновые тела образуются в печени в митохондриях гепатоцитов. Прежние представления о том, что кетоновые тела являются промежуточными продуктами β-окисления жирных кислот, оказались ошибочными.Кетоновые тела синтезируются из ацетил-КоА и начальные этапы этого синтеза сходны с биосинтезом холестерина.
Формулы стр 232-233
Возможный второй путь синтеза кетоновых тел, связанный с образовани-ем ацетоуксусной кислоты в результате отщепления Ко-А от ацетоацетил-КоА в реакции, катализируемой ацетоацетил-КоА-гидролазой (деацилазой), не имеет существенного значения, так как активность деацилазы низкая. Ацетон образуется, как полагают, путем спонтанного декарбоксилирования ацетоук-сусной кислоты и, по-видимому, не имеет определенного физиологического значения. Ацетоуксусной и β-гидроксимасляной кислотам в последнее время придается большое значение как энергетических источников для мышц, мозга, почек, предотвращающих чрезмерную мобилизацию жирных кислот из жиро-вых депо.
В крови здоровых людей содержание ацетоновых тел обычно не превы-шает 1 мг%. С мочой ацетоновых тел в норме выводится за сутки около 40 мг. Однако при голодании, как полном, так и при исключении из пищи только уг-леводов, и, особенно, при таком эндокринном заболевании как диабет, связан-ном с поражением β-клеток поджелудочной железы,вырабатывающих инсу-лин, развивается кетонемия и кетонурия, т.е. повышенное содержание кетоно вых тел в крови до 400 мг% (или до 10-20 ммоль/л) и в моче до 10-50-100 г за сутки.
|
||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 253; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.141.6 (0.025 с.) |