Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
А. Особенности строения и дифференцировки эритроцитовСодержание книги
Поиск на нашем сайте
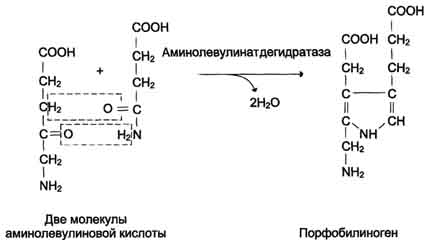
Эритроциты - единственные клетки, которые имеют только клеточную мембрану и цитоплазму. Дифференцировка стволовых клеток в специализированные происходит в клетках костного мозга и заканчивается в кровотоке. Особенности строения эритроцитов соответствуют их функциям: большая площадь поверхности обеспечивает эффективность газообмена, эластичная клеточная мембрана облегчает движение по узким капиллярам, специальная ферментативная сисгема защищает эти клетки от активных форм кислорода. Дифференцировка эритроцитов. Эритроциты, так же как и другие клетки крови, образуются из полипотентных стволовых клеток костного мозга (рис. 14-1). Размножение и превращение начальной клетки эритроидного ряда в унипотентную стимулирует ростовой фактор интерлейкин-3. Интерлейкин-3 синтезируется Т-лимфоцитами, а также клетками костного мозга. Это низкомолекулярный белок группы цитокинов - регуляторов роста и дифференцировки клеток. Дальнейшую пролиферацию и дифференцировку унипотентной клетки эритроидного ряда регулирует синтезирующийся в почках гормон эритропоэтин. Скорость образования эритропоэтина в почках зависит от парциального давления кислорода. При недостатке кислорода скорость образования гормона повышается и, соответственно, количество эритроцитов тоже увеличивается. Хроническая почечная недостаточность сопровождается снижением образования эритропоэтина в почках, что приводит к развитию анемии. В процессе дифференцировки на стадии эритробласта происходят интенсивный синтез гемоглобина, конденсация хроматина, уменьшение размера ядра и его удаление. Образующийся ретикулоцит ещё содержит глобиновуюмРНК и активно синтезирует гемоглобин. Циркулирующие в крови ретикулоциты лишаются рибосом, ЭР, митохондрий и в течение двух суток превращаются в эритроциты. Стволовая клетка превращается в эритроцит за две недели. Эритроциты не содержат ядра и поэтому не способны к самовоспроизведению и репарации возникающих в них повреждений. Эти клетки циркулируют в крови около 120 дней и потом разрушаются макрофагами в печени, селезёнке и костном мозге (см. раздел 13). Строение эритроцитов. Двояковогнутая форма эритроцитов имеет большую площадь поверхности по сравнению с клетками сферической формы такого же размера. Это облегчает газообмен между клеткой и внеклеточной средой. Кроме того, такая форма, а также особенности строения мембраны и цитоскелета обеспечивают большую пластичность эритроцитов при прохождении ими мелких капилляров. Важную роль в сохранении формы и способности к обратимой деформации эритроцитов играют липиды и белки плазматической мембраны. 90) Биосинтез гема Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени (рис. 13-2). В костном мозге гемнеобходим для синтеза гемоглобина в ретикулоцитах, в гепатоцитах - для образования цитохрома Р450. Первая реакция синтеза гема - образование 5-аминолевулиновой кислоты из глицина и сук-цинил-КоА (рис. 13-3) идёт в матриксе митохондрий, где в ЦТК образуется один из субстратов этой реакции - сукцинил-КоА. Эту реакцию катализирует пиридоксальзависимый фермент аминолевулинатсинтаза. Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму. В цитоплазме проходят промежуточные этапы синтеза гема: соединение 2 молекул 5-аминолевулиновой кислоты молекулу порфобилиногена (рис. 13-4), дезаминированиепорфобилиногена с образованием гидроксиметилбилана, ферментативное превращение гидроксиметилбилана в молекулу уропор-фобилиногена III, декарбоксилирование последнего с образованием копропорфириногена III. Гидроксиметилбилан может также нефермента-тивно превращаться в уропорфириноген I, который декарбоксилируется в копропорфирино-ген I. Из цитоплазмы копропорфириноген III опять поступает в митохондрии, где проходят заключительные реакции синтеза гема. В результате двух последовательных окислительных реакций копропорфириноген III превращается в протопорфириноген IX, а протопорфириноген IX - в Протопорфирин IX. Фермент феррохела-таза, присоединяя к протопорфирину IX двухвалентноелентное железо, превращает его в гем (рис. 13-2). Источником железа для синтеза гема служит депонирующий железо белок ферритин. Синтезированный гем, соединяясь с α и β-полипепептидными цепями глобина, образует гемоглобин. Гем регулирует синтез глобина: при снижении скорости синтеза гема синтез глобина в ретикулоцитах тормозится.
Рис. 13-2. Синтез гема. Цифрами на схеме указаны ферменты: 1 - аминолевулинатсинтаза; 2 - аминолевулинатдегидратаза; 3 - порфобилиногендезаминаза; 4 - уропорфириноген III косинтаза; 5 - уропорфириногендекарбоксилаза; 6 - копропорфи-риноген III оксидаза; 7 - протопорфириногеноксидаза; 8 - феррохелатаза. Буквами обозначены заместители в пиррольных кольцах: М - метил, В - винил, П - остатки пропионовой кислоты, А - ацетил, ПФ - пиридоксальфосфат. Донором железа служит депонирующий железо в клетках белок ферритин.
Рис. 13-3. Реакция образования 5-аминолевулиновой кислоты.
Регуляция биосинтеза гема Регуляторную реакцию синтеза гема катализирует пиридоксальзависимый фермент аминолевулинатсинтаза. Скорость реакции регулируется аллостерически и на уровне трансляции фермента. Аллостерическим ингибитором и корепрессором синтеза аминолевулинатсинтазы является гем (рис. 13-5). В ретикулоцитах синтез этого фермента на этапе трансляции регулирует железо. На участке инициации мРНК, кодирующей фермент, имеется последовательность нуклеотидов, образующая шпилечную петлю, которая называется железочувствительным элементом (от англ, iron-responsiveelement, IRE) (рис. 13-6).
Рис. 13-5. Регуляция синтеза гема и гемоглобина. Гем по принципу отрицательной обратной связи ингибирует аминолевулинатсинтазу и аминолевулинатдегидратазу и является индуктором трансляции α- и β-цепей гемоглобина. При высоких концентрациях железа в клетках оно образует комплекс с остатками цистеина регуляторного железосвязывающего белка. Взаимодействие железа с регуляторным железосвязывающим белком вызывает снижение сродства этого белка к IRE-элементу мРНК, кодирующей аминолевулинатсинтазу, и продолжение трансляции (рис. 13-6, А). При низких концентрациях железа железосвязывающий белок присоединяется к железо-чувствительному элементу, находящемуся на 5'-нетранслируемом конце мРНК, и трансляция аминолевулинатсинтазы тормозится (рис. 13-6, Б). Аминолевулинатдегидратаза также аллостерически ингибируется гемом, но так как активность этого фермента почти в 80 раз превышает активность аминолевулинатсинтазы, то это не имеет большого физиологического значения. Дефицит пиридоксальфосфата и лекарственные препараты, которые являются его структурными аналогами, снижают активность аминолевулинатсинтазы. 91) Перенос кислорода кровью Сущность дыхательной функции крови состоит в доставке кислорода от легких к тканям и углекислого газа от тканей к легким (табл. 17.4). Кровь осуществляет дыхательную функцию прежде всего благодаря наличию в ней гемоглобина. Физиологическая функция гемоглобина как переносчика кислорода основана на способности обратимо связывать кислород. Поэтому в легочных капиллярах происходит насыщение кровикислородом, а в тканевых капиллярах, где парциальное давление кислорода резко снижено, осуществляется отдача кислорода тканям. Итак, функцию переносчика кислорода в организме выполняет гемоглобин. Напомним, что молекула гемоглобина построена из 4 субъединиц (полипептидных цепей), каждая из которых связана с гемом (см. главу 2). Следовательно, молекула гемоглобина имеет 4 гема, к которым может присоединяться кислород, при этом гемоглобин переходит в оксигемо-глобин. Гемоглобин человека содержит 0,335% железа. Каждый грамм-атом железа (55,84 г) в составе гемоглобина при полном насыщении кислородомсвязывает 1 грамм-молекулу кислорода (22400 мл). Ход кривой насыщения гемоглобина кислородом или диссоциации оксигемоглобина зависит от ряда факторов. Сродство гемоглобина к кислороду в первую очередь связано с рН. Чем ниже рН, тем меньше способность гемоглобина связывать кислород и тем выше Р50. В тканевых капиллярах рН ниже (поступает большое количество СО2), в связи с чем гемоглобин легко отдает кислород. В легких СО2 выделяется, рН повышается и гемоглобинактивно присоединяет кислород. Способность гемоглобина связывать кислород зависит также от температуры. Чем выше температура (в тканях температура выше, чем в легких), тем меньше сродство гемоглобина к кислороду. Напротив, снижение температуры вызывает обратные явления. Количество гемоглобина в крови, а также в какой-то мере его способность связывать кислород (характер кривой диссоциации оксигемоглобина) несколько меняются с возрастом. Например, у новорожденных содержание гемоглобина доходит до 20–21% (вместо обычных для взрослого 13–16%). У человека имеется несколько гемоглобинов, которые образуются в различном количестве в разные стадии онтогенеза и различаются по своему сродству к кислороду. Карбгемоглобин – соединение очень нестойкое и чрезвычайно быстро диссоциирует в легочных капиллярах с отщеплением СО2 Метгемоглобин — производное гемоглобина, в котором железо окислено (трехвалентно). Метгемоглобин не способен переносить кислород. Образуется в организме при некоторых видах отравлений. Гемоглобинопатия — наследственное или врождённое изменение или нарушение структуры белка гемоглобина, обычно приводящее к клинически или лабораторно наблюдаемым изменениям в его кислород-транспортирующей функции либо в строении и функции эритроцитов. К наиболее часто встречающимся и известным гемоглобинопатиям относятся серповидно-клеточная анемия, бета-талассемия, персистенция фетального гемоглобина. Гемоглобинопатии классифицируются на качественные и количественные. 92) Транспорт железа в плазме крови и его поступление в клетки В плазме крови железо транспортирует белок трансферрин. Трансферрин - гликопротеин, который синтезируется в печени и связывает только окисленное железо (Fe3+). Поступающее в кровь железо окисляет фермент ферроксидаза, известный как медьсодержащий белок плазмы крови церулоплазмин. Одна молекула трансферрина может связать один или два иона Fe3+, но одновременно с анионом СО32- с образованием комплекса трансферрин-2 (Fe3+-CO32-). В норме трансферрин крови насыщен железом приблизительно на 33%. Трансферрин взаимодействует со специфическими мембранными рецепторами клеток. В результате этого взаимодействия в цитозоле клетки образуется комплекс Са2+-кальмодулин-ПКС, который фосфорилирует рецептор трансферри-на и вызывает образование эндосомы. АТФ-зависимый протонный насос, находящийся в мембране эндосомы, создаёт кислую среду внутри эндосомы. В кислой среде эндосомы железо освобождается из трансферрина. После этого комплекс рецептор - апотрансферрин возвращается на поверхность плазматической мембраны клетки. При нейтральном значении рН внеклеточной жидкости апотрансферрин изменяет свою конформацию, отделяется от рецептора, выходит в плазму крови и становится способным вновь связывать ионы железа и включаться в новый цикл его транспорта в клетку. Железо в клетке используется для синтеза железосодержащих белков или депонируется в белке ферригине.
Рис. 13-7. Поступление экзогенного железа в ткани. В полости кишечника железо освобождается из белков и солей органических кислот пищи. Усвоению железа способствует аскорбиновая кислота, восстанавливающая железо. В клетках слизистой оболочки кишечника избыток поступившего железа соединяется с белком апоферритином с образованием ферритина, при этом ферритин окисляет Fe2+ в Fe3+. Поступление железа из клеток слизистой оболочки кишечника в кровь сопровождается окислением железа ферментом сыворотки крови ферроксидазой. В крови Fe3+ транспортирует белок сыворотки крови трансферрин. В тканях Fe2+ используется для синтеза железосодержащих белков или депонируется в ферритине. Ферритин - олигомерный белок с молекулярной массой 500 кД. Он состоит из тяжёлых (21 кД) и лёгких (19 кД) полипептидных цепей, составляющих 24 протомера. Разный набор прогомеров в олигомере ферритина определяет образование нескольких изоформ этого белка в разных тканях. Ферритин представляет собой полую сферу, внутри которой может содержаться цо 4500 ионов трёхвалентного железа, но обычно содержится менее 3000. Тяжёлые цепи ферритина окисляют Fe2+ в Fe3+, Железо в виде гидроксидфосфата находится в центре сферы, оболочка которой образована белковой частью молекулы. Оно поступает внутрь и освобождается наружу через каналы, пронизывающие белковую оболочку апоферритина, но железо может откладываться и в белковой части молекулы ферритина. Ферритин содержится почти во всех тканях, но в наибольшем количестве в печени, селезёнке и костном мозге. Незначительная часть ферритинаэкскретируется из тканей з плазму крови. Поскольку поступление ферэитина в кровь пропорционально его содержанию в тканях, то концентрация ферритина в крови - важный диагностический показатель запасов железа в организме при железодефидитной анемии. Метаболизм железа в организме представлен на рис. 13-8.
|
||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 199; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.250.241 (0.009 с.) |