Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
III. 3. Metabolismul protidelorСодержание книги
Поиск на нашем сайте
Cele mai multe dintre protidele organismelor superioare sunt continuu biodegradate şi biosintetizate. La om şi animale, timpul de înjumătăţire biologică a albuminelor din plasmă este de 20-25 de zile, cînd jumătate din cantitatea de albumină este biodegradată şi înlocuită cu una nou sintetizată. Chiar şi proteinele intracelulare (enzimele) sunt supuse unor procese de biodegradare şi biosinteză continuă în perioade de timp de la cîteva ore la mai multe zile. De aceea, pentru un adult, necesarul de aminoacizi este de 1 g/zi/kg corp, deoarece organismul uman nu poate sintetiza decît jumătate din cei 20 de aminoacizi proteinogeni. Proteinele animale şi vegetale se asimilează diferit de către organismul uman. Proteinele laptelui, produselor lactate şi din ou se asimilează la 95%, de către organismul uman. Proteinele din pîine se asimilează numai la 62 – 86%, cele din legume – 80%, din cartofi şi boabe – 70%. Procesul tehnologic de prelucrare şi preparare a produsului alimentar influenţează asupra nivelului de asimilare a lor în organismul uman. Măcinarea, temperatura, procesele fermentative şi alte metode metode tehnologice de obţinere a produsului alimentar se manifestă diferit asupra procesului de asimilare a proteinelor din produsul dat.Prepararea tehnologiei evită distrucţia aminoacizilor. Acţiunea termică moderată asupra produsului alimentar, preponderent de origine vegetală, măreşte gradul de asimilare a proteinelor deoarece denaturarea parţială simplifică accesul la legăturile peptidice. Temperaturile ridicate diminuiază asoimilarea proteinelor.
III.3.1 Biosinteza (anabolismul) protidelor Etapa de biosinteză a protidelor (anabolismul) începe cu biosinteza aminoacizilor, urmată de biosinteza protidelor, în ordinea complexităţii lor:
aminoacizi → peptide → peptone → albumoze → proteine → proteide (holoproteide) (heteroproteide) Biosinteza aminoacizilor Biosinteza aminoacizilor se realizează în principal pe două căi metabolice: • aminare reductivă a cetoacizilor • transaminare
• Aminarea reductivă a cetoacizilor reprezintă o cale principală de biosinteză a amino-acizilor, direct din amoniac şi cetoacizii formaţi în organism prin degradarea aerobă a glucidelor (ciclul Krebs). Aminarea cetoacizilor decurge în prezenţa enzimei glutamatdehidrogenaza care are drept coenzimă NAD+ sau NADP+. Reacţia decurge cu formarea intermediară a unui iminoacid, care va fi redus enzimatic, conform reacţiei:
Se biosintetizează prin acest mecanism aminoacizii: alanina, acid aspartic, acid glutamic din cetoacizii respectivi: acid piruvic, acid oxalilacetic, acid cetoglutaric.
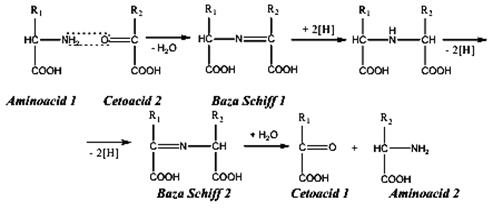
• Transaminarea
Transaminarea constă în transferul grupei amino -NH2 de la un aminoacid la un cetoacid, după un mecanism care cuprinde ca etape intermediare formarea unor baze Schiff:
Transaminarea este catalizată de o enzimă specifică transaminaza care are drept coenzimă piridoxalfosfatul (vitamina B6). Importanţa deosebită a reacţiilor de transaminare, reacţii biochimice reversibile, constă în realizarea corelaţiei dintre metabolismul glucidic şi cel protidic. Aminoacizii sunt intermediari la obţinerea altor biomolecule importante, cum ar fi: peptide, proteine, antibiotice (gramicidina), hormoni (adrenalina, noradrenalina).
Biosinteza proteinelor (poliprotidelor) Proteinele (holoproteide superioare) se sintetizează din aminoacizi printr-un proces continuu şi complex, care decurge cu viteză mare, la nivelul ribozomilor din celule, cu implicarea acizilor nucleici şi a compuşilor macroergici ATP, GTP care furnizează energia necesară proceselor biochimice. Aminoacizii se unesc în catene macromoleculare, prin legături peptidice, într-o anumită succesiune, conform codului genetic conţinut în ADN. Succesiunea bazelor azotate din ADN este transcrisă (cu respectarea principiului complementarităţii) într-o anumită structură a acizilor mARN şi tradusă cu ajutorul acizilor tARN din codonii mARN pe anticodonii tARN în noua structură proteică (limbajul bazelor azotate din acizii nucleici este tradus în limbajul aminoacizilor proteinei). Proteinele sunt sintetizate din cei 20 de aminoacizi proteinogeni, iar secvenţa bazelor azotate din mARN reprezintă secvenţa amionacizilor din proteină. Fiecare aminoacid este reprezentat pe mARN printr-o tripletă de baze azotate numită codon (cu cele 4 baze azotate există 64 codoni (triplete) diferiţi). Etapele necesare sintezei proteinelor sunt: - reduplicarea ADN, constă în desfacerea legăturilor de hidrogen dintre bazele azotate complementare, urmată de desfăşurarea spiralei bicatenare, cu formarea celor două catene polipeptidice simple de ADN; - transcrierea (transcripţia) mesajului genetic, respectiv o anumită succesiune a bazelor azotate de pe ADN (matriţa) pe catena polinucleotidică a mARN, care este sintetizată cu respectarea riguroasă a complementarităţii bazelor azotate din ADN, cu deosebirea că timina din ADN este înlocuită în mARN cu uracil - traducerea (translaţia) este o etapă importantă în determinarea caracterului şi însuşirilor unui organism, deoarece limbajul bazelor azotate din acizii nucleici (o anumită secvenţă, respectiv codul genetic) este tradus оn limbajul aminoacizilor constituenţi ai proteinei (o anumită secvenţă a aminoacizilor). Fiecare secvenţă de 3 baze azotate din structura acizilor nucleici constituie un codon, iar fiecărui codon îi corespunde un anumit aminoacid. Conform principiului complementarităţii bazelor azotate, unui anumit codon de pe ADN îi corespunde un anumit codon de pe mARN şi apoi un anticodon de pe tARN. Reprezentarea acestor etape este redată schematic în figura următoare.
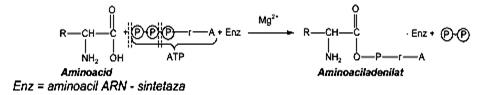
Din punct de vedere biochimic, etapa de traducere (translaţie) reprezintă biosinteza propriu-zisă a macromoleculelor proteice şi cuprinde mai multe etape: a) activarea enzimatică a aminoacizilor din citoplasmă constă în acţiunea ATP asupra aminoacizilor, în prezenţa enzimei amionoacil- ARN sintetaza şi a ionilor Mg2+, cu formarea complexului aminoacil-AMP- enzima.
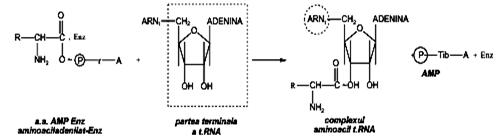
b) formarea complexului aminoacil-tARN, prin transferul restului aminoacil de la complexul aminoacil-AMP-enzima la capatul C’3 -OH al tARN (se formează o legătură esterică la C’3-OH de la secvenţa terminală a tARN a trinucleotidei CCA. Trinucleotida terminală CCA a tARN are braţul flexibil şi poate adapta grupa aminoacil la poziţia reactivă determinată de pe ribozom.
Evidenţierea modului în care tARN este capabil să identifice poziţia de legare a amino-acidului în lanţul peptidic, poate fi realizată cu ajutorul “modelului trifoi” al tARN:
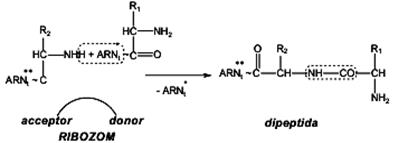
Legarea corectă a aminoacidului cu tARN corespunzător se datorează specificităţii absolute a enzimei aminoacil-ARN-sintetaza. Se asigură astfel, recunoaşterea codonului de către anticodon (şi nu de către aminoacidul activat). c) formarea legăturii peptidice decurge pe ribozomi (particule conţinînd rARN, prezente în toate celulele) şi se realizează între aminoacizii transportaţi fiecare de tARN corespunzători (aflaţi pe codonii dictaţi de mesajul genetic înscris pe mARN). Ribozomii posedă pe suprafaţa lor două situsuri catalitice: - situsul P (donor), pe care se va găsi complexul aminoacil 1-t1ARN - situsul A (acceptor), pe care se află complexul aminoacil 2 –t2ARN. Între cei doi aminoacizi alăturaţi, legătura peptidică -NH-CO- se realizează între grupa carbonil a aminoacidului 1, de pe poziţia donor a ribozomului (corespunzator codonului 1 de pe mARN) şi grupa amino (-NH2) a aminoacidului 2 de pe poziţia acceptor a ribozo-mului (corespunzînd codonului 2 de pe mARN). În urma formării legăturii peptidice între cei doi aminoacizi, molecula de t1 -ARN este eliberată din complexul aminoacid 1-t1 ARN şi poate fi din nou utilizată.
Prin deplasarea ribozomilor de-a lungul mARN (sau deplasarea mARN pe suprafaţa ribozomilor), codonii de pe mARN trec succesiv prin dreptul situsului A de pe ribozomi, dictînd natura complexului aminoacil-tARN care urmează să fie fixat pe acest situs. Dipeptida formată, sub forma complexului aminoacid 1-aminoacid 2–t2ARN, trece pe poziţia donor a ribozomului, lăsînd liberă poziţia acceptor, corespunzator codonului 3 de pe mARN. d) elongaţia (creşterea lungimii lanţului polipeptidic) se realizează după un mecanism identic cu cel implicat în cazul biosintezei dipeptidei. Situsul P al ribozomului este ocupat cu complexul dipeptidil-t2ARN, iar situsul A este vacant şi se poziţionează la al treilea codon de pe mARN, formвnd complexul aminoacil 3-t3ARN. După formarea noii legături peptidice între grupa carbonil legată de complexul dipeptidil-t2ARN şi grupa amino de la complexul aminoacil 3-t3ARN, are loc deplasarea tripeptidei formate (sub forma complexului AA1-AA2-AA3-t3ARN) pe situsul donor (situs P) al ribozomului cu eliberarea concomitentă a situsului acceptor (situs A) al ribozomului, care se va poziţiona în dreptul codonului 4 de pe mARN, în vederea formării complexului aminoacil-4-t4 ARN.Dacă proteina care urmează a fi sintetizată are, de exemplu, 200 de aminoacizi, etapa finală implică transferul peptidei conţinînd 199 de aminoacizi spre aminoacidul final, legat în complexul cu tARN, cu formarea unui complex proteină-tARN. Capătul N-terminal al proteinei este sintetizat primul, capătul C-terminal, ultimul. e) Terminarea biosintezei lanţului polipeptidic al proteinei Lungimea lantului polipeptidic este determinată genetic, prin transcrierea pe mARN a unui codon stop (nu codează nici un aminoacid): UAG, UAA, AGA (pentru care nu există nici un tARN cu anticodoni corespunzători). Aceşti codoni "non-sens" sunt însă recunoscuţi de proteine citoplasmatice specifice, denumite factori de eliberare (protein release factors), care desprind proteina de pe tARN. Lanţul polipeptidic este eliberat de pe situsul P al ribozomului şi de pe tnARN printr-o reacţie de hidroliză. Ribozomul se detaşează de pe mARN şi este apt pentru o nouă etapă de iniţiere. Lungimea lanţului proteic este determinată genetic, prin transcrierea pe mARN a unui codon stop. Proteinele sintetizate (holoproteide) participă la biosinteza heteroproteidelor, a enzimelor, la îndeplinirea unor funcţii specifice organismului. Concomitent se desfăşoră şi un proces invers, de biodegradare a proteinelor.
|
||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 343; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.163.134 (0.01 с.) |