Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
II. 1. 1. VItaminele liposolubileСодержание книги
Поиск на нашем сайте
Vitaminele liposolubile sunt în cea mai mare parte substanţe termostabile, rezistente faţă de acţiunea acizilor şi bazelor şi care pot fi depozitate în organism, şi utilizate ulterior, în cazul în care cantitatea lor în alimente este mai mare decît cea necesară. Din categoria vitaminelor liposolubile fac parte vitaminele: A, D, E, K.
Vitaminele A Vitaminele A sunt din punct de vedere al structurii chimice alcooli primari nesaturaţi, care conţin în moleculă un nucleu β-iononic şi o catenă cu duble legături conjugate, pe care sunt grefaţi cinci radicali metil. Vitaminele A sunt cunoscute şi ca vitamine antixeroftalmice, antiinfecţiose, vitamine de creştere liposolubile, vitamine de apărare a epiteliilor, axeroftoli. Vitaminele A sunt biosintetizate numai de către plante, sub formă de provitamine cu structură carotenoidică, în organismele animale fiind scindate hidrolitic, sub influenţa enzimei carotenază. Surse de vitamine A sunt: ficatul, gălbenuşul de ou, laptele, untul, precum şi salata, spanacul, ceapa verde, vegetale de culoare galbenă-portocalie (morcovi, tomate). Carotenii sunt sintetizaţi de toate plantele, cu excepţia plantelor parazite şi saprofite. Cele mai importante provitamine A sunt: α-carotenul, β-carotenul, γ-carotenul şi criptoxantina. β-Carotenul este cel mai bine reprezentat în masa carotenoizilor separaţi din frunzele plantelor, unde însoţeşte clorofilele. Vitamina A1 (retinol, vitamina antixeroftalmică, antiinfecţioasă, vitamina creşterii) se formează în organism prin scindarea oxidativă a carotenilor care conţin cel puţin un ciclu β-iononic. Din β-caroten, principala provitamină A, se obţin două molecule de vitamină A1, pe cînd din restul carotenilor (care conţin un singur inel β-iononic), se obţine numai cîte o moleculă de vitamină A1. Scăderea conţinutului de proteine din organism împiedică transformarea provitaminelor în vitamină. Se presupune că în faza primară produsul oxidării este o aldehidă a vitaminei A (retinalul), care este redusă la alcoolul corespunzător, denumit retinol sau vitamina A1. Retinolul poate fi esterificat şi depozitat în ficat sub formă de ester retinol palmitat. Este probabil ca forma activă a vitaminei A să fie forma acidă, denumită acid retinoic. Funcţia specifică a vitaminei în procesul vederii este îndeplinită de forma aldehidică a vitaminei A1, denumită retinal. Vitamina A2 (care se găseşte frecvent în carnea peştilor de apă dulce) are în inelul β-iononic două duble legături şi se mai numeşte dehidroretinol.
Conversia carotenilor la retinol este sub 100%, aşa încît conţinutul în vitamina A al diferitelor alimente este exprimat sub formă de echivalenţi de retinol (1 RE = 1 mg retinol, 6 mg β-caroten şi 12 mg alte carotenoide). Rolul biochimic al vitaminelor A este foarte complex: • β-carotenul are un rol antioxidant pronunţat, reducînd riscul formelor de cancer, iniţiate de către radicalii liberi şi alţi oxidanţi puternici; • retinolul şi acidul retinoic, convertiţi în organism în retinil fosfat sunt implicaţi în sinteza unor glicoproteine şi mucoplizaharide care au acţiune protectoare asupra ţesuturilor epiteliale, prevenind keratinizarea lor, proces care favorizează, prin predispoziţia la fisuri, instalarea infecţiilor microbiene; • retinolul şi acidul retinoic stimulează eritropoieza (formarea globulelor roşii) prin participarea la biosinteza proteinelor transportoare de fier; • forma aldehidică a vitaminelor A (cis-retinalul) este legată reversibil de proteinele vederii (opsina şi rodopsina). Lumina iniţiază în retină schimbări biochimice complexe, cu generarea unui impuls nervos datorat transformării cis-retinalului în trans-retinal şi disocierea de pe proteina vederii (rodopsina). Regenerarea pigmenţilor vizuali necesită izomerizarea retinolului în forma cis. Hemeralopia nocturnă (pierderea acuităţii vizuale pe timp de noapte) este un simpton al deficienţei în vitamina A, forma severă conducînd la keratinizarea corneei (xeroftalmie). Hipervitaminoza A (peste 50 000 RE/zi) conduce la acumularea ei în ficat, cu apariţia unor efecte toxice (mărirea volumului ficatului, splinei, dermatite etc.).
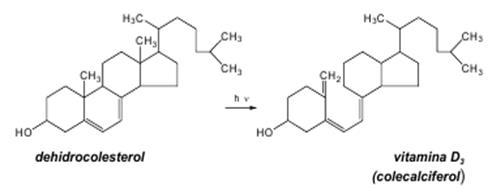
Vitaminele D Vitaminele D (calciferoli, vitamine antirahitice), (vitamine antirahitice), dintre care cele mai importante sunt: vitaminele D2 şi D3 pot fi considerate datorită acţiunii biochimice, mai degrabă hormoni decît vitamine. În natură se găsesc atît libere cît şi sub formă de provitamine (steroli). În prezent se cunosc şase vitamine D: - vitamina D2 – calciferolul; - vitamina D3 –colecalciferolul; - vitamina D4 – 22-Dihidroergosterolul; - vitamina D5 – 7-Dehidrositosterolul; - vitamina D6 – 7-Dehidrostigmasterolul; - vitamina D7 – cetona 25 O3. Toate vitaminele D sunt înrudite prin structura chimică de sterol, pe care sunt grefate; o grupă hidroxil la C3, un ciclu deschis (B) cu trei legături duble conjugate, un nucleu indanic şi o catenă laterală caracteristică fiecărei vitamine. Catenele laterale se deosebesc între ele prin numărul atomilor de carbon şi prin prezenţa sau absenţa unei duble legături. Transformarea sterolilor în vitamine D se face sub acţiunea energiei solare, a radiaţiilor ultraviolete, printr-un proces fotochimic cu consum de energie. Din ergosterol, sub influenţa radiaţiilor UV, se formează ca produs intermediar lumisterol, şi apoi tahisterol şi ergocalciferol (vitamina D2).
Colecalciferolul (vitamina D3) este produs în piele prin iradierea cu raze UV a 7-dehidrocolesterolului, provenit din colesterolul preluat în organism prin alimentaţie. Atîta timp, cît corpul este expus luminii solare nu se impune suplimentarea vitaminei D.
.Cea mai bună sursă de vitamine D o constituie peştii de apă sărată (sardine, heringi, somoni), ficatul, gălbenuşul de ou, laptele, untul, drojdia de bere. Vitaminele D se exprimă sub formă de mg de colecalciferol (1 mg colecalciferol sau de ergocalciferol = 40 UI). Acţiunea biochimică: vitaminele D reglează absorbţia intestinală a calciului şi fosforului. Nivelele ridicate ale calciului şi fosforului seric cresc viteza de mineralizare a oaselor (favorizează depunerea de calciu în sistemul osos). Cînd în organism, nivelul calciului şi fosforului sunt scăzute se produce demineralizarea oaselor pentru a menţine nivelul seric normal de calciu şi fosfor. Simptomele în cazul deficienţei de vitamine D sunt rahitismul (la copii) şi osteomalacia (la adulţi). Hipervitaminoza (hipercalciurie) se manifestă prin formarea calculilor renali, hepatici. Vitaminele D sunt stabile în absenţa oxigenului şi a luminii (pot fi stabilizate cu antioxidanţi, de exemplu, cu tocoferoli.
Vitaminele E (tocoferoli) Vitaminele E se mai numesc tocoferoli (tokos = naştere; fero = a purta), vitaminele antisterilităţii sau vitaminele de reproducere. Ele sunt sintetizate numai de plante şi se găsesc în cantitate mare în plantele verzi (salată, legume), germenii cerealelor, uleiuri vegetale, ţesuturi de organe animale (ficat, rinichi, muşchi), ouă, lapte. Din punct de vedere chimic, vitaminele E reprezintă un amestec de compuşi chimici înrudiţi care au la bază tocolul, format dintr-un nucleu benzopiranic (cromanic) pe care sunt grefate o grupă hidroxil la C6, o catenă laterală derivată din fitol şi radicali metil în diferite poziţii (în funcţie de reprezentant: α, β, γ, δ, ε etc.).
Tocoferolii sunt substanţe uleioase, termostabile, optic active, oxidabile uşor în prezenţa oxigenului din aer. Prin transformarea reversibilă a hidroxilului de la C6 în grupare cetonică, vitaminele E funcţionează în organism ca sisteme redox. Pe această proprietate se bazează rolul lor antioxidant, protectori ai altor substanţe uşor oxidabile (vitaminele: A, D, C, E, a biotinei, carotenilor, acizilor graşi etc.). Datorită caracterului lipofilic, se acumulează în lipoproteine, în membranele celulare şi depozitele de grăsimi, unde reacţionează rapid cu O2 şi radicalii liberi, protejîndu-le de reacţii de oxidare şi asigurînd o absorbţie mai bună a grăsimilor. Vitaminele E joacă rol în respiraţia celulară (stabilizînd coenzima Q sau transferînd electroni pe aceasta) şi în sinteza hemoglobinei. Favorizează reacţiile de fosforilare şi formarea compuşilor macroergici. Fiind implicată în reducerea colesterolului seric, joacă rol benefic în controlul afecţiunilor cardiace (conform cercetărilor recente, o suplimentare a dietei cu 100 mg/zi de vitamina E, reduce riscul de infarct). Participă la diferite sisteme enzimatice, stimulează ritmul de creştere şi protejează organismul de infecţii. Fiind o vitamină liposolubilă, ar putea avea un potenţial toxic, care însă nu a fost pus pînă acum în evidenţă (este cea mai puţin toxică dintre vitaminele liposolubile). Deficienţile în vitamina E se manifestă la mai multe nivele: - sitemul reproductiv: la masculi se manifestă lipsa de mobilitate a spermatozoizilor şi degenerarea lor pînă la pierderea capacităţii de fertilizare; degenerarea epiteliului germinativ; pierderea instinctului sexual; la femele dezvoltarea foetusului este întîrziată, avînd loc degenerarea ţesuturilor placentale, şi foetale, etc. - în sistemul muscular se pot înregistra distrofii musculare nutriţionale progresive; creşterea consumuilui de oxigen al muşchilor scheletali (in vitro); umflare şi hialinizare a muşchilor sceletali şi cardiaci, care devin necrotici, etc. - modoficări metabolice: creşterea consumului de oxigen; creatinurie; scăderea activităţii colinesterazei şi creşterea activităţii xantin-oxidazei din ficat; creşterea ciclului de refacere a fosforului; scăderea vitezei de eliberae a aminoacizilor; - sistem excretor: degenerarea parenchimatoasă a rinichilor; necroza epiteliului tubular. De remarcat că la păstrarea produselor alimentare şi la prelucrarea lor culinară, cantitatea de vitamina E primită de organism se micşorază cu 70%.
Vitaminele K Vitaminele K se mai numesc vitamine antihemoragice sau vitaminele coagulării, menaftone, filochinone. Vitaminele K sunt sintetizate numai de plante (din fitol, componentă a clorofilei) şi microorganismele din tubul digestiv al animalelor. Sunt răspîndite în cantitate mare în frunzele de lucernă, trifoi, spanac, soia, varză, cloroplaste şi în făina de peşte. Din punct de vedere chimic sunt derivaţi ai 2-metil-para-naftochinonei, pe catena căreia se găseşte la C3 o grupă metil, iar la C2 o catenă laterală care diferă de la o vitamină la alta.
Vitamina K1 (R = radical fitil) este răspîndită în plantele verzi, iar vitamina K2 (R = radical farnesil) este biosintetizată de bacteriile intestinale. Participă activ la procesele de oxidare celulară şi la procesele de fosforilare oxidativă. În organismele vegetale, vitaminele K au un rol important în procesele de oxido-reducere, în procesele de fosforilare şi în respiraţia tisulară. Datorită reacţiei reversibile dintre forma oxidată şi forma redusă, vitaminele K asigură transportul atomilor de hidrogen de la un substrat la altul, pe cale neenzimatică.
Vitaminele K determină coagularea sîngelui prin transformarea fibrinogenului în fibrin (sinteza protrombinei). Carenţa de vitamine K conduce la creşterea timpului de coagulare a sîngelui şi poate fi un factor favorizant al osteoporozei. Deoarece vitaminele K sunt sintetizate de bacteriile din intestine, deficienţele sunt rare, deşi recent s-a descoperit faptul că vitaminele K sintetizate intestinal nu sunt absorbite total. Deficienţa de vitamine K a fost semnalată în cazul malabsorbţiei grăsimilor ca şi după tratamentele îndelungate cu antibiotice, care pot distruge vitaminele K sintetizate intestinal.
Vitaminele F Vitaminele F se mai numesc vitamine antidermatitice, deoarece în lipsa lor apar tulburări metabolice la nivelul pielii. Vitaminle F sunt formate dintr-un amestec de acizi graşi esenţiali, care conţin mai multe duble legături în moleculă şi care sunt răspîndiţi în organismele vegetale (în special uleiuri vegetale) şi nu sunt biosintetizaţi de animale. Dintre aceştia cei mai importanţi sunt acidul linoleic, acidul linolenic şi acidul arahidonic. Administrate omului, vitaminele F contribuie la procesul de vindecare a unor dermatite. Vitaminele F sunt implicate în procesul de biosinteză a lipidelor complexe.
II.1.2. VITAMINELE HIDROSOLUBILE Vitaminele hidrosolubile sunt substanţe foarte diferite din punct de vedere structural, reprezentate de vitaminele din aşa-numitul “complex B” (B1, B2, B6, B12 etc.), vitaminele PP, vitamina C, acidul lipoic, acidul pantotenic, acidul folic, vitaminele P etc. Ele diferă faţă de vitaminele liposolubile în multe aspecte importante, astfel ele sunt solubile în apă şi insolubile în solvenţi organici, sunt mai termolabile, dar mai fotostabile, stabile în mediu acid, dar instabile în mediu bazic etc. Multe dintre vitaminele hidrosolubile sunt rapid eliminate, (de aceea hipervitaminozele sunt rare), iar carenţele apar relativ rapid în cazul unei diete sărace în aceste vitamine. Deoarece vitaminele hidrosolubile sunt coenzime ale multor enzime cu rol important în metabolism, sunt implicate în etapele generatoare de energie sau în hematopoeză. De obicei, ele participă în atît de multe reacţii biochimice încît este imposibil de stabilit exact cauza biochimică a unui simptom anumit. Totuşi, se poate generaliza faptul că, datorită rolului important jucat de aceste vitamine în metabolismul energetic, deficienţele se observă prima dată în ţesuturile cu creştere rapidă. Simptomele tipice includ: dermatite, glosite (umflarea limbii), diaree, depresii, pierderea coordonării mişcării.
Vitamina B1 Vitamina B1 (tiamina, aneurina, vitamina anti beri-beri) este larg răspîndită în regnul vegetal în seminţele cerealelor şi leguminoaselor, în cojile de orez, frunze, flori, polen, drojdie de bere etc. Din punct de vedere chimic, este constituită dintr-un nucleu pirimidinic şi unul tiazolic, legate printr-un radical metilen.
Sub formă de clorhidrat, este o substanţă solidă, cristalină, solubilă în apă şi insolubilă în solvenţi organici. Este distrusă la fierbere şi sub acţiunea razelor ultraviolete. Tiamina este rapid transformată prin fosforilare în coenzima tiaminpirofosfat (TPP), care este implicată în: metabolismul căii pentozofosfat (singura sursă de biosinteză a ribozei necesară sintezei acizilor nucleici şi sursa majoră de NADPH pentru biosinteza acizilor graşi), decarboxilarea cetoacizilor etc. Avitaminoza, se manifestă la om prin tulburări ale sistemului nervos, iritabilitate, oboseală, depresie, tulburări gastro-intestinale, simptome neuromusculare asociate cu tulburări cardiace (boala beri-beri). Necesarul de tiamină este proporţional cu conţinutul caloric al dietei (1,0-1,5 mg/zi) şi poate fi mărit în cazul excesului de carbohidraţi sau al creşterii vitezei metabolice (datorită febrei, traumatismelor, gravidităţii). Vitamina B1 stimulează creşterea ţesuturilor şi a rădăcinilor plantelor cultivate în soluţii artificiale.
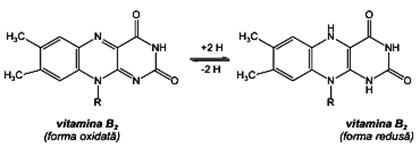
Vitamina B2 Vitamina B2 (riboflavina, lactoflavina – din lapte, ovoflavină din ou, hepatoflavină din ficat), este sintetizată în plante, bacteriile de fermentaţie anaerobă şi drojdia de bere. Din punct de vedere al structurii chimice este formată dintr-un nucleu izoaloxazinic metilat (care conferă formei oxidate o culoare galben-verzuie), pe care este grefat un radical ribitil, provenit de la pentaalcoolul ribitol.
Vitamina B2 este sensibilă la acţiunea luminii, care în mediu bazic o transformă în compuşi fără activitate vitaminică. Vitamina B2 prezintă în organism rol complex. Ea intră în constituţia enzimelor dehidrogenaze FMN şi FAD, implicate în reacţiile de oxidoreducere din metabolism, deoarece poate fixa reversibil atomi de hidrogen. Stimulează creşterea organismelor tinere şi participă alături de vitamina A în procesul vederii. Alimentele bogate în riboflavină sunt: laptele, carnea, ouăle, cerealele. Doza recomandată este de 1,2-1,7 mg /zi pentru un adult (mai mare în cazul alcoolicilor şi a hipotiroidismului). Simptomele caracteristice deficienţei de riboflavină se manifestă prin: dermatite, căderea părului, glosită, slăbirea rezistenţei la infecţii, tulburări hematologice.
Vitaminele B6 Vitaminele B6 (adermine, piridoxol, piridoxal, piridoxamina) sunt răspîndite în: seminţe de cereale, drojdie de bere, unt, carne, lapte, ouă. Din punct de vedere structural sunt derivaţi ai 2-metilpiridinei, care apar de obicei împreună, şi se pot transforma una în alta.
Prin fosforilarea piridoxalului şi a piridoxaminei se obţin coenzimele piridoxalfosfat şi piridoxaminofosfat, care biocatalizează decarboxilarea şi transaminarea aminoacizilor. Piridoxalfosfatul este necesar sintezei neurotransmiţătorului serotonina şi a sfingolipidelor necesare formării mielinei. Vitaminele B6 constituie factori de creştere pentru unele microorganisme. Carenţa în vitamine B6 produce la om tulburări nervoase, iritabilitate, depresii, insomnii, astenie. Necesarul de vitamine B6, pentru un organism adult este proporţional cu conţinutul proteic al dietei (pentru 100 g proteine/zi sunt necesare 1,4-2,0 mg/zi).
Vitamina B12 Vitamina B12 (cianocobamida) este puţin răspîndită în regnul vegetal. În organismele animale se găseşte în ficat, rinichi, sînge, lapte, reprezentînd factorul absolut necesar creşterii unor microorganisme. Vitamina B12 este indispensabilă pentru viaţa organismelor vegetale şi animale, fiind implicată în procesul de creştere, hematopoeză şi buna funcţionare a celulei nervoase. Din punct de vedere a structurii chimice, vitamina B12 este formată dintr-un nucleu porfirinic care conţine central un atom de cobalt şi o grupă cian, grupe metilice şi amidice legate de nucleele pirolice, un nucleu dimetilbenzoimidazolic, riboză, acid fosforic şi alcool izopropilic. Vitamina B12 este o substanţă cristalină, de culoare roşie, solubilă în apă, insolubilă în solvenţi organici. Ea stimulează biosinteza nucleoproteidelor şi este un factor antianemic. În avitaminoză, se întrerupe diviziunea celulară şi se produce anemia pernicioasă. Deoarece este larg răspîndită în alimentele de origine animală, iar ficatul păstrează timp de 6 ani suplimentul de vitamina B12, deficienţele sunt rare (la persoane în vîrstă şi la cele vegetariene).
Vitamina PP Vitamina PP (niacina, nicotinamida, pelagropreventivă) este răspîndită în embrioni de grîu, tărîţe, alune, drojdie de bere, lapte, carne (mai puţin în porumb, cartofi). Din punct de vedere structural, niacina (nicotinamida) este amida acidului nicotinic, componentă a coenzimelor oxidoreductaze anaerobe NAD şi NADP, implicate în reacţii redox prin transfer de atomi de hidrogen de la un substrat la altul, în condiţii anaero Niacina poate fi sintetizată din aminoacidul triptofan (1 mg de niacină din 60 mg de triptofan), dar biosinteza are loc numai după ce necesarul organismului în triptofan a fost asigurat şi cu aportul altor vitamine din complexul B.
Carenţa pronunţată conduce la boala numită pelagra (pella agra = piele groasă) sau boala celor trei afecţiuni cu "d": dermatită, diaree şi demenţă). Simptomele neurologice sunt asociate cu degenerarea ţesutului nervos. Necesarul pentru un adult este de: 13-19 mg/zi de niacină.
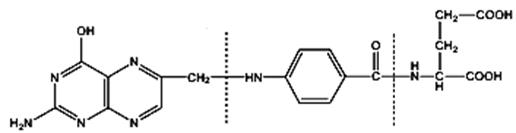
Acidul folic (vitamina B9) Vitamină B9 este prezentă în frunzele plantelor verzi (spanac, salată), fructe verzi, drojdie de bere, carne, lapte, ouă. Din punct de vedere chimic este acidul pteroilglutamic, constituit din acid pteridinic, rest de acid p-aminobenzoic şi acid glutamic.
nucleul pteridinic acid para-aminobenzoic acid glutamic 2-amino-4-oxo-6-metilpteridina Acidul folic îndeplineşte rol de coenzimă în biosinteza aminoacizilor (colina, serina, glicina), a bazelor azotate purinice, a nucleotidei dTMP. Cel mai pronunţat efect al deficienţei este inhibarea sintezei ADN datorită lipsei de purine şi dAMP, ceea ce cauzează forme grave de anemie.
Acidul paraaminobenzoic (PAB) Acidul paraaminobenzoic (PAB) se numeşte şi vitamina H şi este răspîndit atît în organismele vegetale cît şi în cele animale. Este un factor de creştere pentru numeroase microorganisme. Este sintetizat de flora intestinală în cantităţi suficiente pentru om. PAB este componentă a acidului folic şi a coenzimei tirozinaza. Are o acţiune antiinfecţioasă generală, previne depigmentarea pielei şi a părului.
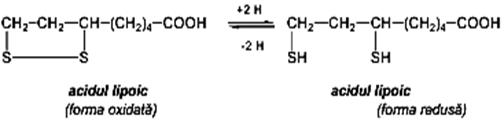
Acidul lipoic Acidul lipoic (tioctic) este prezent în plantele verzi, sub formă de lipotiamidpirofosfat, coenzimă participantă la carboxilarea acidului piruvic (metabolismul glucidic). Trebuie evidenţiat, de asemenea, rolul de acceptor de atomi de hidrogen în prima fază a fotosintezei şi de activator al radicalului metil.
Acidul pangamic Acidul pangamic (vitamina B15, D-gluconodimetilaminoacetat) a fost pus în evidenţă în organisme vegetale, sîmburi de caise, plantule de orez, levuri, sîngele de bovine etc. Acidul pangamic este un compus sintetizat în organism din componente care sunt produse normale ale metabolismului: acidul D-gluconic şi dimetilglicina. Pe cale sintetică au fost obţinuţi şi derivaţi ai vitaminei B15 care conţin în moleculă 4, 8 şi 12 grupe metil.
Acidul pangamic intervine în procesele de metilare şi transmetilare, datorită grupelor metil, labile, pe care le conţine. Este implicat în biosinteza unor substanţe biologic-active (donor de grupe metil), cum ar fi: metionina, colina, creatinina, adrenalina, metionina, ARN, hormoni steroizi, în activitatea respiratorie a celulei şi procesele de detoxifiere. Acidul pangamic este un factor lipotrop, fiind utilizat la vindecarea hepatitei şi tratamentul cirozelor hepatice.
Inozita Inozita (inozitolul, Bios I) sub forma izomerului mezoinozitol (hexahidroxiciclohexan) este un poliol ciclic, răspîndit în toate ţesuturile vegetale (frunze, rădăcini, polen) şi animale, sub formă liberă sau ca ester fosforic (acidul fitinic), ca atare, sau sub forma sărurilor de calciu:
Acidul fitinic este principala sursă de fosfor din seminţe. În timpul germinării se eliberează prin hidroliză enzimatică: ioni de calciu, acid fosforic şi final mezoinozitol liber. În organismele animale (nu şi în cel uman) inozita este factor lipotrop, preоntîmpină fixarea grăsimilor). Aceeaşi acţiune manifestă şi colina.
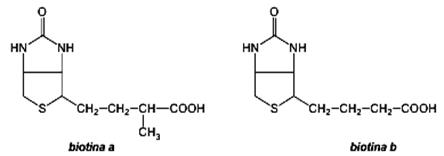
Biotina Biotina (vitamina H, Bios II) este prezentă în: drojdie de bere, muguri de plante, ouă, alune, ciocolată. Se găseşte liberă sau combinată cu proteine, peptide, aminoacizi. Se cunosc două biotine: α-biotina şi β-biotina. Ambele au o structură biciclică, rezultată prin condensarea formală a unui nucleu tetrahidroimidazolic cu unul tiofenic, avînd drept catenă laterală un rest de acid valerianic sau izovalerianic.
Biotina constituie gruparea prostetică a unor enzime, de exemplu a piruvatcarboxilazei implicată în reacţii de carboxilare a cetoacizilor (sinteza acidului oxalilacetic din ciclul Krebs), a acetil-coenzimei A, (biosinteza acizilor graşi) şi a propionil-coenzimei A (biosinteza aminoacizilor). Biotina stimulează creşterea ţesuturilor merismatice prin intensificarea diviziunii celulare. Biotina poate fi sintetizată de bacteriile intestinale. Avitaminoza se manifestă prin descuamarea pielei, căderea părului, lipsa poftei de mîncare, oboseală etc.
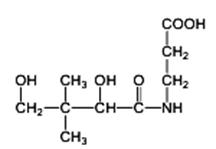
Acidul pantotenic Acidul pantotenic (Bios III) este răspîndit în toate organismele vegetale şi animale. În cantitate mare se află în lăptişorul de matcă, fasole, soia, drojdia de bere etc. Acidul pantotenic este format din β-alanină şi acid α,γ-dihidroxi-β-dimetilbutiric.
Acidul pantotenic este o substanţă uleioasă, de culoare galbenă, solubil în apă şi sensibil la acţiunea oxidanţilor în mediu bazic. Intră în structura coenzimei A, implicată în metabolismul glucidic şi lipidic. Este un factor de creştere pentru numeroase microorganisme şi factor de stimulare a metabolismul celular. Cu toată importanţa acestor reacţii, nu există deficit de acid pantotenic, deoarece acesta este foarte răspîndit (panthotem = peste tot) în alimentele de origine vegetală şi animală, iar simptomele deficienţei sunt vagi, asemănătoare, în general, deficienţei de vitamine B.
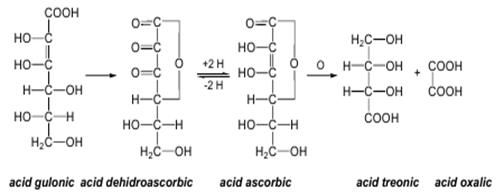
Vitamina C (acidul ascorbic) Vitamina C (acidul ascorbic) este una dintre vitaminele cele mai răspîndite în regnul vegetal în fructe de cătină, măceş, coarne, coacăze, mere, citrice etc.), atît în stare liberă cît şi asociată cu proteinele sub formă de ascorbinogen. Din punct de vedere al structurii chimice este lactona unui acid cetohexonic, acidul 2,3-endiol-L-gulonic.
Datorită structurii endiolice, acidul ascorbic aparţine sistemelor redox biochimice; el poate, prin oxidare, trece reversibil în acid dehidroascorbic. Este un activator general al metabolismului celular fiind implicat în sinteza protocolagenului şi deci în menţinerea stării de sănătate a ţesuturilor, în vindecarea rănilor, în combaterea fragilităţii capilare. Rolul sau reducător (enzimatic) se manifestă în absorbţia fierului în stomac (prin reducerea Fe3+ la Fe2+) precum şi la protejarea altor vitamine (A, E, D) faţă de procesul de oxidare. Rolul său important de antioxidant biologic recomandă vitamina C, alături de Я-caroten în dieta preventivă a cancerului. Este necesar un aport continuu de vitamina C (60 mg/zi), deoarece organismul uman nu sintetizează şi nu acumulează această vitamină, care este sensibilă la lumină, temperatură, O2 din aer, contactul cu metalele (Fe, Cu). Avitaminoza se manifestă sub forma bolii numită scorbut (anemie pronunţată, hemoragii, osteoporoză).
Vitaminele P Vitaminele P (citrine, bioflavonoide, vitaminele permeabilităţii) se găsesc în cantităţi apreciabile în citrice, ardei etc. Sunt substanţe cu activitate vitaminică, cu rol asupra pereţilor vaselor capilare. Din punct de vedere chimic sunt amestecuri de glicozide (conţin o componentă glucidică şi un aglicon). Agliconii sunt reprezentaţi de: pigmenţi din clasa flavonelor reprezentaţi de: hesperitină, rutină, quercetină. Prin oxidare formează flavochinone, funcţionînd ca sisteme redox. Acţionează sinergic cu vitamina C în prevenirea şi combaterea scorbutului, măresc tonusul miocardului, măresc rezistenţa la rupere a vaselor sanguine, scad tensiunea arterială.
II.1.3. Antivitamine
Antivitaminele sunt substanţe cu structură chimică asemănătoare vitaminelor, dar cu acţiune opusă acestora. Diferenţa de comportare este consecinţa diferenţelor structurale, chiar dacă acestea nu sunt mari. Antivitaminele prezintă în general o structură moleculară asemănătoare vitaminelor, sau cu unele fragmente din molecula lor. Efectul antivitaminic se explică prin afectarea activităţii enzimatice, datorită modificării structurii enzimei prin înlocuirea coenzimei (vitaminei) cu antivitamina corespunzătoare, sau prin inhibiţie competitivă a acţiunii biocatalitice enzimatice de către noua structură a antivitaminei. În prezent se cunosc numeroase antivitamine care au o structură analoagă riboflavinei, piridoxinei, tiaminei, biotinei, acidului foilc, precum şi vitaminelor K şi E. Se cunosc de asemenea, în afară de antivitamine, substanţe cu au o structură chimică diferită mult de cea a vitaminelor, de natură proteică, care au proprietatea de a se combina cu vitaminele, anihilîndu-le astfel activitatea vitaminică. De exemplu, în albuşul de ou s-a identificat proteina avidina, care se combină cu biotina, anihilîndu-i activitatea vitaminică. Acţiunea antivitaminelor se explică prin perturbarea unor procese metabolice care sunt stimulate de acţiunea vitaminelor. În tabloul sintetic de mai jos, sunt prezentate în paralel, structurile unor vitamine şi cele ale antivitaminelor corespunzătoare.
II.2. ENZIME Enzimele sunt compuşi macromoleculari de natură proteică, produşi şi prezenţi numai în organismele vii, cu rol de biocatalizatori ai tuturor transformărilor biochimice caracteristice metabolismului. Necesităţile plastice şi energetice ale organismelor vii sunt acoperite, pe de o parte, din substanţele nutritive, relativ stabile chimic, iar pe de altă parte de o serie de reacţii “de ardere” la care participă oxigenul. Apariţia şi evoluţia fiinţelor vii organizate a fost însoţită de selecţionarea şi perfecţionarea unor mecanisme capabile să asigure o viteză mare de desfăşurare a proceselor biochimice, în condiţii de activitate relativ menajate (soluţii apoase, temperaturi joase, mediu neutru etc.). Această problemă, a fost rezolvată în decursul evoluţiei, prin apariţia catalizatorilor biologici care sunt enzimele. Enzimele au rol esenţial în biosinteza şi biodegradarea substanţelor din materia vie. În lipsa enzimelor, majoritatea reacţiilor chimice din organism nu s-ar putea produce şi deci nu ar mai exista procese metabolice şi nici fenomene de viaţă. Bogate în enzime sunt plantulele, frunzele tinere, ţesuturile meristematice, seminţele în stare de germinaţie, fructele. În general, plantele tinere au un conţinut mai ridicat de enzime decît plantele adulte. Activitatea catalitică a enzimelor din organismele în creştere este mai mare decît a celor din organismele adulte. După locul unde acţionează, se pot evidenţia: • endoenzime (enzime intracelulare); • exoenzime (enzime extracelulare). Endoenzimele, acţionează în celulele în care s-au sintetizat. Ele sunt lioenzime (legate mai slab în celulă) şi desmoenzime (legate mai puternic în celule). Exoenzimele, după etapa de formare în celule, sunt eliminate în lichidele din organism, unde îşi exercită activitatea catalitică. Astfel, acţionează de exemplu, enzimele din lichidele interstiţiale, din diferite cavităţi, din seva elaborată etc. Substanţa asupra căreia acţionează enzimele se numeşte substrat.
II:2.1. STRUCTURA CHIMICĂ GENERALĂ A ENZIMELOR
Enzimele se pot clasifica, din punct de vedere chimic în două clase: • enzime monocomponente (holoproteice); • enzime bicomponente.
a) Enzimele monocomponente (holoproteice, proteine biocatalitice) sunt constituite numai din proteine. Acţiunea lor biocatalitică se datorează anumitor fragmente din catena polipeptidică, care includ grupe funcţionale componente ale catenelor laterale ale aminoacizilor (-OH, -NH2, -SH, -COOH etc.), constituind centrul activ sau situsul catalitic. Prin acest centru activ enzima fixează substratul (îl recunoaşte) sub forma unui complex enzimă-substrat, simbolizat E-S, şi biocatalizează transformarea substratului. Pentru recunoaşterea şi formarea complexului E-S, geometria centrului activ trebuie să fie complementară cu cea a substratului. Blocarea sau inactivarea centrului activ (de exemplu denaturarea proteinei) conduce la pierderea activităţii catalitice a enzimei holoproteice. În schimb, denaturarea unei părţi a proteinei, care nu cuprinde centrul activ, nu modifică activitatea catalitică a enzimei. b) Enzimele bicomponente (heteroproteice) sunt constituite din: • componenta proteică (apoenzimă, apoferment), care determină specificitatea enzimei (o anumită secvenţă a aminoacizior prin care enzima recunoaşte substratul şi оl fixează), este caracterizată prin masă moleculară mare, termolabilitate etc.; • componenta neproteică (prostetică, coenzimă, cofactor), care determină mecanismul şi viteza reacţiei enzimatice poate fi: o vitamină, un hormon, un colorant, nucleotide, metale. Ea este caracterizată prin masă moleculară mică, termostabilitate. În majoritatea cazurilor, acţiunea catalitică a enzimelor se manifestă numai în prezenţa unor substanţe speciale, denumite cofactori, care se clasifică în trei grupe: • coenzime sau cofermenţi specifici, sunt substanţe organice cu masă moleculară mică, termostabile şi care dializează uşor din soluţiile enzimei. Coenzimele se caracterizează prin însuşirea lor de a reacţiona reversibil cu proteina care intră în structura enzimei (apoenzima sau apofermentul); • grupările prostetice, substanţe combinate mult mai strîns cu apoenzima, se disociază greu şi, în general, rămîn fixate pe o singură apoenzimă; • activatorii, denumiţi uneori şi cofactori anorganici, sunt substanţe nespecifice (diferite metale, agenţi reducători etc.), care mediază trecerea enzimei într-o stare catalitică activă. Este greu de precizat o demarcaţie clară între cele trei grupe de cofactori, clasificaţi după natura şi raportul lor faţă de apoenzimă. Multe dintre coenzime şi grupări prostetice sunt de fapt derivaţi ai vitaminelor hidrosolubile. O mare parte dintre coenzime şi grupări prostetice identificate în componenţa unor enzime sunt nucleotide sau derivaţi ai acestora. Deşi în cazul enzimelor bicomponente, componenta care participă efectiv la realizarea procesului biocatalitic enzimatic este coenzima, totuşi, pentru manifestarea activităţii enzimatice, prezenţa apoenzimei de natură proteică este absolut obligatorie, deoarece gruparea prostetică luată separat are slabe proprietăţi catalitice. În complexul format de apoenzimă şi coenzimă (holoenzimă) activitatea catalitică creşte de 1000 de ori, comparativ cu activitatea catalitică a coenzimei libere. Legăturile dintre apoenzimă şi coenzimă sunt de natură diferită, variind de la o enzimă la alta şi pot fi: legături covalente, legături van der Waals etc. Datorită structurii proteice macromoleculare, enzimele au o masă moleculară mare şi formează soluţii coloidale. Starea coloidală a enzimelor prentîmpină difuzia lor dintr-o celulă în altă celulă, condiţionînd o localizare strictă a reacţiilor biochimice în organism la nivelul diferitelor organe, ţesuturi, celule.
II.2.2. CARACTERISTICI ALE ACTIVITĂŢII ENZIMATICE Enzimele, asemănător catalizatorilor chimici obişnuiţi, biocatalizează numai acele reacţii metabolice posibile din punct de vedere termodinamic (care se desfăşoară spontan, avînd energia liberă ∆G < 0). Rolul enzimelor, ca şi al catalizatorilor chimici, este de a reduce energia de activare (nu modifică echilibrele chimice, dar grăbeşte atingerea lor). Energia de activare în cazul enzimelor este însă mult mai mică. De exemplu, energia de activare la descompunerea apei oxigenate conform reacţiei: 2 H2O2 = O2 + 2 H2O este diferită, în funcţie de tipul de catalizator utilizat: • fără catalizator: 18 kcal/mol; • cu catalizatorul chimic FeCI3: 11,7 kcal/mol; • cu biocatalizatorul catalază: 5,5 kcal/mol Viteza reacţiei enzimatice este mult mai mare decît în cazul reacţiei catalizată de catalizatori chimici. De exemplu, enzima catalaza realizează descompunerea H2O2 de 10 miliarde de ori mai repede decît FeCl3 (ambii catalizatori au în structură cationul Fe3+). Sensibilitatea reacţiei enzimatice este foarte mare, astfel o moleculă de catalază descompune 5 milioane de molecule de H2O2 într-un minut, la 0 0C şi la pH = 6,8. Enzimele catalizează reacţii de desfacere şi formare de legături în condiţii fiziologice compatibile cu viaţa. Aceleaşi reacţii ar necesita în laborator condiţii de temperatură, presiune, pH, improprii vieţii. Spre deosebire de catalizatorii chimici, enzimele se caracterizează prin specificitate (absolută sau relativă) de substrat sau de acţiune. Specificitatea de substrat absolută este proprietatea enzimelor de a acţiona asupra unui singur substrat (de exemplu, ureaza catalizează numai descompunerea ureei). Acest tip de specificitate este determinat de o anumită secvenţă a aminoacizilor componenţi ai apoenzimei. Specificitatea de substrat relativă este proprietatea enzimelor de a acţiona asupra unui grup de substraturi cu structură chimică apropiată. De exemplu, maltaza catalizează hidroliza poliglucidelor în care componentele glucide sunt legate α-glicozidic. Specificitatea de substrat poate fi: stereochimică, dacă enzima catalizează transformarea doar a unui singur izomer din mai mulţi posibili (de exemplu: a izomerului trans, sau a izomerului cis; a izomerului dextrogir, sau a celui levogir). Specificitatea de substrat poate fi specificitate de legătură, dacă enzima catalizează formarea sau scindarea unui anumit tip de legătură (peptidică, glicozidică, eterică, esterică etc.), indiferent de natura substanţei care o conţine. De exemplu: lipazele catalizează hidroliza gliceridelor indiferent de natura acidului gras component. Specificitatea de acţiune absolută este caracteristica enzimelor de a cataliza o singură reacţie, dintre multiplele reacţii posibile. Specificitatea de acţiune relativă este proprietatea enzimelor de a cataliza un anumit tip de reacţie, dată de un grup de substraturi Înrudite. Acest tip de specificitate a enzimelor este determinat mai ales de natura cofactorilor (gruparea prostetică, coenzima) şi mai rar de natura apoenzimei.
II.2.2.1. MECANISMUL DE ACŢIUNE A ENZIMELOR. CINETICA REACŢIILOR ENZIMATICE Mecanismul de acţiune a enzimelor este analog cu cel al catalizatorilor chimici. Enzimele sunt capabile să accelereze viteza de desfăşurare a diferitelor reacţii (micşorează energia de activare), absolut necesare pentru menţinerea şi reproducerea materiei vii. Enzimele catalizează numai reacţii termodinamic posibile, care se pot produce şi fără participarea lor, dar într-un timp mai îndelungat şi uneori în condiţii incompatibile cu materia vie. Spre deosebire de catalizatorii nebiologici, enzimele au un randament mult mai ridicat, care asigură mersul reacţiei biochimice, în majoritatea cazurilor într-un singur sens, fără reacţii secundare. Ele preîntîmpină descompunerea unor substanţe instabile în anumite condiţii şi permit realizarea unor procese chimice complexe, cu o cantitate minimă de energie. Enzimele participă activ la procesele catalitice, parcurgînd următoarele etape: • activarea moleculelor substratului (S), prin scăderea energiei de activare a acestuia, şi formarea complexului intermediar disociabil, enzimă-substrat (ES), mai activ decît substratul ca atare; • transformarea complexului enzima-substrat (ES) în produsul de reacţie (procesul catalitic efectiv), mai întîi legat de enzimă (EP), şi în final, prin eliberarea enzimei, obţinerea produsului de reacţie, (P). Schematic, mecanismul catalizei enzimatice, conform teoriei etapelor intermediare, poate fi reprezentat astfel:
sau considerat ca echilibru:
Ţinînd cont că transformarea ES → EP este practic instantanee iar reacţia de transformare P + E → EP este nulă (enzima fiind specifică pentru substrat nu şi pentru produs), sistemul de ecuaţii de mai sus devine:
şi poartă denumirea de echilibrul Michaelis-Menten.
Factorii care influenţează viteza reacţiilor enzimatice Reacţiei de formare şi de descompunere a compusului enzimă-substrat i se poate aplica legea acţiunii maselor şi se poate determina astfel constanta de echilibru. Viteza reacţiilor enzimatice depinde în mare măsură de concentraţia enzimei şi de concentraţia substratului. a ) Influenţa concentraţiei enzimei asupra vitezei reacţiei enzimatice Viteza reacţiei enzimatice este direct proporţională cu concentraţia enzimei prezente în mediul de reacţie (figura 1.1):
Fig. 1.1. Influenţa concentraţiei enzimei asupra vitezei reacţiei enzimatice
În unele cazuri, de obicei cînd sunt prezenţi în sistem şi alţi factori, curba care reprezintă dependenţa vitezei de concentraţia enzimei, este deviată faţă de cea normală. Abaterile de la această comportare se pot datora prezenţei inhibitorilor, folosirea unei concentraţii de substrat sub limita de saturare a enzimei etc. b ) Influenţa concentraţiei substratului asupra vitezei reacţiei enzimatice S-a constatat că dacă se pleacă de la o cantitate fixă de enzimă şi se măreşte treptat concentraţia substratului, se va forma o cantitate mai mare de complex enzimă-substrat, viteza reacţiei va creşte treptat, pînă cînd toată enzima s-a combinat cu substratul. Acest stadiu reprezintă momentul de saturare a enzimei, iar viteza va fi maximă (vmax). Dacă se măreşte în continuare concentraţia substratului, viteza de reacţie nu se va mări, deoarece nu există enzimă liberă care să intre în reacţie cu substratul. Momentul de saturare a enzimei este dificil de stabilit, deoarece acestă variază în funcţie de concentraţia enzimei şi de concentraţia substratului. În practică, activitatea enzimatică se apreciază după concentraţia substratului, cînd jumătate din cantitatea de enzimă este combinată cu substratul sub formă de complex enzimă-substrat. În acest caz, viteza reacţiei este jumătate din valoarea sa maximă. Acest punct reprezintă constanta Michaelis (KM) şi reprezintă concentraţia substratului pentru care viteza de reacţie este jumătate din viteza maximă. Deci, pentru v = vmax/2, rezultă KM = [S] (vezi figura 1.2).
Fig. 1.2. Influenţa concentraţiei substratului asupra vitezei reacţiei enzimatice
Constanta Michaelis are valorile unor concentraţii şi se exprimă în moli/L. Constanta Michaelis se poate utiliza pentru a determina afinitatea enzimei faţă de substrat. Cu cît KM va avea o valoare mai mare, cu atît afinitatea enzimei faţă de substrat va fi mai mică şi invers. Relaţia cantitativă dintre viteza reacţiei enzimatice, concentraţia substratului şi valoarea KM, care exprimă viteza reacţiei enzimatice în fiecare moment, este dată de ecuaţia Michaelis-Menten:
Constanta lui Michaelis este o mărime importantă nu doar din punct de vedere al cineticii enzimatice ci şi pentru măsurătorile cantitative ale activităţii enzimatice din ţesuturi. Cercetări recente au pus în evidenţă importanţa medicală a constantei KM. Unele cazuri de leucemie (în care are loc o creştere enormă a numărului de leucocite) pot fi regresate prin administrarea intravenoasă a enzimei asparaginaza care catalizează reacţia de hidroliză a asparaginei la acid aspartic şi amoniac. Prin injectarea intravenoasă a asparaginazei (factor de creştere a leucocitelor), fenomenul de creştere a leucocitelor este stopat. Cercetările asupra surselor de asparaginază au demonstrat ca enzima are valori diferite ale KM în funcţie de provenienţă (bacterii, plante, animale). Deoarece concentraţia de asparagină din sînge este foarte mică, cantitatea de asparaginază injectată va avea efect terapeutic, doar dacă valoarea KM va fi suficient de mică pentru a hidroliza rapid asparagina aflată оn concentraţii mici în sînge. Activitatea enzimatică se exprimă prin unitatea enzimatică, respectiv cantitatea de enzimă care poate cataliza transformarea unui micromol de substrat în timp de un minut. Activitatea enzimatică în cazul enzimelor pure se determină prin numărul de molecule de substrat care pot fi metabolizate într-un minut de o singură moleculă de enzimă. Această mărime se numeşte raport de transformare (turnover number).
c) Influenţa temperaturii asupra vitezei reacţiei enzimatice Activitatea enzimelor este foarte mult influenţată de temperatură. Asemănător celor mai multe dintre reacţiile chimice, viteza reacţiei enzimatice creşte cu creşterea temperaturii (se dublează la creşterea temperaturii cu 10 0C). Pentru fiecare enzimă există o temperatură la care activitatea enzimatică este maximă, numită temperatură optimă (în general, cuprinsă între 20-400C. Pînă la atingerea temperaturii optime, activitatea enzimatică creşte proporţional cu creşterea temperaturii. După atingerea acestei temperaturi, activitatea enzimatică scade rapid cu creşterea temperaturii, datorită denaturării părţii proteice a enzimei, acelaşi fenomen avînd loc la scăderea temperaturii sub cea optimă (fenomene utilizate în practică la păstrarea alimentelor prin fierbere sau congelare). Cele mai multe enzime sunt inactivate la temperaturi peste 55-600C, cu excepţia enzimelor din bacteriile termofile (din izvoarele termale), active şi peste 850C. Influenţa temperaturii asupra vitezei reacţiei enzimatice este redată în figura 1.3.
Fig. 1.3. Influenţa temperaturii asupra vitezei reacţiei enzimatice
Unele enzime, cum ar fi ribonucleazele, îşi pierd activitatea la încălzire, dar şi-o regăsesc rapid la răcire, fapt care indică refacerea conformaţiei iniţiale a catenelor polipeptidice desfăcute. Temperatura critică a unei enzime este temperatura la care enzima pierde jumătate din activitatea sa, în timp de o oră. Temperatura optimă a enzimelor variază cu durata de expunere a acestora la o anumită temperatură. Pentru o durată de timp mai scurtă, temperatura optimă are valori mai mari decît pentru o perioadă de timp mai lungă. Această comportare este importantă deoarece reprezintă un mod de adaptare a enzimelor la condiţiile de mediu. Legarea enzimei de substrat măreşte rezistenţa acesteia la temperaturi ridicate. Enzimele în stare uscată sau sub formă cristalină rezistă la încălzire pînă la temperaturi de 100°C (bobul de cereală uscat suportă temperaturi mai ridicate decît acelaşi bob în stare umedă). Temperaturile joase nu distrug activitatea enzimelor ci numai o micşorează sau o opresc în mod reversibil. Soluţiile enzimatice diluate (1%) prin congelare, urmată de topire, îşi măresc activitatea enzimatică, datorită eliberării de noi centri activi din molecula enzimei, în urma proceselor de îngheţ-dezgheţ. În cazul soluţiilor concentrate, activitatea enzimatică se micşorează după îngheţ, datorită formării unor agregate moleculare care blochează centrii activi. Fiecărei enzime i se poate stabili o temperatură minimă (începînd cu 00C) la care începe activitatea enzimatică, o temperatură optimă, la care activitatea enzimatică este maximă, şi o temperatură maximă la care activitatea enzimatică încetează.
d ) Influenţa valorii pH asupra activităţii enzimatice Activitatea enzimelor este influenţată în mod accentuat şi de concentraţia ionilor de hidrogen din mediul de reacţie, deci de pH. Enzimele îşi manifestă activitatea numai între anumite limite de pH (limite inferioare şi limite superioare). Cele mai multe enzime manifestă activitate maximă la valori caracteristice ale pH-ului (pH optim). Valoarea pH-ului optim depinde de natura şi de originea enzimei, de mediul de reacţie, de proprietăţile acido-bazice ale enzimei şi de factorii biologici. Influenţa valorii pH asupra activităţii enzimatice este redată în figura 6.4.
Fig. 6.4. Influenţa valorii pH asupra activităţii enzimatice
În general, pH-ul optim coincide cu pH-ul lichidelor din organism, unde enzimele îşi exercită activitatea. Astfel, pH-ul optim al pepsinei din stomac este cuprins între 1,4-1,5; pH-ul optim al tripsinei din pancreas între 7,8-8,7; al amilazei din malţ între 4,7-5,2 etc. Majoritatea enzimelor vegetale au un pH optim cuprins între 5,3-7,6. În afara limitelor de pH stabilite, enzimele devin inactive. Valori prea mari ale pH-ului (alcalinitate mărită) sau prea mici (aciditate mărită), afectează activitatea enzimatică prin denaturarea părţii proteice sau perturbarea echilibrelor de disociere ale grupelor funcţionale ale centrului activ al enzimei, ca şi modificarea geometriei centrilor activi. Valoarea pH-ului optim este influenţată de temperatură, de ionii din soluţie, de natura şi de concentraţia substratului, de originea enzimei, de factorii biologici etc. Acţiunea pH-ului asupra activităţii enzimatice se explică prin influenţa ionilor de hidrogen asupra gradului de ionizare a enzimei şi a substratului. Unele enzime au activitate maximă sub formă nedisociată, altele sub formă disociată.
e) Influenţa activatorilor enzimatici Activatorii sunt compuşi chimici care măresc activitatea enzimelor (intervin în mecanismul acţiunii enzimatice), fie prin stimularea directă a acestora, fie prin îndepărtarea unor inhibitori din sistem. Activatorii se clasifică după efectul produs în: • Activatori care acţionează prin deblocarea centrilor activi din molecula enzimelor. Unele enzime, denumite proenzime, sunt secretate sub formă inactivă, cu grupările active blocate (mascate) de polipeptide sau de alte substanţe. Proenzimele se transformă în enzime active sub influenţa unor enzime kinaze, care îndepărtează substanţele inhibitoare. • Activatori care acţionează asupra enzimei prin înlăturarea din sistem a unor inhibitori ai enzimei. Substanţele, adăugate unei soluţii enzimatice pentru protejarea enzimei împotriva factorilor care o inactivează sau o denaturează, se numesc protectori. De exemplu, proteinele activează ureaza prin captarea ionilor inhibitori din sistem (de exemplu, ionul cianură (CN−) înlătură efectul inhibitor al Cu2+ asupra ureeazei, prin formarea cianurii complexe de cupru, stabilă). • Activatori care sunt componente ale enzimelor sau care stimulează direct activitatea acestora. Sunt activatori specifici pentru anumite enzime o serie de cationi metalici şi anioni, astfel, fosforilaza este activată de Mg2+, fosfoglucomutaza de Mg2+, şi de Mn2+, fosfataza de Ca2+ şi de Mn2+, amilaza salivară este activă numai în prezenţa ionilor de clor, proteazele vegetale sunt activate de glutationul redus etc.
f ) Inhibitori ai enzimelor Inhibitorii sunt substanţe care acţionînd asupra enzimelor, influenţează negativ desfăşurarea activităţii enzimatice pînă la anularea ei, reversibilă sau ireversibilă. Studiul inhibitorilor furnizează informaţii uti
|
||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 250; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.86.246 (0.016 с.) |