Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Adenozinmonofosfat guanozinmonofosfat citidinmonofosfat uridinmonofosfatСодержание книги
Поиск на нашем сайте
Structura secundară a acizilor ARN este reprezentată de un lanţ polinucleotidic care, pe anumite porţiuni, prezintă structură dublu spiralată, ca rezultat al plierii lanţului monocatenar şi formării legăturilor de hidrogen între bazele azotate complementare (citozină-guanină şi adenină-uracil). Stabilitatea crescută conferită macromoleculeleor de ARN datorită formării porţiunilor dublu spiralate, este determinată de pH-ul soluţiei, de forţa ionică şi de temperatură. Deoarece în structura ARN, catena macromoleculară pereche lipseşte, raporturile bazelor azotate complementare (A/U şi C/G) nu vor mai fi egale cu unitatea ca în cazul ADN. Acizii nucleici ARN se clasifică după valorile maselor moleculare, structura chimică, funcţia biologică şi rolul lor în biosinteza proteinelor în trei clase: • acizi ribonucleici mesageri, matriciali sau informaţionali (mARN, iARN); • acizi ribonucleici de transport sau solubili (tARN, sARN); • acizi ribonucleici ribozomali (rARN). a) Acizii ribonucleici mesageri, matriciali sau informaţionali Acizii mARN reprezintă o fracţiune mică (3-5%) din cantitatea totală de acizi ARN din celule. Au mase moleculare de ordinul a 20 000-300 000. Secvenţa bazelor azotate din structura polipeptidică monocatenară, liniară, a acizilor mARN este complementară cu cea a bazelor azotate din acizii ADN care au servit drept matriţă la formarea acizilor mARN. Pe baza respectării regulii complementarităţii se realizează transcrierea (transcripţia) mesajului genetic de pe ADN pe mARN. Acesta, la rîndul său, ca purtător al mesajului genetic (al informaţiei) din nucleu la suprafaţa ribozomilor (în citoplasmă), unde are loc biosinteza proteinelor, serveşte ca matriţă în procesul de biosinteză a proteinelor, determinînd secvenţa aminoacizilor în lanţul polipeptidic.
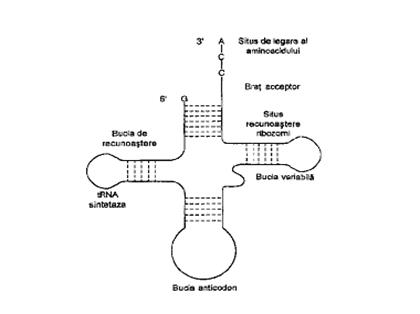
Într-un cromozom sunt mii de gene diferite. O moleculă de mARN este codificată pentru o singură genă (sau în procariote, pentru un mic grup de gene). De aceea, se formează în celule un mare număr de molecule de mARN diferite, puţin stabile, cu viaţa de la cîteva minute (2 minute în bacterii) pînă la 20 de minute sau ore, în eucariote. Destrucţia mARN reprezintă cauza principală a încetinirii sintezei proteinelor. Odată îndeplinit rolul esenţial, de participant activ la biosinteza macromoleculelor proteice, mARN dispare printr-o reacţie de hidroliză, urmînd a fi resintetizat. b) Acizii nucleici de transport sau solubili (tARN) Cele mai mici molecule de ARN (cu cele mai mici grade de polimerizare) sunt reprezentate de acizii nucleici de transport sau solubili (tARN). Sunt localizaţi în citoplasmă, reprezentînd 10-15% din cantitatea totală de acizi ARN şi au dimensiuni mici (73-93 de nucleotide) şi masa moleculară de ordinul 25 000-30 000. Rolul de bază al tARN este transportul specific al aminoacizilor la ribozomi şi identificarea codonului complementar de pe ARN, prin intermediul anticodonului, proces în urma căruia este poziţionat aminoacidul în catena polipeptidică. Fiecare acid tARN poate forma cu aminoacizii complexe aminoacid-tARN. Deoarece numărul speciilor de tARN (cca. 60) este mai mare decît numărul aminoacizilor proteinogeni (20), rezultă mai multe specii de acizi tARN (cîte 2-3) pentru fiecare aminoacid. Astfel moleculele de tARN, avînd posibilitatea de a se combina specific cu diferiţi aminoacizi, sunt implicaţi în traducerea (translaţia) şi îndeplinirea mesajului genetic, respectiv alegerea şi includerea aminoacizilor în catena polipeptidică, în ordinea dictată de mARN. Acizii tARN au o structură monocatenară, parţial dublu elicoidală. Caracteristic este faptul că, deşi speciile de tARN diferă prin secvenţa bazelor azotate, toate conţin la capătul C5’ terminal al catenei polinucleotidice restul nucleotidic GMP (guanozin monofosfat), iar la capătul C3’ (la grpa -OH) al catenei polipeptidice, o aceeaşi secvenţă de trinucleotide: CCA (acid citidilic, acid citidilic, acid adenilic), după cum este ilustrat în figura 4.4. La această trinucleotidă terminală, se leagă fiecare aminoacid, care urmează să fie transferat la nivelul ribozomilor, prin reacţia de esterificare a grupei carboxil (-COOH) a aminoacidului cu grupa hidroxil liberă (-OH) de la C3’ al acidului adenilic terminal din secvenţa CCA. Se formează astfel complexul aminoacil-tARN, care este transferat enzimatic la capătul catenei polipeptidice în curs de formare, de la suprafaţa ribozomilor.
Fig. 4.4. Structura spaţială tip „frunză de trifoi” a tARN
Locul de introducere a fiecărui aminoacid în catena macromoleculară, este dictat de anticodonul tARN (format din trei nucleotide) care recunoaşte un anumit codon mARN fixat pe ribozomi (format din trei nucleotide cu baze azotate complementare celor din anticodon). Diferitele tipuri de tARN se diferenţiază prin anticodon. Structura spaţială a tARN, care corespunde proprietăţilor şi funcţiilor sale, este cea “lobată”, tip “frunză de trifoi” (vezi figura 4.4). Acidul nucleic ARN are o structură parţial bicatenară, formată prin plierea în formă de ac de păr a unei catene macromoleculare şi formarea legăturilor de hidrogen între bazele azotate. Capătul C3’ terminal este monocatenar şi este situsul de legare a aminoacidului. Primul lob participă la legarea de enzimă a aminoacidului activat sub forma complexului AMP-aminoacid. Acest lob conţine 7 nucleotide nepereche şi constituie situsul de recunoaştere ribozomal, care asigură legarea tARN încărcat cu aminoacizi de ribozomi. Semnificaţia lobului II, cu dimensiuni variabile, nu este încă elucidată. Lobul III, reprezintă lobul anticodonului, constituit tot din 7 nucleotide, ale căror baze azotate sunt neоmperecheate. Aici se găseşte anticodonul între o purină la capătul C3’ şi uracil la capătul C5’. Lobul IV are rol în legarea complexului aminoacil-tARN la suprafaţa ribozomului. Un rol esenţial în structura tARN prezintă anticodonul, o tripletă de baze complementare unui codon de pe mARN. Astfel, dacă codonul de pe mARN este UUU (corespunzător fenilalaninei), anticodonul corespunzător acestuia pe molecula tARN va fi AAA. Important este că, molecula de tARN va accepta doar fenilalanina. Deoarece sunt cunoscuţi doar 61 de codoni, fiecare reprezentînd cîte un aminoacid, pentru a-i translata, este de aşteptat să existe 61 de molecule de tARN diferite, fiecare cu anticodonul sau, complementar cîte unui codon, corespunzător unui aminoacid. De fapt sunt mai puţin de 61 de specii de tARN, cel puţin cîte una pentru fiecare din cei 20 de aminoacizi, deşi unele molecule de tARN pot recunoaşte mai mulţi codoni. Locul de introducere în catena polipeptidică este dictat de anticodonul t-ARN care recunoaşte un anumit codon de pe mARN fixat pe ribozomi. c) Acizii nucleici ribozomali (rARN) Majoritatea acizilor ARN (pînă la 80%) este reprezentată de acidul ARN ribozomal (rARN), prezent în ribozomii citoplasmei celulare. Acidul nucleic rARN nu se găseşte în stare liberă, ci combinat cu proteine sub forma unor complexe ribonucleoproteice, constituind componente ale ribozomilor, la suprafaţa cărora are loc biosinteza proteinelor. Ribozomii sunt particule mici, prezente în număr mare în celule, implicaţi în biosinteza proteinelor. Numele lor provine de la conţinutul în acid ribonucleic ARN (60% din conţinutul оn solide). Ribozomii se leagă reversibil atît de mARN cît şi de tARN. Acizii nucleici rARN au masă moleculară mare (600 000-1 200 000), datorită gradului de polimerizare ridicat şi o structură monocatenară, parţial dublu helicoidală (prin plierea catenei macromoleculare), caracterizată prin formarea de legături de hidrogen între bazele azotate complementare. Acizii rARN au aceiaşi compoziţie indiferent de celulele din care provin, vegetale sau animale.
II. SUBSTANŢE ORGANICE ACTIVE ALE ORGANISMELOR II.1 VITAMINE Vitaminele, alături de enzime şi hormoni, formează o familie de substanţe organice cu structură chimică foarte diferită, fără valoare plastică sau energetică, dar care joacă un rol catalitic important în organism, în cantităţi extrem de mici intervenind în stimularea şi reglarea proceselor metabolice ale organismului. Marea majoritate a vitaminelor sunt sintetizate numai de organismul vegetal. Organismul animal şi uman ia aceste substanţe indispensabile odată cu alimentele vegetale, fie sub formaă de vitamine propriu-zise, fie sub formă de provitamine, pe care le converteşte apoi în forma activă de vitamine propiuzise. Aproape fiecare vitamină este o componentă structurală activă a unei enzime sau a unui grup de enzime, îndeplinind rolul de coenzime, sau deactivatori enzimatici şi justificînd astfel încadrarea lor în clasa biocatalizatorilor. Unele vitamine sunt constituente ale unor importante sisteme de oxido-reducere, implicate în procesele metabolice ale glucidelor, lipidelor şi protidelor, reglează potenţialul redox celular, contribuie la transportul hidrogenului pe cale neenzimatică (vitaminele C, E, K etc.). Prima vitamină a fost descoperită de Funk (1911), care a izolat din tărîţele de orez o substanţă capabilă să vindece boala beri-beri (vitamina B1), pe care a numit-o vitamină (amină vitală). Vitaminele sunt răspîndite în forme direct asimilabile în: frunze, fructe, seminţe (mai ales în stare de germinare), polen, drojdie de bere, ouă, carne, lapte; alte vitamine se găsesc în compuşi chimici cu structură premergătoare vitaminelor (provitamine) care acţionează ca vitamine numai în urma unor transformări chimice. De exemplu, vitaminele A rezultă din provitaminele caroteni, vitamina D2 din provitamina ergosterol. Se cunosc şi compuşi naturali, care fără să fie vitamine, manifestă acţiune similară lor, şi poartă numele de substanţe vitagene, cum ar fi: diferiţi aminoacizi esenţiali, acizi graşi esenţiali, colina, betaina etc. Pe de altă parte sunt cunoscuţi şi analogi structurali ai vitaminelor, dar cu acţiune antagonică, care anihilează total sau parţial acţiunea vitaminelor, substanţe denumite antivitamine. Vitaminele sunt substanţe organice care se găsesc în cantităţi mici în alimente şi sunt indispensabile pentru creşterea şi dezvoltarea normală a organismelor. Lipsa (carenţa) sau insuficienţa vitaminelor în organism determină tulburări metabolice şi apariţia unor boli carenţiale cunoscute sub numele de hipovitaminoze sau avitaminoze. Hipervitaminoza este mai rară şi se instalează doar în cazul unei dozări necorespunzătoare a vitaminelor (mai ales a celor liposolubile), în vitaminoterapie. Sub aspect chimic, vitaminele sunt substanţe micromoleculare cu structură chimică foarte heterogenă. Ca element comun se poate semnala prezenţa unor grupări funcţionale esterificabile în molecula lor. În prezent, se poate sintetiza majoritatea vitaminelor cunoscute, care se utilizează în medicină ca factori profilactici şi curativi. În condiţii normale de alimentaţie, de regulă, necesarul omului sănătos este pe deplin acoperit printr-o hrană variată. Unul şi acelaşi aliment, de obicei, este bogat numai într-o singură vitamină: de exemplu – morcovul – în caroten; citricele –în vitamina C şi P; carnea – în acid nicotinic; etc. Prin urmare, pentru păstrarea sănătaţii omului, o mare importanţă o are utilizarea unor produse variate, în special, de natură vegetală, dar şi animală. Sunt alimente care conţin aproape toate vitaminele necesare organismului în crestere (laptele, oul). Însă, chiar din acest produs ideal– aptele–lipseste vitamina E şi se găseşte puţină vitamina D. Drojdiile conţin multe vitamine, însă utilizarea lor este posibilă numai după tratarea termică, deoarece drojdiile vii nu sunt descompuse de enzimele digestive. Deci, echilibrarea corectă a alimentaţiei asigură organismului uman un complex de vitamine.
NOMENCLATURĂ ŞI CLASIFICARE Denumirea de vitamine (amine vitale) atribuită de Funk acestei grupe de substanţe se menţine şi în prezent, deşi unele vitamine nu conţin în molecula lor azot. Nomenclatura vitaminelor se poate stabili după trei criterii: • nomenclatura veche; • rolul fiziologic; • structura chimică. Conform vechii nomenclaturi, vitaminele continuă să se denumească şi în prezent cu ajutorul literelor mari din alfabetul latin (A, B, C, D, E, F etc.). În cadrul aceleiaşi clase, vitaminele se denumesc cu ajutorul indicilor (A1, A2, B1, B2, B6, D2, D3 etc.) După rolul fiziologic îndeplinit în organism, vitaminele se denumesc: vitamina antixeroftalmică (vitamina A), vitamina antiscorbutică (vitamina C), vitamina antirahitică (vitamina D) etc. După structura chimică se denumesc: tiamina (vitamina B1), riboflavina (vitamina B2), acid ascorbic (vitamina C), piridoxina (vitamina B6) etc. Deoarece, datorită structurii lor heterogene, nu există un criteriu structural de clasificare a vitaminelor, se recurge la clasificarea vitaminelor pe baza solubilităţii lor: • vitamine liposolubile, insolubile în apă, solubile în solvenţi organici, grăsimi; • vitamine hidrosolubile, solubile în apă, insolubile în solvenţi organici.
|
||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 292; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.24.145 (0.007 с.) |