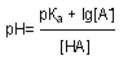Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Зона буферного действия и буферная емкость. Расчет рН протолитических системСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Реакция среды в растворе конкретной БС зависит от двух факторов: Кдисс слабого электролита и соотношения компонентов. Значение рН БС может быть рассчитано по уравнению Гендерсона-Гассельбаха:
где рКа – показатель кислотности слабой кислоты (справочная, константная величина, например, для уксусной кислоты он равен +4,76), [A-] – концентрация соли [HA] – концентрация слабой кислоты. Используя уравнение Гендерсона-Гассельбаха можно приготовить буфер с заданным значением рН. Способность буфера к сохранению рН не беспредельна, она определяется концентрацией компонентов и их соотношением. Количественно эта способность характеризуется величиной буферной ёмкости. Буферная ёмкость – это количество молей любой сильной кислоты или щёлочи, которое необходимо добавить к 1 л буферного раствора для смещения его рН на 1. Буферная ёмкость тем выше, чем больше концентрация компонентов и чем ближе их соотношение к единице. Буферная емкость (В) измеряется количеством моль или ммоль эквивалента кислоты или щелочи, добавление которого к 1 л буферного раствора изменяет рН на единицу. В=C×V/∆pH×Vбуф, где В - буферная емкость, С - концентрация кислоты или основания, V - объем данного электролита, Vбуф – объем буферного раствора, ∆pH – изменение рН. Буферная емкость зависит от ряда факторов: 1. Чем выше концентрации компонентов буферного раствора, тем больше его буферная емкость. 2. Буферная емкость зависит от отношения концентраций компонентов, а, следовательно, и от рН буфера. При рН=рКа буферная емкость максимальна. 3. Установлено, что достаточное буферное действие наблюдается, если концентрация одного из компонентов превышает концентрацию другого не более, чем в 10 раз. Интервал рН=рКа±1 называется зоной буферного действия. 4. При разбавлении буферного раствора величина буферной емкости уменьшается вследствие снижения концентрации компонентов раствора.
Табл. 4.2 Буферная ёмкость систем организма
Как следует из данных Таб. 4.2, буферная емкость по кислоте у буферных систем организма выше, чем буферная емкость по основанию. Это связано с особенностями метаболизма человеческого организма, образующего значительно больше кислотных продуктов, чем основных.
Механизм действия буферных систем
Механизм буферного действия рассмотрим на примере ацетатной БС: СН3СООН/СН3СОО- +Na+, где СН3СООН – слабая кислота, а СН3СОО-+Na+ - соль, образованная сильным основанием (NaOH). При добавлении: а) сильной кислоты (избытка протонов) ацетат-анион связывает этот избыток протонов (т.е. проявляет свойства основания) с образованием эквивалентного количества слабой уксусной кислоты: СН3СОО- + Н+ ↔ СН3СООН Несмотря на увеличение общей кислотности, активная кислотность вырастет мало, так как оно произошло за счёт увеличения концентрации слабой кислоты, степень диссоциации которой понизится согласно закону Оствальда. б) сильного основания (щёлочи, избытка ОН--анионов) она нейтрализуется за счёт резервной кислотности: СН3СООН + ОН- ↔ СН3СОО- + Н2О. Активная кислотность при этом изменяется незначительно, так как согласно закону Оствальда уменьшение концентрации слабой кислоты приводит к росту степени её диссоциации. Обратите внимание, что катион металла, входящего в состав соли, не принимает участие в буферном действии. При разбавлении и концентрировании рН не изменяется, так как остаётся прежним соотношение компонентов БС.
Буферные системы крови: гидрокарбонатная, фосфатная, Гемоглобиновая, белковая Бикарбонатная (гидрокарбонатная) БС (Н2СО3/НСО3-) – мощная система плазмы крови, составляющая примерно 10% от её общей буферной ёмкости. В норме соотношение компонентов (гидрокарбонат-анион / угольная кислота) равно 20. Механизм действия бикарбонатной БС в организме аналогичен таковому ацетатной БС, с той лишь разницей, что при увеличении концентрации угольной кислоты, она интенсивно разлагается под действием фермента карбангидразы: Н2СО3 ↔ Н2О + СО2↑. Образующийся при этом углекислый газ удаляется с выдыхаемым воздухом. Фосфатная БС. Образована двумя ионами: гидро- и дигидрофосфат-анионами: НРО42-/Н2РО4- Первый из них выполняет роль соли, второй – слабой кислоты. На долю фосфатной БС приходится примерно 1% буферной ёмкости крови. Механизм её действия аналогичен описанному выше.
Белковая БС имеет меньшее значение в поддержании рН. Благодаря амфотерным свойствам белков, состав белковой БС условно можно представить, как белок-кислоту (НООС–Pr–NH3+) и белок-основание (-ООС–Pr–NH2), где Pr – протеин (белок). При добавлении в систему протонов они последовательно будут связываться с оснόвными группами: -ООС–Pr–NH2+ Н+ → -ООС–Pr–NH3+, -ООС–Pr–NH3+ + Н+ → НООС–Pr–NH3+. При добавлении в систему гидроксид-ионов они последовательно будут нейтрализоваться протонами, отщепляющимися от кислотных групп: НООС–Pr–NH3+ + ОН- → -ООС–Pr–NH3+ + Н2О, -ООС–Pr–NH3+ + ОН- → -ООС–Pr–NH2 + Н2О. Гемоглобиновая БС – самая мощная в организме. Она действует в эритроцитах, обеспечивая примерно 76% буферной ёмкости крови. Она состоит из 2 сопряжённых кислотно-основных пар: HHb и H++HbO2- K++Hb- и K++HbO2-, где HHb – дезоксигемоглобин, K++Hb- - его калиевая соль; H++ HbO2- - оксигемоглобин, являющийся более сильной кислотой, чем дезоксигемоглобин, а K++HbO2- - калиевая соль оксигемоглобина. Действует гемоглобиновая БС согласованно в периферических тканях и лёгких. В лёгочных капиллярах при высоком парциальном давлении кислорода гемоглобин на 98% насыщается кислородом, образуя оксигемоглобин. Оксигемоглобин как более сильная кислота, чем угольная, вытесняет её из гидрокабонат-аниона, поступающего из периферических тканей. Выделившаяся угольная кислота под действием фермента карбангидразы разлагается на воду и углекислый газ, удаляемый с выдыхаемым воздухом: HHb + О2 → H+ + HbO2- H+ + HbO2- + К+ + НСО3- → K+ + HbO2- + Н2СО3; Н2СО3 →Н2О + СО2↑. В капиллярах периферических тканей, при низком парциальном давлении кислорода последний освобождается и используется в процессах биологического окисления. Дезоксигемоглобин, будучи более слабой кислотой, чем угольная, образует молекулярную форму: K++H++HbO2- → K+ + HHb + О2. Источником протонов и гидрокарбонат-анионов является угольная кислота, образующаяся в периферических тканях из продуктов метаболизма – воды и углекислого газа. Следует обратить внимание, что гемоглобиновая БС является плазменно-клеточной и действует совместно с бикарбонатной.
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 1171; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.145.97 (0.011 с.) |